Expert médical de l'article
Nouvelles publications
Atrésie de l'œsophage
Dernière revue: 12.07.2025

Tout le contenu iLive fait l'objet d'un examen médical ou d'une vérification des faits pour assurer autant que possible l'exactitude factuelle.
Nous appliquons des directives strictes en matière d’approvisionnement et ne proposons que des liens vers des sites de médias réputés, des instituts de recherche universitaires et, dans la mesure du possible, des études évaluées par des pairs sur le plan médical. Notez que les nombres entre parenthèses ([1], [2], etc.) sont des liens cliquables vers ces études.
Si vous estimez qu'un contenu quelconque de notre contenu est inexact, obsolète ou discutable, veuillez le sélectionner et appuyer sur Ctrl + Entrée.
L'atrésie de l'œsophage (AE) est une malformation congénitale dans laquelle l'œsophage se termine de manière aveugle à une distance d'environ 8 à 12 cm de l'entrée de la cavité buccale.
La fistule trachéo-œsophagienne congénitale sans atrésie est un canal pathologique tapissé de tissu de granulation ou d'épithélium, faisant communiquer la lumière inchangée de l'œsophage avec la lumière de la trachée.
L'atrésie de l'œsophage est le type le plus courant d'atrésie gastro-intestinale.
Épidémiologie
L'atrésie de l'œsophage est une malformation congénitale du tractus gastro-intestinal supérieur dont la prévalence mondiale est estimée entre 1 sur 2 500 et 1 sur 4 500 naissances.[ 1 ] Aux États-Unis, la prévalence est estimée à 2,3 pour 10 000 naissances vivantes.[ 2 ] L'incidence relative de l'atrésie de l'œsophage augmente avec l'âge maternel.[ 3 ],[ 4 ]
Causes atrésie de l'œsophage
L'étiologie de l'atrésie de l'œsophage avec ou sans fistule trachéo-œsophagienne associée est l'incapacité à séparer ou à développer incomplètement l'intestin antérieur.[ 5 ] Le trajet de la fistule provient d'une branche du rudiment pulmonaire embryonnaire qui ne parvient pas à se ramifier en raison d'interactions épithéliales-mésenchymateuses défectueuses.
Plusieurs gènes ont été associés à l'atrésie de l'œsophage, notamment Shh, [ 6 ] SOX2, CHD7, MYCN et FANCB. Cependant, l'étiologie n'est pas entièrement élucidée et est probablement multifactorielle. Les patients peuvent être diagnostiqués avec un AP/TPS isolé ou faisant partie d'un syndrome tel que VACTERL ou CHARGE.
Pathogénèse
L'œsophage est un tube musculaire qui transporte le bol alimentaire du pharynx à l'estomac. Il provient de la couche germinale de l'endoderme qui forme le pharynx, l'œsophage, l'estomac et les lignes épithéliales des voies aérodigestives. La trachée et l'œsophage naissent de la division d'un tube digestif antérieur commun au début du développement fœtal. [ 7 ] L'absence de séparation ou de développement complet de ce tube digestif antérieur commun peut entraîner une fistule trachéo-œsophagienne (FTO) et une atrésie de l'œsophage (AE). Avant la naissance, les patientes atteintes d'atrésie de l'œsophage peuvent présenter un polyhydramnios, principalement au troisième trimestre, ce qui peut être un indice diagnostique d'atrésie de l'œsophage.
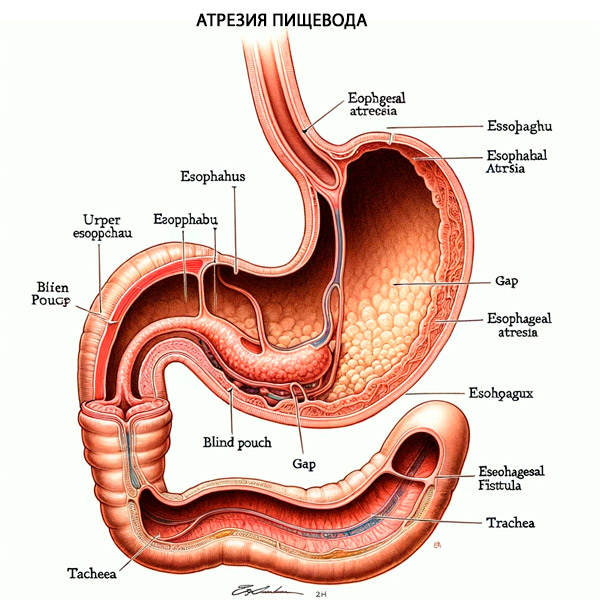
Français De plus, environ 50 % des patients atteints de TPS/EA présenteront des anomalies congénitales associées, notamment VACTERL (anomalies vertébrales, atrésie anale, anomalies cardiaques, fistule trachéo-œsophagienne, anomalies rénales et anomalies des membres) ou CHARGE ( colobome, anomalies cardiaques, atrésie des choanes, retard de croissance, anomalies génitales et anomalies de l'oreille). Après la naissance du nouveau-né, les symptômes les plus courants de l'atrésie de l'œsophage sont une salivation excessive, une suffocation et une incapacité à passer une sonde nasogastrique. De plus, en cas de TPS associé, une distension gastrique se produira lorsque l'air passera de la trachée à travers la fistule œsophagienne distale, puis dans l'estomac.
Les patients présentant ce complexe de symptômes doivent subir une évaluation accélérée pour une atrésie de l’œsophage et une fistule trachéo-œsophagienne et être rapidement orientés vers un niveau de soins supérieur pour une évaluation par un chirurgien pédiatrique.
Physiopathologie
La fistule trachéo-œsophagienne et l'atrésie œsophagienne résultent d'une division latérale défectueuse de l'intestin antérieur en œsophage et trachée. Le trajet fistuleux entre l'œsophage et la trachée peut se former secondairement en raison d'interactions épithéliales-mésenchymateuses défectueuses. [6] La fistule trachéo-œsophagienne et l'atrésie œsophagienne sont présentes ensemble dans environ 90 % des cas. L'atrésie œsophagienne et la fistule trachéo-œsophagienne sont classées en cinq catégories selon leur configuration anatomique. [ 8 ]
- Le type A est une atrésie œsophagienne isolée sans fistule trachéo-œsophagienne associée, dont la prévalence est de 8 %.
Les œsophages proximal et distal se terminent en aveugle et ne sont pas reliés à la trachée. L'œsophage proximal est dilaté, à paroi épaisse et se termine généralement plus haut dans le médiastin postérieur, près de la deuxième vertèbre thoracique. L'œsophage distal est court et se termine à des distances variables du diaphragme. La distance entre les deux extrémités déterminera la possibilité d'une réparation primaire (rare) ou la nécessité d'une anastomose primaire différée ou d'un remplacement œsophagien. Dans ces cas, il est important d'exclure une fistule trachéo-œsophagienne proximale.
- Le type B est une atrésie de l'œsophage avec fistule trachéo-œsophagienne proximale. Il s'agit du type le plus rare, avec une prévalence de 1 %.
Cette anomalie rare doit être distinguée de la forme isolée. La fistule n'est pas située à l'extrémité distale du sac œsophagien supérieur, mais 1 à 2 cm au-dessus de son extrémité, sur la paroi antérieure de l'œsophage.
- L'atrésie œsophagienne de type C est la plus courante (84 à 86 %) et implique une atrésie œsophagienne proximale avec une fistule trachéo-œsophagienne distale.
Il s'agit d'une atrésie caractérisée par une dilatation de l'œsophage proximal et un épaississement de sa paroi musculaire, aboutissant à un aveuglement dans le médiastin supérieur, à peu près au niveau de la troisième ou de la quatrième vertèbre thoracique. L'œsophage distal, plus fin et plus étroit, pénètre dans la paroi postérieure de la trachée au niveau de la carène ou, plus fréquemment, à un ou deux centimètres en amont de la trachée. La distance entre l'œsophage proximal aveugle et la fistule trachéo-œsophagienne distale varie, allant de segments chevauchants à une large fente. Très rarement, la fistule distale peut être occluse ou oblitérée, ce qui peut conduire à un diagnostic erroné d'atrésie isolée avant l'intervention chirurgicale.
- Type D - atrésie de l'œsophage avec fistule trachéo-œsophagienne proximale et distale, rare - environ 3 %
Chez de nombreux nourrissons, l'anomalie a été diagnostiquée à tort et traitée comme une atrésie proximale et une fistule distale. Suite à des infections respiratoires récurrentes, une fistule trachéo-œsophagienne, auparavant confondue avec une fistule récidivante, a été identifiée à l'examen. Grâce au recours croissant à l'endoscopie préopératoire (bronchoscopie et/ou œsophagoscopie), la fistule « double » peut être détectée précocement et complètement réparée dès la première intervention. Si une fistule proximale n'est pas identifiée en préopératoire, le diagnostic doit être suspecté en raison d'une importante fuite de gaz provenant de la poche supérieure lors de l'anastomose.
- L'atrésie œsophagienne de type E est une fistule trachéo-œsophagienne isolée sans atrésie œsophagienne associée. Elle est appelée type « H » et sa prévalence est d'environ 4 %.
Il existe une fistule reliant l'œsophage anatomiquement intact à la trachée. Le trajet fistuleux peut être très étroit, de 3 à 5 mm de diamètre, et se situe généralement dans la région cervicale inférieure. Les fistules sont généralement uniques, mais deux, voire trois, ont été décrites.
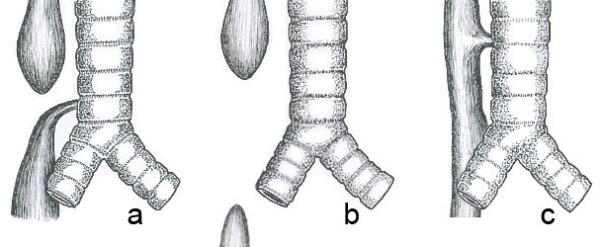
Types anatomiques courants d'atrésie de l'œsophage. a) Atrésie de l'œsophage avec fistule trachéo-œsophagienne distale (86 %). b) Atrésie de l'œsophage isolée sans fistule trachéo-œsophagienne (7 %). c) Fistule trachéo-œsophagienne de type H (4 %)
Symptômes atrésie de l'œsophage
Chez environ un tiers des fœtus, l'atrésie de l'œsophage et la fistule trachéo-œsophagienne sont diagnostiquées avant la naissance. Le signe échographique le plus fréquent d'atrésie de l'œsophage est l'hydramnios, qui survient dans environ 60 % des grossesses. [ 9 ] Si le diagnostic est prénatal, la famille peut être conseillée sur les attentes postnatales.
Cependant, dans de nombreux cas, le diagnostic n'est posé qu'à la naissance. Les nourrissons atteints d'atrésie de l'œsophage présentent des symptômes peu après la naissance, avec une augmentation des sécrétions entraînant un étouffement, une détresse respiratoire ou des épisodes de cyanose pendant la tétée. Dans l'atrésie de l'œsophage, une fistule entre la trachée et l'œsophage distal provoque un remplissage de l'estomac par des gaz sur la radiographie pulmonaire. Les nourrissons atteints d'atrésie de l'œsophage de types A et B ne présenteront pas de distension abdominale, car il n'y a pas de fistule reliant la trachée à l'œsophage distal. Les nourrissons atteints d'une fistule trachéo-œsophagienne peuvent refluer le contenu de l'estomac par la fistule dans la trachée, entraînant une pneumonie par aspiration et une détresse respiratoire. Chez les patients atteints d'atrésie de l'œsophage de type E, le diagnostic peut être retardé si la fistule est petite.[ 10 ]
Où est-ce que ça fait mal?
Qu'est ce qui te tracasse?
Formes
Il existe environ 100 variantes connues de ce défaut, mais trois des plus courantes sont:
- atrésie de l'œsophage et fistule entre l'œsophage distal et la trachée (86-90 %),
- atrésie œsophagienne isolée sans fistule (4-8 %),
- fistule trachéo-oesophagienne, type H (4%).
Dans 50 à 70 % des cas d’atrésie de l’œsophage, on observe des anomalies du développement combinées:
- malformations cardiaques congénitales (20 à 37 %),
- anomalies du tractus gastro-intestinal (20-21 %),
- anomalies du système génito-urinaire (10 %),
- défauts musculo-squelettiques (30 %),
- défauts craniofaciaux (4%).
Dans 5 à 7 % des cas, l'atrésie de l'œsophage s'accompagne d'anomalies chromosomiques (trisomies 18, 13 et 21). Une combinaison particulière d'anomalies du développement dans l'atrésie de l'œsophage est désignée par le terme « VATER » (initiales latines des anomalies du développement suivantes, 5 à 10 %):
- défauts de la colonne vertébrale (V),
- défauts anaux (A),
- fistule trachéo-œsophagienne (T),
- atrésie de l'œsophage (E),
- défauts osseux du radius (R).
30 à 40 % des enfants atteints d’atrésie de l’œsophage sont prématurés ou présentent un retard de croissance intra-utérin. [ 11 ], [ 12 ]
Complications et conséquences
Des complications chirurgicales peuvent survenir après la réparation d'une atrésie de l'œsophage. La complication la plus redoutée est la fuite anastomotique œsophagienne.[ 13 ] Les petites fuites peuvent être traitées par drainage thoracique et une NPO prolongée jusqu'à leur correction. En cas de fuite importante ou de fuite anastomotique, une réintervention et une résection œsophagienne avec interposition d'un greffon gastrique, colique ou jéjunal peuvent être nécessaires.
Une autre complication potentielle est la sténose anastomotique œsophagienne. Celles-ci sont généralement traitées par des dilatations œsophagiennes endoscopiques en série.[ 14 ] Enfin, bien que rare, une fistulisation récurrente de l'œsophage et de la trachée a été rapportée. Ces problèmes sont traités par une réintervention.
Les complications non chirurgicales de l'atrésie œsophagienne et de la fistule trachéo-œsophagienne sont fréquentes. L'utilisation d'inhibiteurs de la pompe à protons est recommandée pendant au moins un an après la réparation de l'atrésie œsophagienne en raison d'une dysmotilité œsophagienne, qui entraîne une augmentation du reflux gastro-œsophagien (RGO) et un risque d'aspiration.[ 15 ] La trachéomalacie est fréquente après une intervention chirurgicale. Les nouveau-nés présentant une atrésie œsophagienne et une fistule trachéo-œsophagienne présentent généralement une incidence accrue de dysphagie, d'infections des voies respiratoires et d'œsophagite.[ 16 ]
En raison d'un taux élevé de RGO pendant l'enfance et l'âge adulte, ces enfants ont une incidence plus élevée d'œsophage de Barrett et un risque plus élevé de cancer de l'œsophage par rapport à la population générale.[ 17 ] Des protocoles de dépistagedu cancer de l'œsophage sont recommandés chez ces patients, bien que cela soit controversé.
Diagnostics atrésie de l'œsophage
L'atrésie de l'œsophage est généralement diagnostiquée lorsqu'une sonde orogastrique ne peut être introduite. La sonde ne descend pas jusqu'à l'estomac et peut être observée enroulée au-dessus de l'atrésie de l'œsophage sur une radiographie pulmonaire. Le diagnostic définitif peut être posé par l'injection d'une petite quantité de produit de contraste hydrosoluble dans la sonde orogastrique sous contrôle fluoroscopique. Le baryum doit être évité, car il peut provoquer une pneumopathie chimique en cas d'aspiration pulmonaire.Une œsophagoscopie ou une bronchoscopie pour détecter une fistule trachéale peut être utilisée pour confirmer le diagnostic.[ 18 ]
Un nouveau-né présentant une atrésie de l'œsophage et une fistule trachéo-œsophagienne nécessite une évaluation pour des anomalies VACTERL et CHARGE, car elles peuvent survenir chez jusqu'à 50 % des nouveau-nés. Plus précisément, une évaluation complète nécessite une échocardiographie cardiaque, des radiographies des extrémités et de la colonne vertébrale, une échographie rénale et un examen physique approfondi de l'anus et des organes génitaux pour détecter toute anomalie. Une vaste étude monocentrique menée aux États-Unis a examiné les anomalies congénitales les plus courantes associées à l'atrésie de l'œsophage et à la fistule trachéo-œsophagienne. Parmi près de 3 000 patients, les diagnostics VACTERL associés comprenaient des anomalies vertébrales chez 25,5 %, des malformations ano-rectales chez 11,6 %, des malformations cardiaques congénitales chez 59,1 %, une maladie rénale chez 21,8 % et des malformations des membres chez 7,1 %. [ 19 ] Près d'un tiers présentaient 3 anomalies ou plus et répondaient aux critères d'un diagnostic VACTERL.
Qu'est-ce qu'il faut examiner?
Comment examiner?
Diagnostic différentiel
Les diagnostics différentiels incluent les fentes laryngées, trachéales et œsophagiennes, les septa ou anneaux œsophagiens, les sténoses œsophagiennes, les duplications tubulaires œsophagiennes, l'œsophage court congénital et l'agénésie trachéale. Ces diagnostics peuvent être approfondis grâce à diverses techniques d'imagerie, allant des radiographies et scanners à l'endoscopie et à la chirurgie.
Qui contacter?
Traitement atrésie de l'œsophage
Une fois le diagnostic d'atrésie de l'œsophage posé, le nourrisson doit être intubé afin de contrôler les voies aériennes et d'éviter toute nouvelle aspiration. Si ce n'est pas déjà fait, un cathéter doit être inséré délicatement pour aspirer les sécrétions oropharyngées. Le nourrisson doit recevoir des antibiotiques, des liquides intraveineux et ne rien prendre par voie orale. Une nutrition parentérale totale (NPT) doit être envisagée. Une fois l'état hémodynamique et les voies aériennes stabilisés, un chirurgien pédiatrique doit être consulté.
Le moment du traitement chirurgical définitif de l'atrésie de l'œsophage dépend de la taille du nourrisson. Si le poids du nourrisson est supérieur à 2 kg, la chirurgie est généralement proposée après correction des anomalies cardiaques, le cas échéant. Les nourrissons de très faible poids de naissance (< 1 500 grammes) sont généralement traités par étapes, avec une ligature initiale de la fistule, suivie d'une réparation de l'atrésie de l'œsophage à mesure que le nourrisson grandit.[ 20 ]
Les options chirurgicales pour la réparation de l'atrésie de l'œsophage comprennent la thoracotomie ouverte ou la chirurgie thoracoscopique vidéo-assistée.[ 21 ] Les étapes sont les mêmes dans les deux chirurgies. La fistule entre l'œsophage et la trachée est identifiée et sectionnée. Un bronchoscope peut être utilisé pour visualiser l'origine de la fistule dans la trachée. Une fois la fistule ligaturée, l'atrésie de l'œsophage est réparée. Généralement, une petite sonde nasogastrique est placée pour croiser les deux extrémités, et les extrémités sont suturées avec du fil résorbable si elles peuvent être atteintes sans trop de tension. Si les extrémités de l'œsophage sont sous trop de tension ou ne peuvent être atteintes, la technique de Foker peut être utilisée.[ 22 ] Cette technique utilise des sutures de traction sur les extrémités de l'œsophage et les rapproche lentement. Une fois les extrémités réunies sans tension, la réparation primaire peut être effectuée.
S'il existe une déchirure œsophagienne extra-longue qui empêche l'anastomose primaire, l'insertion d'un autre organe tel que l'estomac, le côlon ou le jéjunum peut être utilisée.[ 23 ] Les patients atteints d'atrésie œsophagienne de type E « type H » peuvent être traités par une incision cervicale haute et éviter la thoracotomie pour la ligature de la fistule.[ 24 ] La gastrostomie n'est généralement pas indiquée à moins que l'anastomose primaire n'ait échoué.
Après l'intervention, le nourrisson est réintégré en unité de soins intensifs néonatals pour une surveillance étroite. Un drain thoracique est laissé en place du côté où le thorax a été abordé. Le nourrisson continue de recevoir une nutrition parentérale totale par sonde nasogastrique avec aspiration intermittente. Une œsophagographie est réalisée après 5 à 7 jours afin de rechercher une fuite œsophagienne. En l'absence de fuite, une alimentation orale est généralement instaurée. En cas de fuite, le drain thoracique recueillera le drainage. Le drain thoracique est laissé en place jusqu'à la fermeture de la fuite et/ou jusqu'à ce que le nourrisson tolère l'alimentation orale.
Prévoir
Le pronostic des nouveau-nés atteints d'atrésie œsophagienne et de fistule trachéo-œsophagienne est relativement bon et dépend principalement des anomalies cardiaques et chromosomiques plutôt que de l'atrésie œsophagienne elle-même. En général, la survie globale est d'environ 85 à 90 %.[ 25 ] Une mortalité plus élevée est observée lorsque des anomalies cardiaques concomitantes sont présentes en plus de l'atrésie œsophagienne. Les décès précoces sont associés à des anomalies cardiaques, tandis que les décès tardifs sont associés à des complications respiratoires. La distance entre les deux poches œsophagiennes, surtout si elle est grande, peut déterminer le pronostic.[ 26 ] Tous les nouveau-nés subissant une réparation d'atrésie œsophagienne auront des problèmes gastro-intestinaux et respiratoires attendus, qui s'améliorent généralement avec l'âge.
Sources
- Nasr T, Mancini P, Rankin SA, Edwards NA, Agricola ZN, Kenny AP, Kinney JL, Daniels K, Vardanyan J, Han L, Trisno SL, Cha SW, Wells JM, Kofron MJ, Zorn AM. Le remodelage épithélial médié par les endosomes en aval de la glioblastome Hedgehog est nécessaire à la séparation trachéo-œsophagienne. Dev Cell. 16 déc. 2019; 51(6): 665-674.e6.
- Pretorius DH, Drose JA, Dennis MA, Manchester DK, Manco-Johnson ML. Fistule trachéo-œsophagienne in utero. Vingt-deux cas. J Ultrasound Med. 1987 Sep;6(9):509-13.
- Cassina M, Ruol M, Pertile R, Midrio P, Piffer S, Vicenzi V, Saugo M, Stocco CF, Gamba P, Clementi M. Prévalence, caractéristiques et survie des enfants atteints d'atrésie de l'œsophage: une étude de population de 32 ans incluant 1 417 724 nouveau-nés consécutifs. Birth Defects Res A Clin Mol Teratol. 2016 juill. 106(7):542-8.
- Karnak I, Senocak ME, Hiçsönmez A, Büyükpamukçu N. Le diagnostic et le traitement de la fistule trachéo-œsophagienne de type H. J Pediatr Surg. 1997 déc.;32(12):1670-4.
- Scott DA, Atrésie de l'œsophage et fistule trachéo-œsophagienne – Chapitre retiré, pour référence historique uniquement. Dans: Adam MP, Feldman J, Mirzaa GM, Pagon RA, Wallace SE, Bean LJH, Gripp KW, Amemiya A, éditeurs. GeneReviews® [Internet]. Université de Washington, Seattle; Seattle (WA): 12 mars 2009.
- Crisera CA, Grau JB, Maldonado TS, Kadison AS, Longaker MT, Gittes GK. Des interactions épithéliales-mésenchymateuses défectueuses déterminent l'organogenèse de la fistule trachéo-œsophagienne. Pediatr Surg Int. 2000;16(4):256-61.
- Spitz L. Atrésie de l'œsophage. Orphanet J Rare Dis. 11 mai 2007; 2:24.
- Lupo PJ, Isenburg JL, Salemi JL, Mai CT, Liberman RF, Canfield MA, Copeland G, Haight S, Harpavat S, Hoyt AT, Moore CA, Nembhard WN, Nguyen HN, Rutkowski RE, Steele A, Alverson CJ, Stallings EB, Kirby RS., et le Réseau national de prévention des anomalies congénitales. Données sur les anomalies congénitales basées sur la population aux États-Unis, 2010-2014: un focus sur les anomalies gastro-intestinales. Birth Defects Res. 1er novembre 2017; 109(18): 1504-1514.
- Clark DC. Atrésie de l'œsophage et fistule trachéo-œsophagienne. Am Fam Physician. 15 février 1999; 59(4): 910-6, 919-20.
- Lautz TB, Mandelia A, Radhakrishnan J. Associations VACTERL chez les enfants subissant une intervention chirurgicale pour une atrésie de l'œsophage et des malformations anorectales: implications pour les chirurgiens pédiatriques. J Pediatr Surg. 2015 août;50(8):1245-50.
- Petrosyan M, Estrada J, Hunter C, Woo R, Stein J, Ford HR, Anselmo DM. Atrésie œsophagienne/fistule trachéo-œsophagienne chez les nouveau-nés de très faible poids de naissance: amélioration des résultats grâce à une réparation par étapes. J Pediatr Surg. Déc. 2009; 44(12): 2278-281.
- Patkowsk D, Rysiakiewicz K, Jaworski W, Zielinska M, Siejka G, Konsur K, Czernik J. Réparation thoracoscopique de la fistule trachéo-œsophagienne et de l'atrésie œsophagienne. J Laparoendosc Adv Surg Tech A. 2009 avr.; 19 Suppl 1: S19-22.
- Foker JE, Linden BC, Boyle EM, Marquardt C. Développement d'une véritable réparation primaire pour l'ensemble du spectre de l'atrésie de l'œsophage. Ann Surg. 1997 oct.; 226(4): 533-41; discussion 541-3.
- Bairdain S, Foker JE, Smithers CJ, Hamilton TE, Labow BI, Baird CW, Taghinia AH, Feins N, Manfredi M, Jennings RW. Interposition jéjunale après échec de la réparation d'une atrésie de l'œsophage. J Am Coll Surg. Juin 2016; 222(6): 1001-8.
- Ko BA, Frederic R, DiTirro PA, Glatleider PA, Applebaum H. Accès simplifié pour la section de la fistule trachéo-œsophagienne de type H cervicale basse/thoracique haute. J Pediatr Surg. 2000 Nov;35(11):1621-2. [PubMed]
- 16.
- Choudhury SR, Ashcraft KW, Sharp RJ, Murphy JP, Snyder CL, Sigalet DL. Survie des patients atteints d'atrésie de l'œsophage: influence du poids de naissance, d'une anomalie cardiaque et des complications respiratoires tardives. J Pediatr Surg. 1999 janv.; 34(1):70-3; discussion 74.
- Upadhyaya VD, Gangopadhyaya AN, Gupta DK, Sharma SP, Kumar V, Pandey A, Upadhyaya AD. Pronostic de la fistule trachéo-œsophagienne congénitale avec atrésie œsophagienne sur la base de la longueur de l'intervalle. Pédiatre Chirurgie Int. Août 2007;23(8):767-71.
- Engum SA, Grosfeld JL, West KW, Rescorla FJ, Scherer LR. Analyse de la morbidité et de la mortalité dans 227 cas d'atrésie de l'œsophage et/ou de fistule trachéo-œsophagienne sur deux décennies. Arch Surg. 1995 mai; 130(5): 502-508; discussion 508-509.
- Antoniou D, Soutis M, Christopoulos-Geroulanos G. Sténose anastomotique après réparation d'une atrésie de l'œsophage: une expérience de 20 ans avec la dilatation endoscopique par ballonnet. J Pediatr Gastroenterol Nutr. 2010 oct;51(4):464-7.
- Krishnan U, Mousa H, Dall'Oglio L, Homaira N, Rosen R, Faure C, Gottrand F. Lignes directrices ESPGHAN-NASPGHAN pour l'évaluation et le traitement des complications gastro-intestinales et nutritionnelles chez les enfants atteints d'atrésie œsophagienne-fistule trachéo-œsophagienne. J Pediatr Gastroenterol Nutr. 2016 Nov;63(5):550-570.
- Connor MJ, Springford LR, Kapetanakis VV, Giuliani S. Atrésie de l'œsophage et soins de transition – Étape 1: revue systématique et méta-analyse de la littérature pour déterminer la prévalence des problèmes chroniques à long terme. Am J Surg. 2015 avr.; 209(4): 747-59.
- Jayasekera CS, Desmond PV, Holmes JA, Kitson M, Taylor AC. Groupe de quatre cas de carcinome épidermoïde de l'œsophage se développant chez des adultes présentant une atrésie de l'œsophage corrigée chirurgicalement – il est temps de commencer le dépistage. J Pediatr Surg. 2012 avr.;47(4):646-51.
Использованная литература

