Expert médical de l'article
Nouvelles publications
Syndrome de Goodpasture: causes, symptômes, diagnostic, traitement
Dernière revue: 12.07.2025

Tout le contenu iLive fait l'objet d'un examen médical ou d'une vérification des faits pour assurer autant que possible l'exactitude factuelle.
Nous appliquons des directives strictes en matière d’approvisionnement et ne proposons que des liens vers des sites de médias réputés, des instituts de recherche universitaires et, dans la mesure du possible, des études évaluées par des pairs sur le plan médical. Notez que les nombres entre parenthèses ([1], [2], etc.) sont des liens cliquables vers ces études.
Si vous estimez qu'un contenu quelconque de notre contenu est inexact, obsolète ou discutable, veuillez le sélectionner et appuyer sur Ctrl + Entrée.
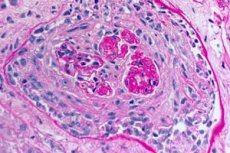
Le syndrome de Goodpasture est un syndrome auto-immun impliquant une hémorragie pulmonaire alvéolaire et une glomérulonéphrite causées par des anticorps anti-GBM circulants. Le syndrome de Goodpasture se développe le plus souvent chez les personnes présentant une prédisposition génétique et fumant des cigarettes, mais l'inhalation d'hydrocarbures et les infections virales des voies respiratoires peuvent également être des facteurs de risque. Les symptômes du syndrome de Goodpasture comprennent dyspnée, toux, fatigue, hémoptysie et/ou hématurie. Le syndrome de Goodpasture est suspecté en cas d'hémoptysie ou d'hématurie et est confirmé par la présence d'anticorps anti-GBM dans le sang. Le traitement du syndrome de Goodpasture comprend les échanges plasmatiques, les glucocorticoïdes et les immunosuppresseurs tels que le cyclophosphamide. Le pronostic est favorable si le traitement est instauré avant l'apparition d'une insuffisance respiratoire ou rénale.
Le syndrome de Goodpasture a été décrit pour la première fois par Goodpasture en 1919. Il associe une glomérulonéphrite et une hémorragie alvéolaire en présence d'anticorps anti-GBM. Le syndrome de Goodpasture se présente le plus souvent comme une association d'hémorragie alvéolaire diffuse et de glomérulonéphrite, mais peut parfois entraîner une glomérulonéphrite isolée (10 à 20 %) ou une atteinte pulmonaire (10 %). Les hommes sont plus souvent touchés que les femmes.
Quelles sont les causes du syndrome de Goodpasture?
La cause de la maladie n'a pas été précisément déterminée. On suppose une prédisposition génétique au syndrome de Goodpasture, dont le marqueur est la présence du gène HLA-DRW2. Certains s'interrogent sur le rôle possible d'une infection virale antérieure (virus de l'hépatite A et autres maladies virales), des risques professionnels et de la prise de médicaments (principalement la D-pénicillamine).
La pathogenèse du syndrome de Goodpasture repose sur la formation d'auto-anticorps dirigés contre les membranes basales des capillaires glomérulaires des reins et des alvéoles. Ces anticorps, de la classe des IgG, se lient aux anticorps des membranes basales en présence du composant C3 du complément, entraînant le développement d'une inflammation immunitaire des reins et des alvéoles pulmonaires.
Les anticorps anti-GBM sont dirigés contre le domaine non collagène (NC-1) de la chaîne 3 du collagène de type IV, dont la concentration est la plus élevée dans les membranes basales des capillaires rénaux et pulmonaires. L'exposition à des facteurs environnementaux – tabagisme, infections respiratoires aiguës virales et inhalation de suspensions d'hydrocarbures (plus fréquentes) – et, plus rarement, la pneumonie, activent la présentation des antigènes capillaires alvéolaires aux anticorps circulants chez les personnes présentant une prédisposition héréditaire (le plus souvent porteuses des allèles HLA-DRwl5, -DR4 et -DRB1). Les anticorps anti-GBM circulants se lient aux membranes basales, fixent le complément et induisent une réponse inflammatoire cellulaire, conduisant au développement d'une glomérulonéphrite et/ou d'une capillarite pulmonaire.
Il existe probablement une certaine similitude entre les autoantigènes de la membrane basale des capillaires glomérulaires des reins et des alvéoles. L'autoantigène se forme sous l'effet d'un facteur étiologique. Un facteur étiologique inconnu endommage et modifie la structure des membranes basales des reins et des poumons. L'excrétion des produits de dégradation des membranes basales glomérulaires des reins ralentit et diminue lorsqu'elles sont endommagées, créant ainsi les conditions préalables au développement de lésions auto-immunes rénales et pulmonaires. On ignore encore précisément quel composant de la membrane basale devient l'autoantigène. On suppose actuellement qu'il s'agit du composant structurel interne de la membrane basale glomérulaire du rein, la chaîne α3 du collagène de type 4.
Les complexes immuns formés se déposent le long des membranes basales des capillaires glomérulaires, ce qui entraîne le développement d'un processus inflammatoire immunitaire dans le glomérule rénal (glomérulonéphrite) et les alvéoles (alvéolite). Les principales cellules impliquées dans le développement de cette inflammation immunitaire sont les lymphocytes T, les monocytes, les endothéliocytes, les leucocytes polynucléaires et les macrophages alvéolaires. L'interaction entre eux est assurée par des médiateurs moléculaires, les cytokines (facteurs de croissance: plaquettes, insulino-like, bêta-transformants; interleukine-1, facteur de nécrose tumorale, etc.). Les métabolites de l'acide arachidonique, les radicaux libres de l'oxygène, les enzymes protéolytiques et les molécules adhésives jouent un rôle majeur dans le développement de l'inflammation immunitaire.
L'activation des macrophages alvéolaires joue un rôle crucial dans le développement de l'alvéolite du syndrome de Goodpasture. À l'état activé, ils sécrètent environ 40 cytokines. Les cytokines du groupe I (chimiotaxines, leucotriènes, interleukine-8) favorisent l'afflux de leucocytes polynucléaires dans les poumons. Les cytokines du groupe II (facteurs de croissance – plaquettes, macrophages) favorisent le mouvement des fibroblastes vers les poumons. Les macrophages alvéolaires produisent également des formes actives d'oxygène, les protéases, qui endommagent les tissus pulmonaires.
Pathomorphologie du syndrome de Goodpasture
Les principales manifestations pathomorphologiques du syndrome de Goodpasture sont:
- Lésion prédominante de la microcirculation rénale et pulmonaire. Au niveau pulmonaire, on observe une vénulite, une artériolite et une capillarite, avec des phénomènes prononcés de destruction et de prolifération. Les lésions capillaires sont principalement observées au niveau des septa interalvéolaires, et une alvéolite avec exsudat hémorragique se développe dans les alvéoles. L'atteinte rénale se caractérise par le développement d'une glomérulonéphrite proliférative extracapillaire, suivie d'une hyalinose et d'une fibrose, conduisant à une insuffisance rénale.
- hémorragies intraalvéolaires prononcées;
- développement d'une hémosidérose pulmonaire et d'une pneumosclérose de gravité variable, résultant de l'évolution d'une alvéolite.
Symptômes du syndrome de Goodpasture
La maladie se manifeste le plus souvent par des manifestations cliniques de pathologie pulmonaire. L'hémoptysie est le symptôme le plus important; cependant, elle peut être absente en présence de manifestations hémorragiques, et le patient peut ne présenter que des modifications infiltrantes à la radiographie thoracique, ou présenter un infiltrat et une détresse et/ou une insuffisance respiratoires. Dyspnée (principalement à l'effort), toux, malaise, diminution de la capacité de travail, douleurs thoraciques, fièvre et perte de poids sont fréquents. Jusqu'à 40 % des patients présentent une macrohématurie, bien qu'une hémorragie pulmonaire puisse précéder les manifestations rénales de plusieurs semaines, voire de plusieurs années.
Lors d'une hémoptysie, l'essoufflement peut s'aggraver. Une faiblesse et une diminution de la capacité de travail sont également préoccupantes.
Les symptômes du syndrome de Goodpasture varient au fil du temps, allant de poumons clairs à l'auscultation à des crépitements et des râles secs. Certains patients présentent un œdème périphérique et une pâleur dus à l'anémie.
Lors de l'examen, on remarque une pâleur de la peau, une cyanose des muqueuses, une pâleur ou un gonflement prononcé du visage, une diminution de la force musculaire et une perte de poids. La température corporelle est généralement élevée jusqu'à des niveaux fébriles.
Lors de la percussion des poumons, un raccourcissement du son de percussion peut être constaté sur des foyers étendus d'hémorragie pulmonaire, mais cela est rarement observé; le plus souvent, il n'y a aucun changement dans le son de percussion.
Un signe auscultatoire caractéristique du syndrome de Goodpasture est une respiration sifflante sèche et humide, dont le nombre augmente considérablement pendant ou après l'hémoptysie.
L'examen du système cardiovasculaire révèle une hypertension artérielle, une possible augmentation de la limite de matité cardiaque relative à gauche, des bruits cardiaques étouffés, un souffle systolique faible et un souffle de friction péricardique, accompagnés d'une insuffisance rénale sévère. En cas d'atteinte rénale progressive sur fond d'hypertension artérielle importante, une insuffisance ventriculaire gauche aiguë avec un tableau d'asthme cardiaque et d'œdème pulmonaire peut se développer. Cette situation survient généralement au stade terminal de la maladie.
En règle générale, les lésions rénales se manifestent plus tardivement, un certain temps après l'apparition des symptômes pulmonaires. Les signes cliniques caractéristiques d'une pathologie rénale sont l'hématurie (parfois macrohématurie), l'insuffisance rénale évolutive rapide, l'oligurie et l'hypertension artérielle.
Dans 10 à 15 % des cas, le syndrome de Goodpasture débute par des signes cliniques de pathologie rénale - le tableau clinique de la glomérulonéphrite apparaît (oligurie, œdème, hypertension artérielle, pâleur prononcée), puis des symptômes de lésions pulmonaires se joignent. De nombreux patients peuvent souffrir de myalgies, d'arthralgies.
Quelle que soit la forme d'apparition, le syndrome de Goodpasture est généralement sévère. La maladie progresse régulièrement et une insuffisance pulmonaire et rénale sévère se développe. L'espérance de vie des patients varie de quelques mois à un à trois ans. Le plus souvent, les patients décèdent d'urémie ou d'hémorragie pulmonaire.
Qu'est ce qui te tracasse?
Diagnostic du syndrome de Goodpasture
Le diagnostic du syndrome de Goodpasture nécessite la détection d'anticorps sériques anti-GBM par immunofluorescence indirecte ou, lorsque disponible, par dosage immuno-enzymatique direct (ELISA) avec le NC-1 a3 humain recombinant. D'autres tests sérologiques, tels que le dosage des anticorps antinucléaires (ANA), sont utilisés pour détecter le LES et le dosage de l'antistreptolysine-O pour détecter la glomérulonéphrite post-streptococcique, qui peut être à l'origine de nombreux cas de syndrome pulmonaire rénal. Les ANCA sont positifs (dans les prélèvements périphériques) dans 25 % des cas de syndrome de Goodpasture. Une biopsie rénale peut être indiquée en cas de glomérulonéphrite (hématurie, protéinurie, boue de globules rouges à l'analyse d'urine et/ou insuffisance rénale). Une glomérulonéphrite nécrosante segmentaire focale à progression rapide et progressive est observée à la biopsie dans le syndrome de Goodpasture et toutes les autres causes de syndrome pulmonaire rénal. La coloration par immunofluorescence des tissus rénaux ou pulmonaires révèle généralement un dépôt linéaire d'IgG le long des capillaires glomérulaires ou alvéolaires. On l'observe également dans le diabète rénal et la glomérulonéphrite fibrillaire, une maladie rare responsable du syndrome pulmonaire-rénal, mais la détection des anticorps anti-GBM dans ces affections est non spécifique.
Les épreuves fonctionnelles respiratoires et le lavage broncho-alvéolaire ne permettent pas de diagnostiquer le syndrome de Goodpasture, mais peuvent être utilisés pour confirmer la présence d'une hémorragie alvéolaire diffuse chez les patients atteints de glomérulonéphrite et d'infiltrats pulmonaires, mais sans hémoptysie. Un liquide de lavage qui reste hémorragique après plusieurs lavages peut confirmer un syndrome hémorragique diffus, surtout en cas de diminution concomitante de l'hématocrite.
 [ 3 ]
[ 3 ]
Diagnostic en laboratoire du syndrome de Goodpasture
- Analyse sanguine générale. Les signes caractéristiques sont une anémie hypochrome ferriprive, une hypochromie, une anisocytose et une poïkilocytose érythrocytaire. On observe également une leucocytose, un décalage vers la gauche de la formule leucocytaire et une augmentation significative de la VS.
- Analyse d'urine générale. On retrouve dans les urines des protéines (le degré de protéinurie peut être important), des cylindres (granulaires, hyalins, érythrocytaires) et des érythrocytes (une macrohématurie peut survenir). À mesure que l'insuffisance rénale chronique progresse, la densité relative de l'urine diminue et une isohyposthénurie se développe lors du test de Zimnitsky.
- Analyse biochimique du sang. Augmentation des taux sanguins d'urée, de créatinine, d'haptoglobine, de séromuqueuse, d'α2 et de gammaglobulines, diminution de la teneur en fer.
- Études immunologiques. Une diminution du nombre de lymphocytes T suppresseurs peut être détectée, ainsi que des complexes immuns circulants. Les anticorps dirigés contre la membrane basale des capillaires glomérulaires et alvéolaires sont détectés par immunofluorescence indirecte ou par des méthodes radioimmunologiques.
- Analyse des expectorations. Les expectorations contiennent de nombreux érythrocytes, de l'hémosidérine et des sidérophages sont détectés.
Diagnostic instrumental du syndrome de Goodpasture
- Examen radiologique des poumons. Les signes radiologiques caractéristiques sont des infiltrats pulmonaires dans la région radiculaire, s'étendant aux parties inférieure et moyenne des poumons, ainsi que des infiltrats nuageux bilatéraux, progressifs et symétriques.
- Étude de la fonction respiratoire externe. La spirométrie révèle une insuffisance respiratoire restrictive (diminution de la capacité vitale); à mesure que la maladie progresse, une insuffisance respiratoire obstructive s'ajoute (diminution du VEMS, indice de Tiffeneau).
- ECG. Des signes de dystrophie myocardique sévère d'origine anémique et hypoxique sont mis en évidence (diminution de l'amplitude des ondes T et de l'intervalle ST dans de nombreuses dérivations, le plus souvent dans les dérivations thoraciques gauches). En cas d'hypertension artérielle sévère, des signes d'hypertrophie myocardique ventriculaire gauche apparaissent.
- L'analyse des gaz du sang révèle une hypoxémie artérielle.
- Examen des biopsies pulmonaires et rénales. Une biopsie pulmonaire (biopsie ouverte) et rénale est réalisée pour confirmer le diagnostic définitif s'il est impossible de diagnostiquer précisément la maladie par des méthodes non invasives. Un examen histologique et immunologique des biopsies est réalisé. Les signes suivants sont caractéristiques du syndrome de Goodpasture:
- la présence de signes morphologiques de glomérulonéphrite (le plus souvent extracapillaire), d’alvéolite hémorragique, d’hémosidérose et de fibrose interstitielle;
- détection de dépôts linéaires d'IgG et du composant C3 du complément sur les membranes basales des alvéoles pulmonaires et des glomérules rénaux par la méthode d'immunofluorescence.
Critères diagnostiques du syndrome de Goodpasture
Lors du diagnostic du syndrome de Goodpasture, il est conseillé d’utiliser les critères suivants.
- Combinaison d'une pathologie pulmonaire et d'une pathologie rénale, c'est-à-dire une hémoptysie (souvent une hémorragie pulmonaire), un essoufflement et des symptômes de glomérulonéphrite.
- Évolution progressive de la maladie avec développement d'une insuffisance respiratoire et rénale.
- Développement d'une anémie ferriprive.
- Détection lors de l'examen radiographique des poumons de multiples infiltrats bilatéraux de type nuageux sur fond de déformation réticulaire du schéma pulmonaire.
- Détection dans le sang de titres élevés d'anticorps circulants dirigés contre la membrane basale des glomérules et des alvéoles rénaux.
- Détection de dépôts linéaires d'IgG et du composant C3 du complément sur les membranes basales des capillaires glomérulaires et alvéolaires.
- Absence d'autres manifestations systémiques (sauf pulmonaires et rénales).
Diagnostic différentiel du syndrome de Goodpasture
Le syndrome de Goodpasture doit être différencié de nombreuses maladies se manifestant par une hémoptysie ou une hémorragie pulmonaire. Il est nécessaire d'exclure les maladies oncologiques des bronches et des poumons, la tuberculose, les abcès pulmonaires, les bronchectasies, les maladies cardiaques et vasculaires (entraînant une congestion et une hypertension de la circulation pulmonaire), les vascularites systémiques et les diathèses hémorragiques.
Programme de dépistage du syndrome de Goodpasture
- Analyses générales de sang et d'urine.
- Analyse biochimique du sang: détermination des protéines totales et des fractions protéiques, de la créatinine et de l'urée, des transaminases, du séromuqueux, de l'haptoglobine, de la fibrine, du fer.
- Analyse des expectorations: examen cytologique, dosage des sidérophages.
- Études immunologiques: détermination du contenu en lymphocytes B et T, sous-populations de lymphocytes T, immunoglobulines, complexes immuns circulants, anticorps dirigés contre les membranes basales des glomérules des reins et des alvéoles.
- Examen radiographique des poumons.
- ECG.
- Spirométrie.
- Examen des biopsies pulmonaires et rénales.
Quels tests sont nécessaires?
Traitement du syndrome de Goodpasture
Le traitement du syndrome de Goodpasture comprend une plasmaphérèse quotidienne ou biquotidienne pendant 2 à 3 semaines (4 L de plasmaphérèse) afin d'éliminer les anticorps anti-GBM, associée à des glucocorticoïdes intraveineux (généralement 1 g de méthylprednisolone pendant au moins 20 minutes tous les deux jours, 3 fois par jour, avec 1 mg/kg de prednisolone par jour) et du cyclophosphamide (2 mg/kg une fois par jour) pendant 6 à 12 mois afin de prévenir la formation de nouveaux anticorps. Le traitement peut être diminué progressivement lorsque les fonctions pulmonaire et rénale cessent de s'améliorer. La mortalité à long terme est liée au degré d'insuffisance rénale au début de la maladie; les patients nécessitant une dialyse précoce et ceux présentant plus de 50 % de néphrons en croissant à la biopsie ont une durée de survie inférieure à 2 ans et nécessitent souvent une dialyse, sauf si une transplantation rénale est envisagée. L'hémoptysie peut être un bon signe pronostique car elle permet une détection plus précoce de la maladie; la minorité de patients ANCA-positifs répond mieux au traitement du syndrome de Goodpasture. La récidive survient dans un faible pourcentage de cas et est associée au tabagisme persistant et à une infection des voies respiratoires. Chez les patients atteints d'insuffisance rénale terminale ayant bénéficié d'une transplantation rénale, la maladie peut réapparaître au niveau du greffon.
Quel est le pronostic du syndrome de Goodpasture?
Le syndrome de Goodpasture évolue souvent rapidement et peut être mortel s'il n'est pas diagnostiqué et traité rapidement; le pronostic est bon lorsque le traitement est commencé avant l'apparition d'une insuffisance respiratoire ou rénale.
La survie immédiate au moment de l'hémorragie pulmonaire et de l'insuffisance respiratoire est associée à la garantie de la perméabilité des voies respiratoires; l'intubation endotrachéale et la ventilation mécanique sont recommandées pour les patients présentant des niveaux de gaz sanguins artériels limites et une insuffisance respiratoire imminente.

