Expert médical de l'article
Nouvelles publications
Akinésie myocardique
Dernière revue: 12.07.2025

Tout le contenu iLive fait l'objet d'un examen médical ou d'une vérification des faits pour assurer autant que possible l'exactitude factuelle.
Nous appliquons des directives strictes en matière d’approvisionnement et ne proposons que des liens vers des sites de médias réputés, des instituts de recherche universitaires et, dans la mesure du possible, des études évaluées par des pairs sur le plan médical. Notez que les nombres entre parenthèses ([1], [2], etc.) sont des liens cliquables vers ces études.
Si vous estimez qu'un contenu quelconque de notre contenu est inexact, obsolète ou discutable, veuillez le sélectionner et appuyer sur Ctrl + Entrée.
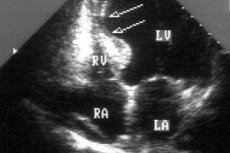
Lors du diagnostic des maladies cardiaques, une akinésie myocardique peut être détectée, c'est-à-dire son immobilité ou l'incapacité de certaines zones du tissu musculaire cardiaque à se contracter.
Ainsi, l'akinésie myocardique n'est pas une maladie, mais un état pathologique, un trouble de la fonction motrice normale du muscle cardiaque, qui est déterminé par le diagnostic échographique du cœur et est l'un des signes structurels et fonctionnels d'un certain nombre de maladies du système cardiovasculaire.
Causes akinésie du myocarde
Pourquoi le muscle cardiaque cesse-t-il de se contracter, c'est-à-dire quelles sont les causes de l'akinésie myocardique?
En cardiologie, la pathogénèse de la perte de la fonction contractile normale du myocarde (automatique chez un cœur sain) est le plus souvent associée à un infarctus du myocarde et à la nécrose d'une partie des cardiomyocytes fonctionnels qui en résulte. Les modifications réparatrices (remodelage) du myocarde après l'infarctus entraînent d'abord une augmentation de la zone d'infarctus, puis la forme du ventricule se déforme et s'élargit, la zone de nécrose des cardiomyocytes se transformant en cicatrice et formant une zone d'akinésie myocardique. Des modifications fibreuses peuvent également affecter le septum séparant les ventricules, et l'échographie révèle alors une akinésie au niveau du septum interventriculaire.
L'infarctus du myocarde est une maladie aiguë d'ischémie cardiaque ou de cardiopathie ischémique (CI), qui se développe lorsque la circulation sanguine dans le système artériel coronaire est perturbée, ce qui entraîne une hypoxie myocardique et la mort de ses cellules.
En cas d'amincissement post-infarctus de la membrane musculaire du cœur et de sa protrusion (anévrisme), l'échographie cardiaque révèle une akinésie du ventricule gauche. Chez près des deux tiers des patients, l'anévrisme se forme dans le ventricule gauche, sur sa paroi antérieure ou à son apex, et une akinésie de l'apex cardiaque est également observée.
De plus, il existe une corrélation entre les résultats échocardiographiques visualisant l'akinésie myocardique et le syndrome myocardique post-infarctus - cardiosclérose post-infarctus focale ou diffuse avec remplacement caractéristique des cardiomyocytes endommagés par du tissu fibreux, ainsi qu'avec des lésions du système de conduction cardiaque (conduction altérée des impulsions bioélectriques par les cellules des nœuds sino-auriculaires ou auriculo-ventriculaires).
Dans les cas de dégénérescence ou de dystrophie myocardique, dont l'image histomorphologique est similaire à celle de la cardiosclérose, des modifications de la structure du tissu musculaire cardiaque démontrent également une akinésie myocardique focale.
On observe souvent des lésions des cellules du nœud sinusal avec une diminution de l'amplitude des mouvements de la paroi musculaire et une absence de contraction, soit une combinaison d'hypokinésie et d'akinésie chez les patients atteints de myocardite infectieuse. Cette maladie peut s'accompagner de la formation d'infiltrats inflammatoires dans l'interstitium et d'une myocytolyse localisée due à une inflammation causée par des virus (adénovirus et entérovirus, Picornaviridae, virus Coxsackie, parvovirus B, virus de la rubéole, HSV-6), des bactéries (Corynebacterium diphtheriae, Haemophilus influenzae, Borrelia burgdorferi, Mycoplasma pneumoniae), ainsi que des protozoaires (Trypanosoma cruzi, Toxoplasma gondii), des champignons (Aspergillus) ou des parasites (Ascaris, Echinococcus granulosus, Paragonimus westermani, etc.). Comme le montrent les statistiques cliniques, la plupart des cas de myocardite infectieuse sont causés par la diphtérie, la grippe, les entérovirus et le toxoplasme.
Et en cas de myocardite d'étiologie auto-immune (associée au lupus érythémateux disséminé, à la sclérodermie, à la polyarthrite rhumatoïde, à la maladie de Whipple, etc.), une akinésie du ventricule gauche et son dysfonctionnement peuvent survenir, entraînant des arythmies potentiellement mortelles.
Les cardiologues distinguent également la cardiomyopathie de stress (cardiomyopathie de Takotsubo), que les spécialistes nationaux appellent syndrome du cœur brisé. Ce dysfonctionnement systolique soudain et transitoire des segments médio-apical du ventricule gauche survient souvent en situation de stress chez les femmes âgées sans antécédents de maladie coronarienne. On observe notamment une zone d'hyperkinésie à la base du ventricule gauche, et au-dessus, une akinésie de l'apex du cœur. De plus, l'échographie cardiaque permet de détecter une absence de mouvement au niveau du septum interventriculaire.
Facteurs de risque
Les principaux facteurs de risque de troubles de la fonction motrice des zones musculaires cardiaques, tels que l'akinésie myocardique, sont le développement d'une cardiopathie ischémique. Les facteurs de risque de ce développement sont, quant à eux, les suivants:
- âge supérieur à 45 ans pour les hommes et supérieur à 55 ans pour les femmes;
- antécédents familiaux de maladie cardiaque précoce;
- diminution des taux de HDL (lipoprotéines de haute densité) transportant le cholestérol dans le sang et augmentation des taux de lipoprotéines de basse densité (LDL), qui contribuent au dépôt de cholestérol sur les parois des vaisseaux sanguins – athérosclérose;
- taux élevés de triglycérides dans le sang (liés à l’alimentation);
- hypertension artérielle;
- trouble métabolique (syndrome métabolique) qui contribue à l’augmentation de la pression artérielle et au dépôt de cholestérol dans les vaisseaux coronaires;
- tabagisme (y compris tabagisme passif), obésité, manque d’activité physique, stress psychologique et dépression.
Les infections virales et bactériennes affectant le myocarde, ainsi que les pathologies auto-immunes, constituent un facteur de risque d'ischémie myocardique, tel qu'une augmentation du taux de protéine C-réactive (CRP) dans le sang. De plus, l'état normal des vaisseaux cardiaques est perturbé par un déséquilibre des activateurs tissulaires du plasminogène (tPA) et de leurs inhibiteurs (PAI), ce qui présente un risque de thrombose des veines coronaires avec occlusion complète.
Pathogénèse
Il est suggéré que la pathogénèse de cette cardiomyopathie réside dans la réponse inadéquate des vaisseaux cardiaques (artères coronaires et/ou artérioles et capillaires) à la libération de neurotransmetteurs catécholamines dans le sang, et que des anomalies à court terme dans la contraction myocardique surviennent en raison du vasospasme qu'ils provoquent.
Symptômes akinésie du myocarde
En cas d'akinésie myocardique – signe échocardiographique de maladies cardiovasculaires – le tableau clinique est déterminé par les symptômes de ces pathologies. Parmi ceux-ci figurent: essoufflement, douleurs d'intensité variable dans la région cardiaque, arythmie (auriculaire ou ventriculaire), flutter ventriculaire et évanouissement.
Ainsi, dans la cardiomyopathie de Takotsubo, les patients se plaignent le plus souvent de douleurs derrière le sternum (de nature compressive) irradiant vers l'omoplate gauche et d'une sensation de manque d'air lors de l'inspiration.
Les douleurs liées à la myocardite peuvent être aiguës et prolongées (sans effet avec la nitroglycérine), ou atténuées (serrantes). De plus, les symptômes cardiaques de cette maladie d'origine infectieuse comprennent un essoufflement, de la fièvre, une accélération du rythme cardiaque, des palpitations; des troubles hémodynamiques rapides comme l'éclair (baisse de la vitesse du flux sanguin), une perte de connaissance et une mort cardiaque subite sont possibles.
Complications et conséquences
Il est certain que l'akinésie myocardique, comparée à la dyskinésie de la zone cicatricielle post-infarctus, représente un danger vital plus grave pour les patients victimes d'un infarctus du myocarde. Des études ont montré que dans environ 40 % des cas d'infarctus avec obstruction coronaire, avec un rétablissement rapide du flux sanguin dans le segment ischémique (reperfusion), la contractilité myocardique est rétablie dans les deux à six semaines suivant l'infarctus. Cependant, ses conséquences et complications incluent une tamponnade cardiaque soudaine, une dissociation électromécanique et le décès.
Les conséquences et complications des changements dystrophiques du myocarde avec son akinésie partielle conduisent à l'atrophie presque inévitable des fibres musculaires, qui peut se manifester non seulement par une arythmie et une diminution de l'éjection systolique, mais également par une expansion des cavités cardiaques avec une insuffisance circulatoire chronique.
L'akinésie ventriculaire gauche avec son dysfonctionnement systolique et l'insuffisance cardiaque sont parmi les prédicteurs les plus forts du risque de mort cardiaque subite.
 [ 23 ]
[ 23 ]
Diagnostics akinésie du myocarde
Seul le diagnostic instrumental du myocarde par échographie cardiaque – échocardiographie – permet d’identifier les zones d’akinésie.
Une méthode spéciale d’analyse segmentaire automatique des contractions cardiaques permet de suivre et d’enregistrer tous les mouvements de la paroi cardiaque.
Qu'est-ce qu'il faut examiner?
Diagnostic différentiel
Le diagnostic différentiel de la douleur thoracique – chez les patients présentant un tableau clinique atypique ou des résultats d’électrocardiogramme indéterminés sur le plan diagnostique – implique également le recours à l’échocardiographie.
Chez les patients sans trouble du mouvement myocardique, l'échocardiographie peut être utilisée pour détecter d'autres affections potentiellement mortelles présentant un tableau clinique similaire: embolie pulmonaire massive ou dissection aortique.
En outre, le diagnostic du myocarde, y compris en cas de troubles de sa fonction contractile, comprend des analyses de sang pour la VS, les niveaux de protéine C-réactive, les anticorps (analyse sérologique du sérum pour les niveaux d'IgM), les niveaux d'électrolytes et la détermination des marqueurs de lésions myocardiques (isoenzymes de troponine I et T, créatine kinase).
Les patients subissent un électrocardiogramme (ECG), une coronarographie avec contraste X, une scintigraphie tomographique (avec radio-isotopes), un Doppler tissulaire couleur et une IRM. Le diagnostic des anévrismes cardiaques nécessite la ventriculographie avec contraste X.
Dans certains cas, le diagnostic différentiel du myocarde n'est possible qu'à l'aide d'une biopsie endomyocardique suivie d'une histologie de l'échantillon obtenu.
Qui contacter?
Traitement akinésie du myocarde
Le traitement du myocarde vise à rétablir l'apport sanguin aux zones endommagées (perfusion) et leur fonction de conduction, à limiter la zone de nécrose localisée des cardiomyocytes et à activer le métabolisme cellulaire.
En pratique clinique, des médicaments de plusieurs groupes pharmacologiques sont utilisés. Dans les syndromes coronariens aigus et les thromboses occlusives de l'artère coronaire épicardique, le traitement de reperfusion est réalisé par thrombolytiques (streptokinase, prourokinase, altéplase) et antiplaquettaires (ticlopidine, sulfate de clopidogrel ou Plavix).
En cas d'insuffisance cardiaque chronique, on utilise des médicaments qui inhibent l'enzyme de conversion de l'angiotensine (ECA), qui régule la pression artérielle: captopril, énalapril, ramipril, fosinopril. Leur posologie est déterminée par un cardiologue en fonction de la maladie et des résultats de l'ECG. Par exemple, le captopril (Capril, aloprésine, tensiomine) peut être prescrit à raison de 12,5 à 25 mg, trois fois par jour avant les repas (par voie orale ou sous la langue). Les effets secondaires de ce médicament et de la plupart des médicaments de ce groupe comprennent: tachycardie, chute de la pression artérielle, dysfonctionnement rénal, insuffisance hépatique, nausées et vomissements, diarrhée, urticaire, anxiété accrue, insomnie, paresthésies et tremblements, et modifications de la composition biochimique du sang (y compris leucopénie). Il convient de garder à l'esprit que les inhibiteurs de l'ECA ne sont pas utilisés en cas de pathologies myocardiques idiopathiques, d'hypertension artérielle, de sténose de l'aorte et des vaisseaux rénaux, de modifications hyperplasiques du cortex surrénalien, d'ascite, de grossesse et d'enfance.
En cas de maladie coronarienne et de cardiomyopathie, des médicaments anti-ischémiques du groupe des vasodilatateurs périphériques peuvent être prescrits, par exemple la molsidomine (Motazomine, Corvaton, Sidnofarm) ou l'Advocard. La molsidomine se prend par voie orale: un comprimé (2 mg) trois fois par jour; elle est contre-indiquée en cas d'hypotension artérielle et de choc cardiogénique; elle a pour effet secondaire des céphalées.
Le vérapamil (Veracard, Lekoptin), un médicament antiarythmique et hypotenseur, est utilisé en cas de maladie coronarienne avec tachycardie et angine de poitrine: un comprimé (80 mg) trois fois par jour. Des effets secondaires peuvent survenir: nausées, sécheresse buccale, troubles intestinaux, maux de tête et douleurs musculaires, insomnie, urticaire et troubles du rythme cardiaque. Ce médicament est contre-indiqué en cas d'insuffisance cardiaque sévère, de fibrillation auriculaire, de bradycardie et d'hypotension.
Le Mildronate (Meldonium, Angiocardil, Vasonate, Cardionate et autres noms commerciaux) a un effet cardiotonique et antihypoxique. Il est recommandé de prendre une gélule (250 mg) deux fois par jour. Ce médicament est réservé aux adultes et contre-indiqué en cas de troubles de la circulation cérébrale et de pathologies structurelles du cerveau. L'utilisation du Mildronate peut entraîner des effets secondaires tels que maux de tête, vertiges, arythmie cardiaque, essoufflement, sécheresse buccale et toux, nausées et troubles intestinaux.
Les médicaments du groupe des bêta-1-bloquants utilisés dans le traitement des maladies coronariennes (métoprolol, propranolol, aténolol, acébutolol, etc.) réduisent principalement la tension artérielle. En réduisant la stimulation sympathique des récepteurs des membranes cellulaires du myocarde, ils ralentissent la fréquence et le débit cardiaques, augmentent la consommation d'oxygène des cardiomyocytes et soulagent la douleur. Par exemple, le métoprolol est prescrit un comprimé deux fois par jour, tandis que l'aténolol suffit à un comprimé par jour. Cependant, ces médicaments augmentent le risque d'insuffisance cardiaque aiguë et de bloc auriculaire et ventriculaire, et leur utilisation est contre-indiquée en cas d'insuffisance cardiaque congestive et décompensée, de bradycardie et de troubles circulatoires. Par conséquent, de nombreux experts remettent actuellement en question l'effet antiarythmique de ces médicaments.
Soulager les douleurs cardiaques est primordial, car l'activation sympathique pendant la douleur provoque une constriction des vaisseaux sanguins et augmente la charge cardiaque. La nitroglycérine est couramment utilisée pour soulager la douleur. Informations détaillées dans l'article: Pilules efficaces pour soulager les douleurs cardiaques.
Les médecins recommandent de prendre des vitamines B6, B9, E et, pour soutenir le système de conduction cardiaque, des médicaments contenant du potassium et du manganèse (Panangin, Asparkam, etc.).
Traitement chirurgical
En cas d'infarctus avec lésion des artères coronaires (conduisant à la formation d'une zone d'ischémie myocardique et à son akinésie avec dilatation des cavités cardiaques), un traitement chirurgical est indiqué pour rétablir le flux sanguin vers le cœur - pontage aortocoronarien.
En cas de maladie cardiaque ischémique, on a recours à une dilatation coronaire (élargissement de la lumière) – stenting.
Le traitement chirurgical est le plus souvent utilisé pour l'anévrisme dyskinétique: soit par anévrismectomie (résection), soit par suture de la cavité anévrismale (anévrismeplastie), soit par renforcement de sa paroi.
Une méthode de cardiomyoplastie dynamique a été développée. Elle consiste à restaurer ou à améliorer la contractilité myocardique grâce à un muscle squelettique électrostimulé (généralement un lambeau provenant du bord du muscle grand dorsal) enroulé autour d'une partie du cœur (avec résection partielle de la deuxième côte). Le lambeau musculaire est suturé autour des ventricules et sa stimulation synchrone avec les contractions cardiaques est réalisée à l'aide d'électrodes intramusculaires d'un stimulateur cardiaque implantable.
La prévention
Revenez à la section Facteurs de risque pour découvrir les méthodes de prévention des maladies cardiovasculaires. L'essentiel est de ne pas prendre de poids, de bouger davantage et d'empêcher le cholestérol de se déposer sous forme de plaques sur les parois des vaisseaux sanguins. Pour cela, il est conseillé, après 40 ans (et en cas de pathologies cardiaques chez des parents consanguins), de suivre un régime alimentaire adapté à l'athérosclérose.
Bien entendu, les cardiologues considèrent l'arrêt du tabac comme la condition la plus importante pour prévenir les lésions ischémiques du myocarde. En effet, lorsque l'on fume, les protéines d'hémoglobine des globules rouges se combinent aux gaz de la fumée de tabac inhalée pour former un composé très nocif pour le cœur: la carboxyhémoglobine. Cette substance empêche les cellules sanguines de transporter l'oxygène, ce qui entraîne une hypoxie des cardiomyocytes du muscle cardiaque et le développement d'une ischémie myocardique.
À lire aussi – Prévention de la cardiosclérose post-infarctus
Prévoir
Les cardiologues sont réticents à fournir des informations pronostiques: il est difficile d’établir un pronostic précis de la dyskinésie, de l’hypokinésie et de l’akinésie post-infarctus.
Pour évaluer le pronostic de mortalité après un infarctus aigu du myocarde, les experts de l'American Society of Echocardiography ont mis au point l'indice de mouvement de la paroi (WMI). Cependant, cet indice n'a pas de valeur pronostique à long terme.
Concernant la myocardite, selon les statistiques, près de 30 % des cas se terminent par une guérison, et dans le reste, un dysfonctionnement chronique du ventricule gauche devient une complication. De plus, environ 10 % des cas de myocardite virale et microbienne entraînent le décès des patients. L'akinésie totale du myocarde conduit à un arrêt cardiaque.

