Expert médical de l'article
Nouvelles publications
Syndrome des ovaires polykystiques.
Dernière revue: 04.07.2025

Tout le contenu iLive fait l'objet d'un examen médical ou d'une vérification des faits pour assurer autant que possible l'exactitude factuelle.
Nous appliquons des directives strictes en matière d’approvisionnement et ne proposons que des liens vers des sites de médias réputés, des instituts de recherche universitaires et, dans la mesure du possible, des études évaluées par des pairs sur le plan médical. Notez que les nombres entre parenthèses ([1], [2], etc.) sont des liens cliquables vers ces études.
Si vous estimez qu'un contenu quelconque de notre contenu est inexact, obsolète ou discutable, veuillez le sélectionner et appuyer sur Ctrl + Entrée.
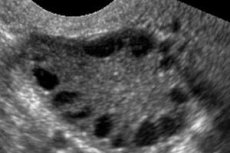
Le syndrome des ovaires polykystiques est une pathologie hétérogène multifactorielle caractérisée par des troubles du cycle menstruel, une anovulation chronique, une hyperandrogénie, des modifications kystiques des ovaires et une infertilité. Il se caractérise par une obésité modérée, des règles irrégulières ou une aménorrhée, et des symptômes d'excès d'androgènes (hirsutisme, acné). Les ovaires contiennent généralement de nombreux kystes. Le diagnostic repose sur des tests de grossesse, des dosages hormonaux et un examen visant à exclure une tumeur virilisante. Le traitement est symptomatique.
Causes le syndrome des ovaires polykystiques
Le syndrome des ovaires polykystiques est une pathologie endocrinienne fréquente de l'appareil reproducteur, survenant chez 5 à 10 % des patientes. Il se caractérise par une anovulation et un excès d'androgènes d'étiologie inconnue. Les ovaires peuvent être de taille normale ou hypertrophiés, avec une capsule lisse et épaissie. En règle générale, les ovaires contiennent de nombreux petits kystes folliculaires de 26 mm; on observe parfois de gros kystes contenant des cellules atrétiques. L'augmentation des taux d'œstrogènes entraîne un risque accru d'hyperplasie endométriale et, à terme, de cancer de l'endomètre. L'augmentation des taux d'androgènes augmente également le risque de syndrome métabolique et d'hirsutisme.
 [ 13 ]
[ 13 ]
Pathogénèse
Les femmes atteintes du syndrome des ovaires polykystiques (SOPK) présentent des anomalies du métabolisme des androgènes et des œstrogènes, ainsi qu'une altération de la synthèse des androgènes. La maladie s'accompagne de concentrations sériques élevées d'hormones androgènes telles que la testostérone, l'androstènedione, le sulfate de déhydroépiandrostérone et la DHEA-S. Cependant, des taux d'androgènes normaux peuvent parfois être mesurés.
Le SOPK est également associé à une résistance à l'insuline, à une hyperinsulinémie et à l'obésité. L'hyperinsulinémie peut également entraîner une suppression de la synthèse de SHBG, ce qui peut à son tour accentuer les caractéristiques androgéniques.
De plus, la résistance à l’insuline dans le SOPK est associée à l’adiponectine, une hormone sécrétée par les adipocytes qui régule le métabolisme des lipides et la glycémie.
L'augmentation du taux d'androgènes s'accompagne d'une augmentation de l'effet stimulant de l'hormone lutéinisante (LH) sécrétée par l'hypophyse antérieure, ce qui entraîne la croissance des cellules de la thèque ovarienne. Ces cellules, à leur tour, augmentent la synthèse d'androgènes (testostérone, androstènedione). En raison d'une diminution du taux d'hormone folliculo-stimulante (FSH) par rapport à celui de la LH, les cellules granuleuses ovariennes ne peuvent pas aromatiser les androgènes en œstrogènes, ce qui entraîne une baisse du taux d'œstrogènes et une anovulation ultérieure.
Certaines données suggèrent que les patients présentent une altération fonctionnelle du cytochrome P450c17, 17-hydroxylase, qui inhibe la biosynthèse des androgènes.
Le syndrome des ovaires polykystiques est un syndrome génétiquement hétérogène. Des études menées auprès de membres de familles atteintes du SOPK ont démontré une transmission autosomique dominante. Un lien génétique entre le SOPK et l'obésité a récemment été confirmé. Une variante du gène FTO (rs9939609, qui prédispose à l'obésité générale) est significativement associée à la prédisposition au développement du SOPK. Des polymorphismes du locus 2p16 (2p16.3, 2p21 et 9q33.3) associés au syndrome des ovaires polykystiques ont été identifiés, ainsi que le gène codant pour le récepteur de l'hormone lutéinisante (LH) et de la gonadotrophine chorionique humaine (hCG).
Symptômes le syndrome des ovaires polykystiques
Les symptômes du syndrome des ovaires polykystiques apparaissent à la puberté et s'atténuent avec le temps. Des règles régulières pendant un certain temps après les premières règles permettent d'exclure un diagnostic de syndrome des ovaires polykystiques. L'examen révèle généralement une glaire cervicale abondante (signe d'un taux élevé d'œstrogènes). Le diagnostic de syndrome des ovaires polykystiques peut être suspecté si une femme présente au moins deux symptômes typiques (obésité modérée, hirsutisme, règles irrégulières ou aménorrhée).
La combinaison la plus courante de symptômes cliniques est:
- troubles du cycle menstruel (oligoménorrhée, saignements utérins anormaux, aménorrhée secondaire);
- anovulation;
- infertilité;
- hirsutisme;
- trouble du métabolisme des graisses (obésité et syndrome métabolique);
- diabète;
- syndrome d'apnée obstructive du sommeil.
Qu'est ce qui te tracasse?
Diagnostics le syndrome des ovaires polykystiques
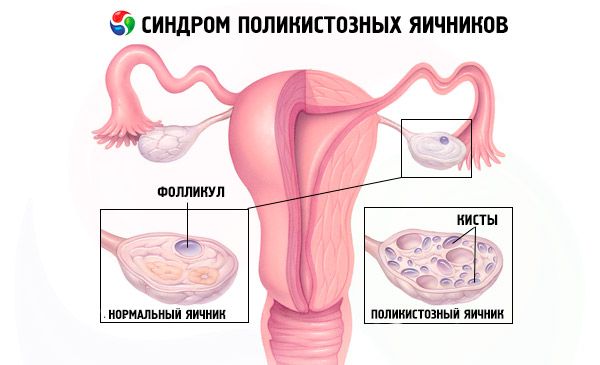
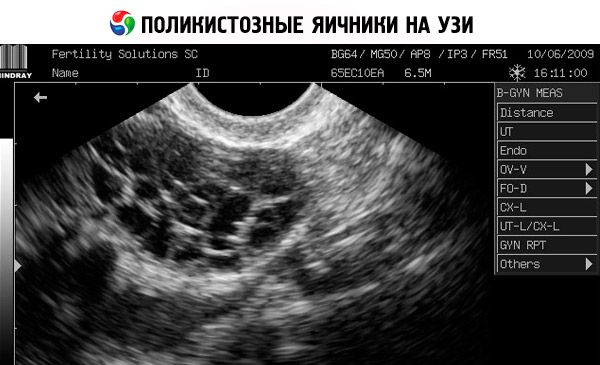
Le diagnostic repose sur l'exclusion d'une grossesse (test de grossesse) et la mesure des taux sériques d'estradiol, de FSH, de TSH et de prolactine. Le diagnostic est confirmé par échographie, qui révèle la présence de plus de 10 follicules dans l'ovaire; les follicules sont généralement situés en périphérie et ressemblent à un collier de perles. En cas de présence de follicules dans les ovaires et d'hirsutisme, il convient de doser les taux de testostérone et de DHEAS. Les taux pathologiques sont évalués comme pour une aménorrhée.
 [ 23 ], [ 24 ], [ 25 ], [ 26 ], [ 27 ], [ 28 ]
[ 23 ], [ 24 ], [ 25 ], [ 26 ], [ 27 ], [ 28 ]
Antécédents et examen physique
Grâce à un recueil minutieux de l'anamnèse, les facteurs héréditaires de développement du syndrome des ovaires polykystiques sont identifiés. Lors de l'examen, l'indice de masse corporelle et le rapport taille-hanches (normalement ≤ 0,8) sont calculés afin de diagnostiquer un excès de poids et une obésité.
Le syndrome des ovaires polykystiques est caractérisé par un polymorphisme des signes cliniques et biologiques.
Méthodes de diagnostic spéciales pour le syndrome des ovaires polykystiques
Un bilan hormonal est obligatoire du 3e au 5e jour de la réaction menstruelle: les taux sanguins de LH, de FSH, de prolactine, de testostérone, d'androgènes surrénaliens (DHEAS) et de 17-hydroxyprogestérone sont mesurés. Le syndrome des ovaires polykystiques se caractérise par un indice LH/FSH élevé (> 2,5–3) (en raison d'une augmentation du taux de LH) et une hyperandrogénie.
Afin de clarifier l'origine de l'hyperandrogénie, un dosage de l'ACTH est réalisé pour le diagnostic différentiel avec une hyperandrogénie causée par une mutation du gène codant pour l'enzyme 21-hydroxylase dans les glandes surrénales (diagnostic des formes latentes et latentes du syndrome adrénogénital). Technique: à 9 h, un prélèvement sanguin est effectué dans la veine cubitale, puis 1 mg de synacthène-dépôt est administré par voie intramusculaire, et un nouveau prélèvement sanguin est effectué 9 heures plus tard. Les concentrations de cortisol et de 17-hydroxyprogestérone sont mesurées dans les deux échantillons sanguins, puis un coefficient est calculé à l'aide d'une formule spéciale, dont les valeurs ne doivent pas dépasser 0,069. Dans ces cas, le test est négatif et la femme (ou l'homme) n'est pas porteur de la mutation du gène 21-hydroxylase.
Le test à la diphénine est réalisé pour détecter les formes centrales du syndrome des ovaires polykystiques et envisager un traitement par neurotransmetteurs. Technique: les concentrations initiales de LH et de testostérone sont mesurées dans le sang, puis la diphénine est prise à raison d'un comprimé trois fois par jour pendant trois jours, après quoi la concentration de ces mêmes hormones est à nouveau mesurée dans le sang. Le test est considéré comme positif si les taux de LH et de testostérone diminuent.
- L'échographie des organes génitaux révèle des ovaires hypertrophiés (10 cm3 ou plus), des follicules multiples jusqu'à 9 mm de diamètre, un épaississement du stroma ovarien et un épaississement de la capsule.
- De plus, si une résistance à l’insuline est suspectée, un test de tolérance au glucose est effectué pour déterminer les niveaux d’insuline et de glucose avant et après l’exercice.
- Si une genèse surrénalienne du syndrome des ovaires polykystiques est suspectée, un conseil génétique et un génotypage HLA sont recommandés.
- Hystérosalpingographie.
- Laparoscopie.
- Evaluation de la fertilité du sperme du conjoint.
En novembre 2015, l'Association américaine des endocrinologues cliniques (AACE), l'American College of Endocrinology (ACE) et la Société de l'excès d'androgènes et du SOPK (AES) ont publié de nouvelles recommandations pour le diagnostic du SOPK. Ces recommandations sont les suivantes:
- Les critères diagnostiques du SOPK doivent inclure l’un des trois critères suivants: anovulation chronique, hyperandrogénie clinique et maladie des ovaires polykystiques.
- En plus des résultats cliniques, les taux sériques de 17-hydroxyprogestérone et d’hormone anti-müllérienne doivent être mesurés pour diagnostiquer le SOPK.
- Les niveaux de testostérone libre sont plus sensibles pour détecter l’excès d’androgènes que les niveaux de testostérone totale.
Qu'est-ce qu'il faut examiner?
Diagnostic différentiel
Qui contacter?
Traitement le syndrome des ovaires polykystiques
Les femmes ayant des cycles menstruels anovulatoires (antécédents de règles absentes ou irrégulières et aucune preuve de production de progestérone), sans hirsutisme et sans désir de grossesse reçoivent un progestatif intermittent (par exemple, de la médroxyprogestérone 5 à 10 mg par voie orale une fois par jour pendant 10 à 14 jours chaque mois pendant 12 mois) ou des contraceptifs oraux pour réduire le risque d'hyperplasie et de cancer de l'endomètre et pour diminuer les taux d'androgènes circulants.
Chez les femmes atteintes du syndrome des ovaires polykystiques, présentant des cycles anovulatoires et un hirsutisme, et ne souhaitant pas de grossesse, le traitement vise à réduire l'hirsutisme et à réguler les taux sériques de testostérone et de DHEAS. Les femmes souhaitant concevoir un enfant suivent un traitement contre l'infertilité.
Le traitement de l'infertilité dans le syndrome des ovaires polykystiques s'effectue en 2 étapes:
- Étape 1 - préparatoire;
- Étape 2 – stimulation de l’ovulation.
Le traitement au stade préparatoire dépend de la forme clinique et pathogénique du syndrome des ovaires polykystiques.
- En cas de syndrome des ovaires polykystiques et d’obésité, il est recommandé de prescrire des médicaments qui aident à réduire la résistance à l’insuline: le médicament de choix est la metformine, prise par voie orale à raison de 500 mg 3 fois par jour pendant 3 à 6 mois.
- Dans la forme ovarienne du syndrome des ovaires polykystiques et les taux élevés de LH, des médicaments sont utilisés pour aider à réduire la sensibilité du système hypothalamo-hypophysaire à la suppression complète de la fonction ovarienne (taux d'estradiol sérique < 70 pmol/l):
- pulvérisation de buséréline, 150 mcg dans chaque narine 3 fois par jour à partir du 21e ou du 2e jour du cycle menstruel, cure de 1 à 3 mois, ou
- dépôt de buséréline par voie intramusculaire 3,75 mg une fois tous les 28 jours à partir du 21e ou du 2e jour du cycle menstruel, cure de 1 à 3 mois, ou
- leuproréline par voie sous-cutanée 3,75 mg une fois tous les 28 jours à partir du 21e ou du 2e jour du cycle menstruel, cure de 1 à 3 mois, ou
- triptoréline par voie sous-cutanée 3,75 mg une fois tous les 28 jours ou 0,1 mg une fois par jour à partir du 21e ou du 2e jour du cycle menstruel, cure de 1 à 3 mois.
En principe, le jour (21e ou 2e) du cycle menstruel à partir duquel les agonistes de la GnRH sont prescrits n'a pas d'importance. Cependant, une prescription à partir du 21e jour est préférable, car dans ce cas, les kystes ovariens ne se forment pas. Lorsqu'ils sont prescrits à partir du 2e jour du cycle, la phase d'activation précédant la phase de suppression du mécanisme d'action de l'agoniste de la GnRH coïncide avec la phase folliculaire du cycle et peut entraîner la formation de kystes ovariens.
Médicaments alternatifs:
- éthinylestradiol/diénogest par voie orale 30 mcg/2 mg une fois par jour du 5e au 25e jour du cycle menstruel, cure de 3 à 6 mois ou
- éthinylestradiol/acétate de cyprotérone par voie orale 35 mcg/2 mg une fois par jour du 5e au 25e jour du cycle menstruel, cure de 3 à 6 mois.
- Dans la forme surrénalienne du syndrome des ovaires polykystiques, l'administration de glucocorticoïdes est indiquée:
- dexaméthasone par voie orale 0,25 à 1 mg une fois par jour, cure de 3 à 6 mois, ou
- méthylprednisolone par voie orale 2 à 8 mg une fois par jour, traitement de 3 à 6 mois, ou
- prednisolone par voie orale 2,5 à 10 mg une fois par jour, traitement de 3 à 6 mois.
- Pour la forme centrale du syndrome des ovaires polykystiques, des anticonvulsivants sont utilisés:
- diphénine 1 comprimé par voie orale 1 à 2 fois par jour;
- carbamazépine par voie orale 100 mg 2 fois par jour, cure de 3 à 6 mois.
Au 2ème stade, une stimulation de l'ovulation est réalisée.
Le choix des médicaments et leur schéma d'administration sont déterminés en tenant compte des données cliniques et biologiques. Lors de l'induction de l'ovulation, une échographie et une surveillance hormonale rigoureuses du cycle stimulé sont réalisées.
Il est inacceptable d'induire l'ovulation par quelque médicament que ce soit sans surveillance échographique. Il est inapproprié de débuter l'induction de l'ovulation en présence de formations kystiques ovariennes d'un diamètre supérieur à 15 mm et d'une épaisseur endométriale supérieure à 5 mm.
L'induction de l'ovulation par clomifène est indiquée chez les jeunes femmes ayant de courts antécédents de la maladie et des taux d'œstrogènes suffisants (estradiol sérique < 150 pmol/l) et de faibles taux de LH (> 15 UI/l).
Le clomifène est prescrit par voie orale à raison de 100 mg une fois par jour du 5e au 9e jour du cycle menstruel à la même heure de la journée.
Une échographie de contrôle est réalisée le 10e jour du cycle. Le diamètre du follicule dominant et l'épaisseur de l'endomètre sont évalués. Les examens sont effectués tous les deux jours, et quotidiennement en période périovulatoire. Ce n'est pas le jour du cycle qui compte, mais la taille du follicule dominant: si son diamètre est supérieur à 16 mm, il est nécessaire de réaliser une échographie quotidienne jusqu'à ce qu'il atteigne 20 mm.
Schémas thérapeutiques alternatifs (avec effet anti-œstrogénique prononcé):
Schéma 1:
- clomifène par voie orale 100 mg 1 fois par jour du 5e au 9e jour du cycle menstruel à la même heure de la journée +
- éthinylestradiol (EE) par voie orale 50 mcg 2 fois par jour du 10e au 15e jour du cycle menstruel ou
- estradiol par voie orale 2 mg 2 fois par jour du 10e au 15e jour du cycle menstruel.
Schéma 2:
- clomifène par voie orale 100 mg 1 fois par jour du 3e au 7e jour du cycle menstruel à la même heure de la journée +
- ménotropines par voie intramusculaire 75 à 150 UI une fois par jour à la même heure à partir du 7e ou 8e jour du cycle menstruel ou
- follitropine alpha par voie intramusculaire 75–150 UI une fois par jour à la même heure à partir du 7e–8e jour du cycle menstruel.
L'induction de l'ovulation avec du citrate de clomifène n'est pas indiquée dans les situations suivantes:
- en cas d’hypoestrogénie (taux d’estradiol sérique < 150 pmol/l);
- après une préparation préliminaire avec des agonistes de la GnRH (en raison d'une diminution de la sensibilité du système hypothalamo-hypophyso-ovarien, un hypoestrogénie se développe);
- chez les femmes en âge de procréer avancé, présentant une longue histoire de la maladie et un taux sérique élevé de LH (> 15 UI/L). Il est inapproprié d'augmenter la dose de clomifène à 150 mg/jour lors de cycles de stimulation répétés, car l'effet anti-œstrogénique périphérique négatif augmente.
Il n'est pas recommandé d'effectuer plus de 3 cycles consécutifs de stimulation au clomifène; si le traitement est inefficace, il faut utiliser des gonadotrophines.
La stimulation de l'ovulation par les gonadotrophines est indiquée en l'absence de folliculogenèse adéquate après stimulation par le clomifène, en présence d'un effet anti-œstrogénique périphérique prononcé ou d'une saturation œstrogénique insuffisante. Elle peut être réalisée aussi bien chez les patientes jeunes qu'en âge de procréer avancé.
Médicaments de choix:
- ménotropines par voie intramusculaire 150–225 UI une fois par jour du 3e au 5e jour du cycle menstruel au même moment, cure de 7 à 15 jours ou
- urofollitropine par voie intramusculaire 150–225 UI une fois par jour du 3e au 5e jour du cycle menstruel à la même heure, cure de 7 à 15 jours.
Médicaments alternatifs (en cas de risque élevé de développer un syndrome d’hyperstimulation ovarienne):
- Follitropine alpha par voie intramusculaire, 100 à 150 UI une fois par jour, du 3e au 5e jour du cycle menstruel, à la même période, pendant 7 à 15 jours. L'induction de l'ovulation par des gonadotrophines utilisant des analogues de la GnRH est indiquée en cas de syndrome des ovaires polykystiques avec taux élevés de LH dans le sérum sanguin (> 15 UI/L).
Médicaments de choix:
- buséréline sous forme de pulvérisation de 150 mcg dans chaque narine 3 fois par jour à partir du 21e jour du cycle menstruel ou
- dépôt de buséréline par voie intramusculaire 3,75 mg une fois le 21e jour du cycle menstruel;
- leuproréline par voie sous-cutanée 3,75 mg une fois le 21e jour du cycle menstruel;
- triptoréline par voie sous-cutanée 3,75 mg une fois le 21e jour du cycle menstruel ou 0,1 mg une fois par jour à partir du 21e jour du cycle menstruel +
- ménotropines par voie intramusculaire 225–300 UI une fois par jour à partir du 2e–3e jour du cycle menstruel suivant en même temps.
Médicaments alternatifs (en cas de risque élevé de développer un syndrome d’hyperstimulation ovarienne):
- ménotropines par voie intramusculaire 150–225 UI une fois par jour à partir du 2e–3e jour du cycle menstruel à la même heure ou
- follitropine alpha par voie intramusculaire 150–225 UI une fois par jour à partir du 2e–3e jour du cycle menstruel à la même heure +
- ganirelix par voie sous-cutanée 0,25 mg une fois par jour, à partir du 5e au 7e jour d'utilisation de la gonadotrophine (lorsque le follicule dominant atteint une taille de 13 à 14 mm);
- cétrorélix par voie sous-cutanée 0,25 mg une fois par jour, à partir du 5e au 7e jour d'utilisation de la gonadotrophine (lorsque le follicule dominant atteint une taille de 13 à 14 mm).
Induction de l'ovulation chez les patientes en âge de procréer tardif (avec une faible réponse ovarienne aux médicaments gonadotropes).
Médicaments de choix:
- ménotropines par voie intramusculaire 225 UI une fois par jour du 3e au 5e jour du cycle menstruel à la même heure +
- triptoréline par voie sous-cutanée 0,1 mg une fois par jour à partir du 2ème jour du cycle menstruel.
Médicaments alternatifs:
- triptoréline par voie sous-cutanée 0,1 mg une fois par jour à partir du 2e jour du cycle menstruel +
- follitropine alpha par voie intramusculaire 200–225 UI une fois par jour du 3e au 5e jour du cycle menstruel en même temps.
Dans tous les schémas utilisant des gonadotrophines, l'adéquation de la dose est évaluée par la dynamique de croissance folliculaire (normalement 2 mm/jour). En cas de croissance folliculaire lente, la dose est augmentée de 75 UI; en cas de croissance trop rapide, elle est réduite de 75 UI.
Dans tous les schémas, s’il existe un follicule mature mesurant 18 à 20 mm et que l’épaisseur de l’endomètre est d’au moins 8 mm, le traitement est arrêté et la gonadotrophine chorionique humaine est administrée par voie intramusculaire à une dose unique de 10 000 UI.
Une fois l’ovulation confirmée, la phase lutéale du cycle est soutenue.
Médicaments de choix:
- dydrogestérone par voie orale 10 mg 1 à 3 fois par jour, cure de 10 à 12 jours ou
- Progestérone par voie orale 100 mg 2 à 3 fois par jour, ou par voie vaginale 100 mg 2 à 3 fois par jour, ou par voie intramusculaire 250 mg 1 fois par jour, pendant 10 à 12 jours. Autre traitement (en l'absence de symptômes d'hyperstimulation ovarienne):
- gonadotrophine chorionique humaine par voie intramusculaire 1 500 à 2 500 UI une fois par jour les jours 3, 5 et 7 de la phase lutéale.
Autres médicaments utilisés dans le traitement du SOPK:
- Antiandrogènes (par exemple, spironolactone, leuprolide, finastéride).
- Médicaments hypoglycémiants (par exemple, metformine, insuline).
- Modulateurs sélectifs des récepteurs aux œstrogènes (par exemple, citrate de clomifène).
- Médicaments contre l'acné (par exemple, peroxyde de benzoyle, crème de trétinoïne (0,02-0,1 %)/gel (0,01-0,1 %)/solution (0,05 %), crème d'adapalène (0,1 %)/gel (0,1 %, 0,3 %)/solution (0,1 %), érythromycine 2 %, clindamycine 1 %, sulfétamide sodique 10 %).
Effets secondaires du traitement
Lors de l'utilisation de clomifène, la plupart des patientes développent un effet anti-œstrogénique périphérique, qui se traduit par un retard de la croissance endométriale par rapport à la croissance folliculaire et une diminution de la glaire cervicale. L'utilisation de gonadotrophines, en particulier de gonadotrophines ménopausiques humaines (ménotropines), peut entraîner un syndrome d'hyperstimulation ovarienne (SHO). L'utilisation de FSH recombinante (follitropine alpha) diminue le risque de syndrome d'hyperstimulation ovarienne. L'utilisation de schémas thérapeutiques incluant des agonistes de la GnRH (triptoréline, buséréline, leuproréline) augmente le risque de syndrome d'hyperstimulation ovarienne, et l'utilisation d'agonistes de la GnRH peut provoquer des symptômes de déficit en œstrogènes: bouffées de chaleur, sécheresse cutanée et muqueuses.
Prévoir
L'efficacité du traitement de l'infertilité dans le syndrome des ovaires polykystiques dépend des caractéristiques cliniques et hormonales de l'évolution de la maladie, de l'âge de la femme, de l'adéquation du traitement préparatoire et de la sélection correcte du régime d'induction de l'ovulation.
Chez 30 % des jeunes femmes ayant des antécédents récents de la maladie, une grossesse peut être obtenue après un traitement préparatoire sans induction de l’ovulation.
L'efficacité de la stimulation de l'ovulation par le clomifène ne dépasse pas 30 % par femme; 40 % des patientes atteintes du syndrome des ovaires polykystiques sont résistantes au clomifène.
L'utilisation de ménotropines et d'urofollitropine permet d'obtenir une grossesse chez 45 à 50 % des femmes, mais ces médicaments augmentent le risque de développer un syndrome d'hyperstimulation ovarienne.
Les schémas thérapeutiques utilisant des agonistes de la GnRH sont les plus efficaces, car ils permettent d'éviter les pics de LH « parasites »: jusqu'à 60 % des grossesses par femme. Cependant, l'utilisation de ces médicaments entraîne un risque plus élevé de complications: formes sévères de syndrome d'hyperstimulation ovarienne, grossesses multiples. L'utilisation d'antagonistes de la GnRH est tout aussi efficace, mais n'est pas associée à un risque élevé de syndrome d'hyperstimulation ovarienne.
 [ 34 ]
[ 34 ]

