Expert médical de l'article
Nouvelles publications
Ovaire
Dernière revue: 04.07.2025

Tout le contenu iLive fait l'objet d'un examen médical ou d'une vérification des faits pour assurer autant que possible l'exactitude factuelle.
Nous appliquons des directives strictes en matière d’approvisionnement et ne proposons que des liens vers des sites de médias réputés, des instituts de recherche universitaires et, dans la mesure du possible, des études évaluées par des pairs sur le plan médical. Notez que les nombres entre parenthèses ([1], [2], etc.) sont des liens cliquables vers ces études.
Si vous estimez qu'un contenu quelconque de notre contenu est inexact, obsolète ou discutable, veuillez le sélectionner et appuyer sur Ctrl + Entrée.
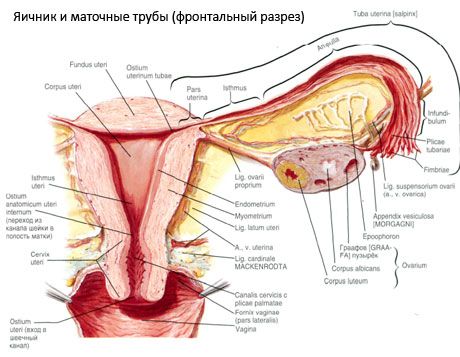
L'ovaire (ovarium; grec oophoron) est un organe apparié, une glande reproductrice féminine, située dans la cavité pelvienne, derrière le ligament large de l'utérus. Dans les ovaires, les cellules reproductrices femelles (ovules) se développent et mûrissent, et des hormones sexuelles féminines sont produites, qui circulent dans le sang et la lymphe. L'ovaire a une forme ovoïde, légèrement aplatie antéropostérieurement. Il est de couleur rosâtre. À la surface de l'ovaire d'une femme qui a accouché, des dépressions et des cicatrices sont visibles: traces d'ovulation et de transformation du corps jaune. L'ovaire pèse entre 5 et 8 g. Ses dimensions sont: longueur 2,5 à 5,5 cm, largeur 1,5 à 3,0 cm, épaisseur jusqu'à 2 cm. L'ovaire possède deux faces libres: la face médiale (faciès médial), tournée vers la cavité pelvienne et partiellement recouverte par la trompe de Fallope, et la face latérale (faciès latéralis), adjacente à la paroi latérale du bassin, jusqu'à une dépression légèrement marquée: la fosse ovarienne. Cette fosse est située à l'angle entre les vaisseaux iliaques externes, recouverts de péritoine en haut, et les artères utérine et obturatrice en bas. Derrière l'ovaire, l'uretère du côté correspondant passe rétropéritonéalement de haut en bas.
Les surfaces de l'ovaire se prolongent par un bord libre (postérieur) convexe (margo liber), puis par le bord mésentérique (margo mesovaricus), rattaché par un court repli du péritoine (mésentère de l'ovaire) au feuillet postérieur du ligament large de l'utérus. Sur ce bord antérieur de l'organe se trouve une dépression sillonnée: le hile de l'ovaire (hilum ovarii), par lequel l'artère et les nerfs pénètrent dans l'ovaire, et les veines et les vaisseaux lymphatiques en sortent. L'ovaire possède également deux extrémités: l'extrémité tubulaire supérieure arrondie (extremitas tubaria), tournée vers la trompe de Fallope, et l'extrémité utérine inférieure (extremitas utenna), reliée à l'utérus par le ligament ovarien (lig. ovarii proprium). Ce ligament, en forme de cordon rond d'environ 6 mm d'épaisseur, relie l'extrémité utérine de l'ovaire à l'angle latéral de l'utérus, situé entre les deux feuillets du ligament large. L'appareil ligamentaire de l'ovaire comprend également le ligament suspenseur de l'ovaire (lig.suspensorium ovarii), un repli du péritoine qui s'étend de la paroi du petit bassin à l'ovaire et contient les vaisseaux ovariens et les faisceaux de fibres. L'ovaire est fixé par un court mésentère (mésovarium), une duplication du péritoine qui s'étend du feuillet postérieur du ligament large de l'utérus au bord mésentérique de l'ovaire. Les ovaires eux-mêmes ne sont pas recouverts par le péritoine. La plus grande frange ovarienne de la trompe de Fallope est fixée à l'extrémité tubulaire de l'ovaire. La topographie de l'ovaire dépend de la position de l'utérus et de sa taille (pendant la grossesse). Les ovaires sont des organes très mobiles de la cavité pelvienne.
Vaisseaux et nerfs de l'ovaire
L'apport sanguin aux ovaires est assuré par les artères ovariennes (aa. et vv. ovaricae et uterinae). Les deux artères ovariennes (aa. ovaricae dextra et sinistra) naissent de la face antérieure de l'aorte, juste en dessous des artères rénales; la droite naît généralement de l'aorte et la gauche de l'artère rénale. Se dirigeant vers le bas et latéralement le long de la face antérieure du muscle grand psoas, chaque artère ovarienne croise l'uretère en avant (lui donnant des branches), les vaisseaux iliaques externes, la ligne de démarcation et pénètre dans la cavité pelvienne, se situant à cet endroit dans le ligament suspenseur de l'ovaire. En direction médiale, l'artère ovarienne passe entre les feuillets du ligament large de l'utérus, sous la trompe de Fallope, lui donnant des branches, puis dans le mésentère de l'ovaire; elle pénètre dans le hile de l'ovaire.
Les branches de l'artère ovarienne s'anastomosent largement avec les branches ovariennes de l'artère utérine. Le flux veineux ovarien s'écoule principalement dans le plexus veineux ovarien, situé dans la région du hile ovarien. De là, le sang circule dans deux directions: les veines utérines et ovariennes. La veine ovarienne droite, munie de valvules, se jette dans la veine cave inférieure. La veine ovarienne gauche, quant à elle, se jette dans la veine rénale gauche, bien qu'elle ne possède pas de valvules.
Le drainage lymphatique des ovaires s'effectue par les vaisseaux lymphatiques, particulièrement abondamment dans la zone de la porte des organes, où se distingue le plexus lymphatique sous-ovarien. La lymphe est ensuite évacuée le long des vaisseaux lymphatiques ovariens jusqu'aux ganglions para-aortiques.
Innervation des ovaires
Sympathique - assuré par les fibres postganglionnaires des plexus cœliaque (solaire), mésentériques supérieurs et hypogastriques; parasympathique - par les nerfs sacrés viscéraux.
Structure de l'ovaire
La surface de l'ovaire est recouverte d'un épithélium germinatif monocouche. Sous celui-ci se trouve une épaisse couche de tissu conjonctif protéique (tunique albuginée). Ce tissu conjonctif forme le stroma ovarien (stroma ovarii), riche en fibres élastiques. Le parenchyme ovarien est divisé en deux couches: externe et interne. La couche interne, située au centre de l'ovaire, près de sa porte, est appelée médullaire (medulla ovarii). Cette couche, constituée de tissu conjonctif lâche, abrite de nombreux vaisseaux sanguins et lymphatiques, ainsi que des nerfs. La couche externe de l'ovaire, le cortex ovarien (cortex ovarii), est plus dense. Il contient beaucoup de tissu conjonctif, dans lequel se trouvent les follicules ovariens primaires en cours de maturation (folliculi ovarici primarii), les follicules secondaires (vésiculaires) (folliculi ovarici secundarii, s.vesiculosi), ainsi que les follicules matures, les follicules de Graaf (folliculi ovarici maturis), ainsi que les corps jaunes et atrétiques.
Chaque follicule contient un ovule reproducteur femelle, ou ovocyte (ovocyte). L'ovule mesure jusqu'à 150 µm de diamètre, est rond et contient un noyau, une importante quantité de cytoplasme qui, outre les organites cellulaires, contient des inclusions protéiques et lipidiques (le vitellus) et du glycogène, nécessaires à sa nutrition. L'ovule consomme généralement ses réserves de nutriments dans les 12 à 24 heures suivant l'ovulation. En l'absence de fécondation, l'ovule meurt.
L'ovule humain est recouvert de deux membranes. À l'intérieur se trouve le cytolemme, la membrane cytoplasmique de l'ovule. À l'extérieur du cytolemme se trouve une couche de cellules folliculaires, qui protègent l'ovule et assurent une fonction hormonale: elles sécrètent des œstrogènes.
La position physiologique de l'utérus, des trompes et des ovaires est assurée par les appareils de suspension, de fixation et de soutien qui unissent le péritoine, les ligaments et le tissu pelvien. L'appareil de suspension est représenté par des formations appariées, comprenant les ligaments rond et large de l'utérus, les ligaments propres et les ligaments de suspension des ovaires. Les ligaments larges de l'utérus, les ligaments propres et les ligaments de suspension des ovaires maintiennent l'utérus en position médiane. Les ligaments ronds tirent le fundus de l'utérus vers l'avant et assurent son inclinaison physiologique.
L'appareil de fixation (d'ancrage) assure le positionnement de l'utérus au centre du petit bassin et rend pratiquement impossible tout déplacement latéral. Cependant, comme l'appareil ligamentaire s'écarte de l'utérus dans sa partie inférieure, des inclinaisons utérines variables sont possibles. L'appareil de fixation comprend des ligaments situés dans les tissus lâches du bassin et s'étendant de la partie inférieure de l'utérus jusqu'aux parois latérales, antérieures et postérieures du bassin: ligaments sacro-magique, cardinal, utéro-vésical et vésico-pubien.
En plus du mésovarium, on distingue les ligaments ovariens suivants:
- Le ligament suspenseur de l'ovaire, autrefois appelé ligament infundibulopelvien, est un repli du péritoine traversé par les vaisseaux sanguins (a. et v. ovarica), les vaisseaux lymphatiques et les nerfs de l'ovaire. Il est tendu entre la paroi latérale du bassin, le fascia lombaire (au niveau de la division de l'artère iliaque commune en artère externe et interne) et l'extrémité supérieure (tubaire) de l'ovaire.
- Le ligament propre de l'ovaire passe entre les feuillets du ligament large utérin, plus près du feuillet postérieur, et relie l'extrémité inférieure de l'ovaire au bord latéral de l'utérus. Il est fixé à l'utérus entre le début de la trompe de Fallope et le ligament rond, en arrière et au-dessus de ce dernier. Dans l'épaisseur du ligament passent les artères utérines, branches terminales de l'artère utérine.
- Ligament appendiculaire-ovarien. Ce ligament s'étend du mésentère de l'appendice jusqu'à l'ovaire droit ou au ligament large de l'utérus, formant un repli péritonéal. Il est instable et est observé chez 1/2 à 1/3 des femmes.
L'appareil de soutien est représenté par les muscles et les fascias du plancher pelvien, divisés en couches inférieure, moyenne et supérieure (interne).
La couche musculaire supérieure (interne) est la plus puissante. Elle est représentée par le muscle pair qui soulève l'anus. Elle est constituée de faisceaux musculaires qui s'étendent du coccyx aux os du bassin dans trois directions (pubo-coccygien, ilio-coccygien et ischio-coccygien). Cette couche musculaire est également appelée diaphragme pelvien.
La couche musculaire moyenne se situe entre la symphyse, le pubis et l'ischion. Le diaphragme urogénital occupe la moitié antérieure du détroit pelvien, traversé par l'urètre et le vagin. Dans la partie antérieure, entre ses feuillets, se trouvent les faisceaux musculaires qui forment le sphincter externe de l'urètre; dans la partie postérieure, les faisceaux musculaires qui se dirigent transversalement: le muscle transverse profond du périnée.
La couche inférieure (externe) des muscles du plancher pelvien est constituée de muscles superficiels dont la forme ressemble au chiffre 8. Il s'agit notamment du muscle bulbocaverneux, de l'ischiocaverneux, du sphincter anal externe et du muscle périnéal transverse superficiel.
Ontogenèse des ovaires
Le processus de croissance et d'atrésie folliculaires débute à 20 semaines de grossesse. Au moment de l'accouchement, il reste jusqu'à 2 millions d'ovocytes dans les ovaires de la jeune fille. À la ménarche, leur nombre chute à 300 000. Durant toute la vie reproductive, pas plus de 500 follicules atteignent la maturité et ovulent. La croissance initiale des follicules ne dépend pas de la stimulation par la FSH, est limitée et l'atrésie survient rapidement. On pense que, contrairement aux hormones stéroïdes, les peptides autocrines/paracrines locaux sont les principaux régulateurs de la croissance et de l'atrésie des follicules primaires. On pense que le processus de croissance et d'atrésie folliculaires n'est interrompu par aucun processus physiologique. Ce processus se poursuit à tous les âges, y compris pendant la période intra-utérine et la ménopause, et est interrompu par la grossesse, l'ovulation et l'anovulation. Le mécanisme qui déclenche la croissance des follicules et leur nombre à chaque cycle reste encore flou.
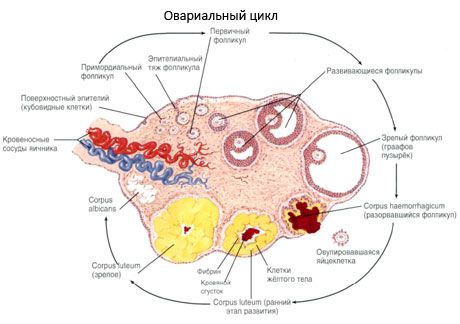
Au cours de son développement, le follicule traverse plusieurs stades. Les cellules germinales primordiales proviennent de l'endoderme du sac vitellin, de l'allantoïde, et migrent vers la région génitale de l'embryon à 5-6 semaines de grossesse. Grâce à une division mitotique rapide, qui se poursuit de 6-8 semaines à 16-20 semaines de grossesse, jusqu'à 6 à 7 millions d'ovocytes se forment dans les ovaires de l'embryon, entourés d'une fine couche de cellules de la granulosa.
Follicule préantral: l’ovocyte est entouré d’une membrane (zone pellucide). Les cellules de la granulosa entourant l’ovocyte commencent à proliférer. Leur croissance dépend des gonadotrophines et est corrélée au taux d’œstrogènes. Les cellules de la granulosa sont la cible de la FSH. Au stade du follicule préantral, les cellules de la granulosa sont capables de synthétiser trois classes de stéroïdes: elles induisent principalement l’activité de l’aromatase, principale enzyme qui convertit les androgènes en œstradiol. On pense que l’œstradiol est capable d’augmenter le nombre de ses propres récepteurs, exerçant ainsi un effet mitogène direct sur les cellules de la granulosa, indépendamment de la FSH. Il est considéré comme un facteur paracrine qui renforce les effets de la FSH, notamment en activant les processus d’aromatisation.
Les récepteurs de la FSH apparaissent sur les membranes des cellules de la granulosa dès le début de la croissance folliculaire. Une diminution ou une augmentation de la FSH entraîne une modification du nombre de ses récepteurs. Cette action de la FSH est modulée par des facteurs de croissance. La FSH agit par l'intermédiaire de la protéine G, le système adénylate cyclase. Bien que la stéroïdogenèse folliculaire soit principalement régulée par la FSH, de nombreux facteurs interviennent dans ce processus: canaux ioniques, récepteurs de tyrosine kinase, système phospholipase des seconds messagers.
Le rôle des androgènes dans le développement folliculaire précoce est complexe. Les cellules de la granulosa possèdent des récepteurs aux androgènes. Ceux-ci servent non seulement de substrat à l'aromatisation en œstrogènes induite par la FSH, mais peuvent également favoriser cette aromatisation à faible concentration. Lorsque les taux d'androgènes augmentent, les cellules de la granulosa préantrale choisissent préférentiellement, non pas la voie d'aromatisation en œstrogènes, mais la voie androgénique plus simple via la 5a-réductase pour se convertir en un androgène non transformable en œstrogène, inhibant ainsi l'activité de l'aromatase. Ce processus inhibe également la formation des récepteurs de la FSH et de la LH, stoppant ainsi le développement folliculaire.
Lors du processus d'aromatisation, le follicule présentant des taux élevés d'androgènes subit un processus d'atrésie. La croissance et le développement du follicule dépendent de sa capacité à convertir les androgènes en œstrogènes.
En présence de FSH, les œstrogènes constituent la substance dominante du liquide folliculaire. En son absence, ce sont les androgènes. La LH est normalement absente du liquide folliculaire jusqu'au milieu du cycle. Dès que le taux de LH augmente, l'activité mitotique des cellules de la granulosa diminue, des modifications dégénératives apparaissent et le taux d'androgènes dans le follicule augmente. Le taux de stéroïdes dans le liquide folliculaire est plus élevé que dans le plasma et reflète l'activité fonctionnelle des cellules ovariennes: cellules de la granulosa et cellules de la thèque. Si la FSH cible uniquement les cellules de la granulosa, la LH a alors de nombreuses cibles: cellules de la thèque, cellules stromales et lutéiniques, et cellules de la granulosa. Les cellules de la granulosa et de la thèque ont toutes deux la capacité de stéroïdogenèse, mais l'activité aromatase prédomine dans les cellules de la granulosa.
En réponse à la LH, les cellules de la thèque produisent des androgènes, qui sont ensuite convertis par les cellules de la granulosa en œstrogènes par aromatisation induite par la FSH.
À mesure que le follicule se développe, les cellules de la thèque commencent à exprimer les gènes des récepteurs de la LH, de la P450 sec et de la 3bêta-hydroxystéroïde déshydrogénase, le facteur de croissance analogue à l'insuline (IGF-1) en synergie avec la LH augmente l'expression des gènes, mais ne stimule pas la stéroïdogenèse.
La stéroïdogenèse ovarienne est toujours dépendante de la LH. À mesure que le follicule se développe, les cellules thécales expriment l'enzyme P450c17, qui synthétise des androgènes à partir du cholestérol. Les cellules de la granulosa ne possèdent pas cette enzyme et dépendent des cellules thécales pour produire des œstrogènes à partir des androgènes. Contrairement à la stéroïdogenèse, la folliculogenèse est dépendante de la FSH. À mesure que le follicule se développe et que les taux d'œstrogènes augmentent, un mécanisme de rétroaction s'active: la production de FSH est inhibée, ce qui entraîne une diminution de l'activité aromatase du follicule et, in fine, une atrésie folliculaire par apoptose (mort cellulaire programmée).
Le mécanisme de rétroaction des œstrogènes et de la FSH inhibe le développement des follicules en croissance, mais pas celui du follicule dominant. Ce dernier contient davantage de récepteurs de la FSH, qui favorisent la prolifération des cellules de la granulosa et l'aromatisation des androgènes en œstrogènes. De plus, les voies paracrine et autocrine jouent un rôle important dans la coordination du développement du follicule antrale.
Le régulateur autocrine/paracrine est constitué de peptides (inhibine, activine, follistatine), synthétisés par les cellules de la granulosa en réponse à la FSH et pénétrant dans le liquide folliculaire. L'inhibine réduit la sécrétion de FSH; l'activine stimule la libération de FSH par l'hypophyse et renforce son action dans l'ovaire; la follistatine inhibe l'activité de la FSH, probablement en se liant à l'activine. Après l'ovulation et le développement du corps jaune, l'inhibine est sous le contrôle de la LH.
La croissance et la différenciation des cellules ovariennes sont influencées par les facteurs de croissance analogues à l'insuline (IGE). L'IGF-1 agit sur les cellules de la granulosa, provoquant une augmentation des taux d'adénosine monophosphate cyclique (AMPc), de progestérone, d'ocytocine, de protéoglycane et d'inhibine.
L'IGF-1 agit sur les cellules thécales, provoquant une augmentation de la production d'androgènes. Les cellules thécales, à leur tour, produisent du facteur de nécrose tumorale (TNF) et du facteur de croissance épidermique (EGF), également régulés par la FSH.
L'EGF stimule la prolifération des cellules de la granulosa. L'IGF-2 est le principal facteur de croissance du liquide folliculaire, et on y trouve également l'IGF-1, le TNF-a, le TNF-3 et l'EGF.
La perturbation de la régulation paracrine et/ou autocrine de la fonction ovarienne semble jouer un rôle dans les troubles de l’ovulation et dans le développement des ovaires polykystiques.
À mesure que le follicule antrale se développe, la teneur en œstrogènes du liquide folliculaire augmente. Au plus fort de cette augmentation, des récepteurs à la LH apparaissent sur les cellules de la granulosa, ce qui entraîne leur lutéinisation et une augmentation de la production de progestérone. Ainsi, en période préovulatoire, une augmentation de la production d'œstrogènes entraîne l'apparition de récepteurs à la LH, qui, à son tour, provoque la lutéinisation des cellules de la granulosa et la production de progestérone. Une augmentation de la progestérone réduit les taux d'œstrogènes, ce qui semble provoquer un second pic de FSH en milieu de cycle.
On estime que l'ovulation survient 10 à 12 heures après le pic de LH et 24 à 36 heures après le pic d'œstradiol. La LH stimulerait la division réductrice de l'ovocyte, la lutéinisation des cellules de la granulosa et la synthèse de progestérone et de prostaglandine dans le follicule.
La progestérone stimule l'activité des enzymes protéolytiques qui, avec la prostaglandine, participent à la rupture de la paroi folliculaire. Le pic de FSH induit par la progestérone permet à l'ovocyte de sortir du follicule en convertissant le plasminogène en plasmine, une enzyme protéolytique, et fournit un nombre suffisant de récepteurs de LH pour le développement normal de la phase lutéale.
Dans les 3 jours suivant l'ovulation, les cellules de la granulosa augmentent de taille et des vacuoles caractéristiques remplies de lutéine, un pigment, apparaissent. Les cellules thécales-lutéales se différencient de la thèque et du stroma et deviennent partie intégrante du corps jaune. Les capillaires pénétrant le corps jaune se développent très rapidement sous l'influence des facteurs d'angiogenèse. Grâce à une meilleure vascularisation, la production de progestérone et d'œstrogènes augmente. L'activité de la stéroïdogenèse et la durée de vie du corps jaune sont déterminées par le taux de LH. Le corps jaune n'est pas une formation cellulaire homogène. Outre deux types de cellules lutéales, il contient des cellules endothéliales, des macrophages, des fibroblastes, etc. Les grandes cellules lutéales produisent des peptides (relaxine, ocytocine) et sont plus actives dans la stéroïdogenèse, avec une activité aromatase et une synthèse de progestérone supérieures à celles des petites cellules.
Le pic de progestérone survient le 8e jour après le pic de LH. Il est à noter que la progestérone et l'œstradiol sont sécrétés épisodiquement pendant la phase lutéale, en corrélation avec la production pulsatile de LH. Avec la formation du corps jaune, le contrôle de la production d'inhibine passe de la FSH à la LH. L'inhibine augmente avec l'augmentation de l'œstradiol avant le pic de LH et continue d'augmenter après, bien que les taux d'œstrogènes diminuent. Bien que l'inhibine et l'œstradiol soient sécrétés par les cellules de la granulosa, ils sont régulés par des voies différentes. La baisse de l'inhibine à la fin de la phase lutéale contribue à l'augmentation de la FSH pour le cycle suivant.
Le corps jaune diminue très rapidement - du 9e au 11e jour après l'ovulation.
Le mécanisme de dégénérescence est mal connu et n'est lié ni au rôle lutéolytique des œstrogènes ni à un mécanisme lié aux récepteurs, comme observé dans l'endomètre. Il existe une autre explication au rôle des œstrogènes produits par le corps jaune. On sait que les œstrogènes sont nécessaires à la synthèse des récepteurs de la progestérone dans l'endomètre. Les œstrogènes de la phase lutéale sont probablement nécessaires aux modifications de l'endomètre liées à la progestérone après l'ovulation. Un développement insuffisant des récepteurs de la progestérone, dû à des taux d'œstrogènes insuffisants, pourrait être un mécanisme supplémentaire d'infertilité et de fausses couches précoces, une autre forme de déficit de la phase lutéale. On pense que la durée de vie du corps jaune est établie au moment de l'ovulation. Et il régressera certainement s'il n'est pas soutenu par la gonadotrophine chorionique humaine due à une grossesse. Ainsi, la régression du corps jaune entraîne une diminution des taux d'œstradiol, de progestérone et d'inhibine. Une diminution de l'inhibine supprime son effet suppresseur sur la FSH; une diminution de l'œstradiol et de la progestérone permet une restauration très rapide de la sécrétion de GnRH et la suppression du mécanisme de rétroaction de l'hypophyse. Une diminution de l'inhibine et de l'œstradiol, associée à une augmentation de la GnRH, donne naissance à la FSH plutôt qu'à la LH. Une augmentation de la FSH entraîne la croissance folliculaire, suivie de la sélection d'un follicule dominant, et un nouveau cycle commence en l'absence de grossesse. Les hormones stéroïdes jouent un rôle majeur en biologie de la reproduction et en physiologie générale. Elles déterminent le phénotype humain, affectent le système cardiovasculaire, le métabolisme osseux, la peau, le bien-être général et jouent un rôle clé dans la grossesse. L'action des hormones stéroïdes reflète les mécanismes intracellulaires et génétiques nécessaires à la transmission d'un signal extracellulaire au noyau cellulaire pour provoquer une réponse physiologique.
Les œstrogènes pénètrent de manière diffuse la membrane cellulaire et se lient aux récepteurs situés dans le noyau cellulaire. Le complexe récepteur-stéroïde se lie ensuite à l'ADN. Dans les cellules cibles, ces interactions conduisent à l'expression génétique, à la synthèse protéique et à des fonctions cellulaires et tissulaires spécifiques.


 [
[