Expert médical de l'article
Nouvelles publications
Anémie hypophysaire (nanisme)
Dernière revue: 12.07.2025

Tout le contenu iLive fait l'objet d'un examen médical ou d'une vérification des faits pour assurer autant que possible l'exactitude factuelle.
Nous appliquons des directives strictes en matière d’approvisionnement et ne proposons que des liens vers des sites de médias réputés, des instituts de recherche universitaires et, dans la mesure du possible, des études évaluées par des pairs sur le plan médical. Notez que les nombres entre parenthèses ([1], [2], etc.) sont des liens cliquables vers ces études.
Si vous estimez qu'un contenu quelconque de notre contenu est inexact, obsolète ou discutable, veuillez le sélectionner et appuyer sur Ctrl + Entrée.
Le terme « nanisme hypophysaire » (du grec nanos - nain; syn.: nanisme, nanosomie, microsomie) désigne au sens absolu une maladie dont la principale manifestation est un retard brutal de croissance, associé à une violation de la sécrétion d'hormone de croissance par l'hypophyse antérieure.
Au sens large, le nanisme est un trouble de la croissance et du développement physique, dont l'apparition peut être causée non seulement par une déficience absolue ou relative de l'hormone somatotrope due à une pathologie de l'hypophyse elle-même, mais également par un trouble de la régulation hypothalamique (cérébrale) de ses fonctions, des défauts dans la biosynthèse de l'hormone somatotrope et des troubles de la sensibilité tissulaire à cette hormone.
Causes nanisme
La plupart des formes de nanisme hypophysaire sont des maladies génétiques. La plus fréquente est le nanisme panhypopituitaire, principalement transmissible de manière récessive. On suppose qu'il existe deux modes de transmission: autosomique et par le chromosome X. Dans cette forme de nanisme, outre le défaut de sécrétion de l'hormone somatotrope, la sécrétion des gonadotrophines et de la thyréostimuline est le plus souvent perturbée. La sécrétion d'ACTH est perturbée moins souvent et dans une moindre mesure. Des études fonctionnelles portant sur des hormones de libération, notamment l'hormone de libération de la somatotropine synthétique (constituée de 29, 40 et 44 résidus d'acides aminés), similaire au polypeptide pancréatique, ont montré que la plupart de ces patients présentent une pathologie hypothalamique, l'insuffisance de l'hypophyse antérieure étant secondaire. Une pathologie primaire de l'hypophyse elle-même est plus rare.
Le nanisme génétique avec déficit isolé en hormone de croissance, associé à une altération de l'activité biologique et de la sensibilité à cette hormone, est observé sporadiquement en Russie et dans les pays voisins. Il est plus fréquent sur le continent américain, dans les pays du Proche et du Moyen-Orient, ainsi qu'en Afrique. D'après les résultats d'une étude portant sur la concentration sanguine en hormone somatotrope et la sensibilité des patients à l'hormone somatotrope exogène, le taux d'insuline immunoréactive (IRI), les facteurs de croissance analogues à l'insuline (IGF) de type I (somatomédine C) et de type II, ainsi que la réponse de l'IGF-1 au traitement par des préparations d'hormones somatotropes, diverses variantes de nanisme cliniquement similaires ont été identifiées.
Récemment, la pathogénèse du nanisme de Laron, causé par une déficience d'IRF-1 et d'IRF-II, a été déchiffrée, ainsi que la pathogénèse du nanisme chez les pygmées africains, associé à une déficience du premier.
En 1984, une nouvelle variante de nanisme pseudo-hypophysaire avec un taux élevé d'hormone somatotrope et d'IGF-1 a été décrite; la genèse du nanisme s'explique par un défaut de ses récepteurs, ce qui est prouvé par une forte diminution de la liaison des fibroblastes cutanés à l'IGF-1.
Il convient de souligner que dans les conditions modernes, avec la présence de petites familles, de nombreux cas isolés (« idiopathiques », sporadiques) de la maladie peuvent également être génétiques.
L'analyse de 350 dossiers médicaux a révélé que l'étiologie du nanisme était incertaine chez 228 patients (65,2 %). Ce groupe comprenait des patients issus de 57 familles présentant une incidence répétée de nanisme (2 à 4 cas par famille), soit 28 % de l'ensemble des patients. Chez 77 % des familles présentant des formes de nanisme d'étiologie incertaine (principalement génétique), un lien indéniable avec l'hérédité de l'absence du facteur Rhésus a été établi. La distribution du facteur Rhésus dans les familles de patients atteints de nanisme diffère de celle observée en cas de conflit Rhésus entre la mère et le fœtus et, en règle générale, ne s'accompagne pas d'une maladie hémolytique du nouveau-né (le père peut être Rhésus négatif, et en cas d'hétérozygotie des parents pour le facteur Rhésus, les enfants, etc.). On peut supposer un lien entre l'activité des gènes responsables de la synthèse de l'hormone somatotrope (ou hormone de libération de la somatotropine) et les gènes déterminant le facteur Rh, d'autant plus que la plupart des formes de nanisme et l'absence de facteur Rh sont des caractères autosomiques récessifs. Cela n'explique pas la relative rareté du nanisme par rapport à la fréquence des individus Rh négatifs dans la population. D'autres facteurs encore inconnus jouent probablement un rôle important, mais il est peu probable que les caractéristiques de la distribution du facteur Rh dans les familles de patients atteints de nanisme familial et sporadique soient accidentelles.
Un grand nombre de patients atteints de nanisme (cérébral primitif, cérébro-hypophysaire) présentent divers types de pathologies organiques du système nerveux central apparues in utero ou dans la petite enfance. Le substrat anatomique à l'origine de cette pathologie peut être un sous-développement ou une absence de l'hypophyse, sa dystopie dans la pathologie de la formation de la selle turcique, une dégénérescence kystique de l'hypophyse, son atrophie due à la compression tumorale (craniopharyngiome, adénome chromophobe, méningiome, gliome). Le nanisme peut être causé par des lésions traumatiques de la région hypothalamo-hypophysaire (intra-utérines, à la naissance ou postnatales), qui surviennent souvent lors de grossesses multiples, ainsi que lors d'accouchements par le siège, en présentation du pied ou en position transversale avec rotation sur la jambe (ce mécanisme d'accouchement est observé chez plus d'un tiers des patientes atteintes de nanisme). Les dommages infectieux et toxiques sont importants (infections virales intra-utérines, tuberculose, syphilis, paludisme, toxoplasmose; maladies à un âge précoce, septicémie néonatale, méningo- et arachno-encéphalite, etc.). Ces processus peuvent endommager l'hypophyse elle-même, les centres hypothalamiques qui régulent sa fonction, et perturber les connexions fonctionnelles normales du système nerveux central.
Les lésions fœtales intra-utérines peuvent conduire à la naissance de patients atteints de « nanisme de naissance » avec sécrétion normale d'hormone de croissance (nanisme cérébral primordial, microcéphalie, nanisme de Silver-Russell avec hémi-asymétrie corporelle et taux élevés de gonadotrophines, etc.).
Des facteurs supplémentaires qui aggravent la violation du développement physique dans le nanisme peuvent être une nutrition inadéquate, déséquilibrée en termes d'ingrédients essentiels (carence en protéines) et de microéléments (carence en zinc), et des conditions environnementales défavorables, ainsi que diverses maladies chroniques, telles que la glomérulonéphrite, dans laquelle l'azotémie affecte l'activité des récepteurs hépatiques ou affecte directement le métabolisme des cellules hépatiques, provoquant une diminution de la synthèse de la somatomédine, ou une cirrhose du foie, lorsque la formation de somatomédine est altérée.
Pathogénèse
Chez la plupart des patients atteints de nanisme hypophysaire, les changements ne se limitent pas à la pathologie de la sécrétion de l'hormone somatotrope et à la sensibilité à celle-ci, mais s'étendent à d'autres hormones tropiques de l'hypophyse, ce qui provoque diverses combinaisons de troubles endocriniens et métaboliques.
En cas de déficit isolé en hormone somatotrope, les modifications morphologiques de l'hypophyse ont été peu étudiées. Dans les cas étudiés, des troubles pathologiques ont rarement été observés (craniopharyngiome ou hyperostose des os crâniens). Dans ce type de nanisme, on peut observer un sous-développement congénital des cellules peptidergiques ou une anomalie du système de neurotransmission de l'hypothalamus. Dans de tels cas, le nanisme peut être associé à une dysplasie ou une hypoplasie des nerfs optiques. Les kystes intrasellaires et les tumeurs hypophysaires et hypothalamiques entraînent un déficit en STH, provoquant une compression du tissu hypophysaire, en particulier des cellules somatotropes.
Le nanisme se caractérise par un amincissement des os, principalement dû à la couche corticale, et par un retard de différenciation et d'ossification du squelette. Les organes internes sont hypoplasiques, parfois atrophiés, et les muscles sont peu développés.
Symptômes nanisme
Un retard important de croissance et de développement physique est la principale manifestation du nanisme hypophysaire. Les patients naissent avec un poids et une taille normaux et commencent à présenter un retard de croissance entre 2 et 4 ans.
Avant l'avènement du traitement actif du nanisme, on considérait comme naines les personnes mesurant moins de 120 cm pour les femmes et 130 cm pour les hommes. Aujourd'hui, la taille d'une naine diffère d'au moins 2 à 3 sigmas de la norme tabulaire moyenne pour un sexe, un âge ou une population donnés. Il existe également une méthode d'évaluation graphique de la taille basée sur la courbe de distribution gaussienne. Dans ce cas, les naines par taille sont incluses dans un groupe comprenant le nombre minimal d'individus de la population correspondante présentant le plus grand décalage par rapport à la norme de croissance moyenne.
Le nanisme hypophysaire se caractérise non seulement par une petite taille absolue, mais aussi par une croissance annuelle et un développement physique faibles. La corpulence est proportionnelle, mais les proportions corporelles des patients sont typiques de l'enfance. La peau est pâle, souvent jaunâtre, sèche, ce qui est dû à une insuffisance thyroïdienne absolue ou relative; on observe parfois une cyanose (marbrure). Chez les patients non traités, une peau vieillissante et ridée (gérodermie) apparaît précocement. Cela est dû à l'insuffisance de l'action anabolique des STH et à la lenteur du changement des générations cellulaires.
Les cheveux peuvent être normaux ou secs, fins et cassants; les cils longs sont typiques. La repousse capillaire est souvent absente. Chez la plupart des patients atteints de nanisme (70 à 75 %), la taille de la selle turcique reste inchangée, mais elle conserve souvent sa forme infantile d'« ovale dressé », présente un dos large et juvénile, et le sinus sphénoïde présente un retard de pneumatisation. Cependant, certains patients présentent une selle turcique élargie, signe d'une tumeur; elle présente des zones de calcification sur son fond ou à son entrée (craniopharyngiome, séquelles d'une neuroinfection) ou une diminution de sa taille (signes de sous-développement, hypophyse de petite taille). Des symptômes d'hypertension intracrânienne sont observés: amincissement des os de la voûte crânienne, augmentation de la vascularisation, présence d'empreintes digitales, etc. Le signe le plus important du nanisme hypophysaire est un retard de différenciation et d'ossification du squelette. Les caractéristiques du système dentaire sont également étroitement liées à la différenciation squelettique: on observe un remplacement tardif des dents de lait. Le retard le plus important dans le développement du système squelettique est observé chez les patients atteints de nanisme, d'insuffisance sexuelle et d'hypothyroïdie.
Les organes génitaux de la plupart des patients sont sévèrement sous-développés, bien que les malformations soient rares. Une cryptorchidie a été observée chez 5,8 % des patients de sexe masculin. L'insuffisance sexuelle s'accompagne d'un sous-développement des caractères sexuels secondaires, d'une diminution du désir sexuel et d'une absence de règles. Un développement sexuel spontané normal n'est observé que chez les patients présentant un déficit isolé en hormone de croissance et chez certains patients atteints de nanisme cérébral.
L'insuffisance thyroïdienne est un symptôme assez fréquent du nanisme. Il convient de noter que les manifestations externes de l'hypothyroïdie ne reflètent pas toujours le véritable état fonctionnel de la glande thyroïde. Cela est dû à une hypothyroïdie relative due à une altération de la transition de la thyroxine (T4 ) à la triiodothyronine (T3 ) et à la formation deT3 inactive (réversible), caractéristique de l'insuffisance somatotrope.
La fonction adrénocorticotrope dans le nanisme hypophysaire diminue moins fréquemment et dans une moindre mesure que les fonctions sexuelles et thyroïdiennes stimulantes et, chez la plupart des patients, ne nécessite pas de correction particulière.
Dans la plupart des cas, l'intellect n'est pas altéré. On observe des changements émotionnels prenant la forme d'un infantilisme mental; chez les patients plus âgés sans déficience intellectuelle, on observe parfois des névroses réactionnelles.
En pathologie cérébrale organique, notamment de nature tumorale, le nanisme peut survenir avec des symptômes de diabète insipide, d'hémianopsie bitemporale et de déficience intellectuelle.
L'étude du développement de l'activité bioélectrique cérébrale chez des patients ne présentant pas de symptômes organiques du système nerveux central a montré que leur EEG se caractérise par des signes d'immaturité, la préservation à long terme d'une tension EEG « enfantine » élevée; une irrégularité du rythme alpha en amplitude et en fréquence; une forte augmentation du contenu des rythmes θ et δ lents, notamment dans les dérivations frontales et centrales; une réaction nette à l'hyperventilation; un déplacement de la gamme des rythmes EEG suivant les rythmes de stimulation lumineuse vers les basses fréquences (preuve d'une diminution de la mobilité fonctionnelle des structures nerveuses du cerveau). Il a été révélé que chez les patients âgés, l'immaturité de l'activité électrique cérébrale est due au sous-développement sexuel, et chez les patients de tous âges, à l'hypothyroïdie.
Le métabolisme glucidique chez les patients atteints de nanisme se caractérise par une tendance à la baisse de la glycémie à jeun, une augmentation de celle-ci lors d'un effort physique, une insuffisance d'insuline endogène et une sensibilité accrue à l'insuline exogène, avec apparition fréquente d'hypoglycémies. Ces dernières s'expliquent principalement par un taux insuffisant d'hormones contre-insulaires dans l'organisme des patients.
Les organes internes présentent une splanchnomycrie, c'est-à-dire une diminution de leur taille. Aucune modification fonctionnelle des organes internes spécifique au nanisme n'a été décrite. Une hypotension artérielle avec diminution des pressions systolique et diastolique et diminution de l'amplitude du pouls est souvent observée. Les bruits cardiaques sont étouffés, des souffles fonctionnels de divers types sont audibles en raison de modifications trophiques du myocarde et de troubles autonomes. L'ECG est caractérisé par une basse tension (surtout en présence d'hypothyroïdie), une bradycardie sinusale ou une bradyarythmie; l'ECG montre une diminution de l'amplitude des sons, des sons supplémentaires et des souffles fonctionnels. Les données d'oxymétrie indiquent une hypoxémie (initiale et à l'effort) et une dette en oxygène. Les patients âgés développent parfois une hypertension.
Diagnostics nanisme
Le diagnostic et le diagnostic différentiel du nanisme reposent sur l'anamnèse et un examen clinique, radiologique, biologique et hormonal complet. Outre la taille absolue, pour évaluer la croissance des patients, on détermine le déficit de croissance (écart entre la taille du patient et sa norme moyenne pour le sexe et l'âge correspondants); l'âge de croissance (conformité de la taille du patient à certaines normes); et l'indicateur d'écart normalisé.
I = M - Mcp / δ, où M est la taille du patient, Mcp est la taille normale moyenne pour un sexe et un âge donnés, δ est l'écart carré par rapport à Mcp; un I inférieur à 3 est typique du nanisme, et un I supérieur à 3 est typique du gigantisme. Cet indicateur permet d'évaluer la dynamique du développement.
L'examen radiographique des patients atteints de nanisme révèle des signes d'hypertension intracrânienne, des séquelles de neuroinfection, des calcifications et une craniosténose. L'étude de la taille, de la forme et de la structure de la selle turcique est considérée comme un indicateur indirect caractérisant la taille de l'hypophyse. L'une des manifestations les plus importantes d'un retard de croissance pathologique est un trouble de la différenciation squelettique. Pour évaluer le degré de maturité squelettique, on détermine l'âge osseux (radiographique), qui correspond à la différenciation du tissu osseux; le déficit d'ossification correspond au retard d'ossification par rapport à la norme (en années); le coefficient d'ossification correspond au quotient de l'âge osseux par des paramètres chronologiques et autres.
Le diagnostic moderne du nanisme est impossible sans l'étude de la sécrétion d'hormone somatotrope, de son taux basal, de son rythme circadien et de sa libération sous stimulation. La plupart des patients atteints de nanisme hypophysaire se caractérisent par une faible concentration sérique d'hormone somatotrope. Déterminée par radio-immunologie, cette concentration est (selon différents auteurs) comprise entre (0,87 ± 0,09) et (1,50 ± 0,64) ng/ml, avec une norme moyenne de (3,81 ± 0,29) ng/ml. Une étude des rythmes quotidiens (circadiens) de sécrétion d'hormone somatotrope a montré que son niveau chez les personnes en bonne santé est maximal pendant les deux premières heures de sommeil et entre 4 et 6 heures du matin. Dans le nanisme, la concentration d'hormone somatotrope est également réduite pendant ces heures.
Pour étudier les réserves de la fonction somatotrope, divers stimulants sont utilisés, en examinant la teneur en hormone somatotrope avant et après leur administration. Un prélèvement sanguin est effectué toutes les 30 minutes pendant 2 à 3 heures. La libération d'hormone somatotrope après stimulation est considérée comme normale jusqu'à 7 à 10 ng/ml, atteignant parfois 20 à 40 ng/ml. En l'absence de réaction dans l'un des échantillons, des tests répétés sont effectués avec d'autres stimulants. Une insuffisance en hormone somatotrope est considérée comme avérée en l'absence de libération d'hormone somatotrope dans 2 ou 3 échantillons différents.
Les tests de stimulation les plus couramment utilisés sont les suivants: après administration intraveineuse de 0,1 U (0,75-1,5 U) d'insuline par kg de poids corporel et dès l'obtention d'une hypoglycémie (diminution de la glycémie de 50 % par rapport à la valeur initiale), le taux sérique d'hormone somatotrope est dosé selon le schéma ci-dessus. En cas d'hypoglycémie sévère, le test est interrompu et du glucose est administré par voie intraveineuse. Il s'agit de la méthode diagnostique classique la plus courante.
TRH à une dose de 200 à 500 µg par voie intraveineuse. Identifie efficacement les réserves hormonales et n'entraîne pas de complications. Associé au dosage de l'insuline, il permet d'évaluer l'étendue des lésions du système hypothalamo-hypophysaire. Une réaction positive à la TRH en l'absence d'hypoglycémie à l'insuline indique l'intégrité de l'hypophyse et une atteinte hypothalamique. Une réaction négative à la TRH et à l'hypoglycémie indique une atteinte de l'hypophyse elle-même.
La TRH, LH-RH à la dose de 300 mcg par voie intraveineuse est similaire à la précédente.
La SGH humaine est un analogue synthétique d'un composé biologiquement actif isolé d'une tumeur pancréatique. Il existe actuellement trois types de SGH synthétique: avec 29, 40 et 44 résidus d'acides aminés. Elle est administrée par voie intraveineuse à des doses de 1 à 3 µg/kg de poids corporel du patient. La libération de SGH est observée 15 à 20 minutes après l'administration; ce test est plus efficace que les autres pour révéler les réserves d'hormone de croissance endogène. Une réaction positive à la SGH indique une atteinte hypothalamique de la fonction somatotrope et une hypophyse intacte; avec des acides aminés (monochlorure de L-arginine, ornithine, tryptophane, glycine, leucine) par voie intraveineuse à une dose de 0,25 à 0,5 g pour 1 kg de poids corporel du patient. Efficace pour étudier les réserves de SGH. Peut provoquer des réactions allergiques.
L-dopa par voie orale à une dose de 250 à 500 µg. Efficace et bien toléré par les patients.
Des tests avec du glucagon, de la bromoergocryptine (parlodel), de la lysine vasopressine, de la clonidine et une charge ergométrique dosée sur vélo sont également utilisés.
L'étude de l'état de la fonction somatotrope est nécessaire non seulement pour le diagnostic du nanisme, mais aussi pour le choix justifié d'une méthode de thérapie, car le traitement par la somatotropine n'est rationnel qu'en cas d'insuffisance d'hormone de croissance endogène.
Pour diagnostiquer le nanisme, il est essentiel d'étudier la teneur en facteurs de croissance analogues à l'insuline, ou somatomédines (notamment l'IGF-1 ou la somatomédine C), médiateurs de l'action de l'hormone somatotrope au niveau tissulaire. On sait que la teneur en somatomédine C est réduite chez les patients atteints de nanisme et augmentée chez les patients atteints d'acromégalie. La forme de nanisme décrite par Laron est une maladie caractérisée par une production normale de STH, mais par une altération de la formation d'IGF-1 et d'IGF-II. Le traitement de ces patients par la somatotropine est inefficace.
Les indicateurs indirects de la fonction somatotrope de l'hypophyse sont l'activité de la phosphatase alcaline et la teneur en phosphore inorganique dans le sérum. En cas d'hyposomatotropie, ces indicateurs sont réduits. Dans la forme panhypopituitaire du nanisme, la sécrétion de gonadotrophines, souvent de TSH, est réduite, ce qui s'accompagne d'une diminution correspondante des fonctions des glandes sexuelles (carence en androgènes ou en œstrogènes), de la thyroïde (diminution des taux de T3 , T4 , d'iode lié aux protéines (PBI), accumulation d' iode 131 par la thyroïde) et des glandes surrénales (diminution des taux plasmatiques de cortisol et de 17-OCS, excrétion urinaire de 17-KC et de 17-OCS, lymphocytose).
Tous les types de nanisme hypophysaire (hypothalamo-hypophysaire) génétique se caractérisent par une maladie récurrente chez les enfants d'une même famille, transmise selon un mode autosomique récessif (le plus souvent) ou autosomique dominant. Ils présentent un retard de croissance et de développement physique de 2 à 4 ans, avec un décalage d'au moins 2 à 3 % par rapport aux normes de croissance moyennes pour un sexe, un âge et une population donnés. Ils se caractérisent par une faible dynamique de croissance annuelle spontanée et un retard d'ossification. En cas de faible taux d'hormone somatotrope (inférieur à 7 ng/ml lors de 2 à 3 tests de stimulation), le traitement par hormone somatotrope est très efficace (permettant une augmentation de la taille d'au moins 7 cm par an). En cas de taux d'hormone somatotrope normal ou élevé (avec son inactivité biologique), la sensibilité à cette hormone peut être préservée. Aucune altération de l'intelligence n'est observée.
Dans le nanisme génétique avec insensibilité tissulaire à l'hormone de croissance (HGH), le tableau clinique est similaire à celui d'un déficit isolé en HGH, mais le traitement par somatotropine est inefficace. Dans ce groupe, on distingue les principales formes suivantes selon le taux d'IRF: à teneur normale (défaut du récepteur de l'IRF) et à teneur réduite: le nanisme de type Laron (déficit en IRF-1 et IRF-II) et celui observé chez les pygmées africains (déficit en IRF-1).
Le nanisme cérébral se caractérise par des maladies isolées dans une famille associées à des lésions intra-utérines ou postnatales du système nerveux central, avec la présence de modifications organiques évidentes du système nerveux central, souvent associées à une pathologie de l'organe visuel, la présence de diabète insipide, la préservation des fonctions gonadotropes et des modifications de l'intelligence.
Certains types de dysgénésie et d'agénésie gonadiques s'accompagnent d'une petite taille marquée, notamment le syndrome de Shereshevsky-Turner et la forme « turnéroïde » (mosaïque) du syndrome de dysgénésie testiculaire. Les études cytogénétiques (chromatine sexuelle, caryotype) aident au diagnostic différentiel, révélant des anomalies chromosomiques, ainsi que des anomalies caractéristiques du développement somatique et sexuel, des taux normaux ou élevés d'hormone somatotrope endogène et une insensibilité au traitement par somatotropine.
Parmi les troubles endocriniens survenant en cas de petite taille, il convient d'identifier l'hypothyroïdie primaire, causée par une hypoplasie ou une aplasie congénitale de la thyroïde, sa dystopie, des anomalies enzymatiques de la biosynthèse des hormones thyroïdiennes ou une atteinte auto-immune précoce de la thyroïde. Dans toutes ces affections, les signes d'hypothyroïdie sont dominés par un taux élevé de TSH et une diminution des taux sériques de T4 et T3. Dans le myxœdème d'origine auto-immune, des anticorps anti-thyroglobuline, des fractions microsomales et nucléaires du tissu thyroïdien sont détectés dans le sang, et le taux d'hormone somatotrope est normal ou abaissé. L'effet clinique peut être obtenu en compensant uniquement l'hypothyroïdie.
La petite taille s'accompagne d'un développement sexuel prématuré et d'un syndrome adrénogénital en raison de la fermeture précoce des zones de croissance; la maladie d'Itsenko-Cushing, qui survient dans l'enfance en raison de l'effet inhibiteur des glucocorticoïdes sur la sécrétion de l'hormone somatotrope et de leur effet catabolique; le syndrome de Mauriac - petite taille et infantilisme des patients atteints de diabète sucré insulino-dépendant sévère.
Le nanisme hypophysaire doit être différencié du retard somatogène du développement physique causé par des troubles métaboliques chroniques (dans les maladies du foie, des reins, du tractus gastro-intestinal), une hypoxie chronique (dans les maladies des systèmes cardiovasculaire et respiratoire, dans l'anémie); avec des maladies systémiques du système musculo-squelettique (chondrodystrophie, ostéogenèse imparfaite, maladie d'exostose), etc.
Un retard de croissance fonctionnel (constitutionnel) est parfois observé lors d'une puberté tardive chez des adolescents apparemment en bonne santé; nous avons constaté qu'il est principalement associé à une insuffisance transitoire de l'activité gonadotrope. La sécrétion d'hormone somatotrope n'est généralement pas altérée ou est légèrement réduite. La stimulation des gonadotrophines peut accélérer le développement sexuel et la croissance.
La petite taille d'origine familiale doit être considérée comme une variante du développement physiologique.
Qu'est-ce qu'il faut examiner?
Comment examiner?
Quels tests sont nécessaires?
Qui contacter?
Traitement nanisme
Le traitement du nanisme est un processus long. Cela oblige le médecin à répartir les moyens d'influencer la croissance dans le temps afin d'obtenir le meilleur effet clinique, tout en respectant deux principes fondamentaux:
- approximation maximale du développement induit par le traitement par rapport aux conditions physiologiques;
- épargnant les zones de croissance épiphysaires.
De nombreuses années d'expérience dans le traitement du nanisme nous permettent de considérer le schéma thérapeutique par étapes suivant comme approprié. Le diagnostic de nanisme chez l'adulte ne soulève généralement aucun doute. Chez le jeune enfant, si le tableau clinique est incertain, une période diagnostique est nécessaire: 6 à 12 mois sous observation sans hormonothérapie. Durant cette période, un traitement général de renforcement est prescrit; une alimentation adaptée avec une augmentation des apports en protéines animales, légumes et fruits, vitamines A et D, calcium et phosphore est prescrit. L'absence de modifications significatives de la croissance et du développement physique dans ce contexte et la détection de troubles endocriniens lors de l'examen clinique justifient la mise en place d'un traitement hormonal.
Le principal traitement pathogénique du nanisme hypophysaire est l' hormone de croissance humaine, car la survenue de la plupart des cas de nanisme dépend sans aucun doute de l'une ou l'autre de ses formes de déficit. En raison de la spécificité d'espèce de cette hormone, seule la somatotropine humaine et celle des primates sont actives chez l'homme. Un médicament isolé de l'hypophyse de personnes décédées de maladies non infectieuses et non néoplasiques est largement utilisé en clinique. La somatotropine humaine est obtenue par synthèse bactérienne à partir d'Escherichia coli par génie génétique. La somatotropine humaine est également synthétisée chimiquement, mais elle est extrêmement coûteuse et pratiquement inutilisée en clinique. Les patients présentant un déficit avéré en hormone de croissance endogène, dont la différenciation squelettique ne dépasse pas le niveau typique de 13-14 ans, sont sélectionnés pour un traitement par somatotropine. Il n'y a pas de limite d'âge pour le traitement.
Les doses minimales efficaces utilisables lors de la première période de traitement sont de 0,03 à 0,06 mg/kg de poids corporel. Les doses les plus efficaces sont de 2 à 4 mg, 3 fois par semaine. L'augmentation de la dose unique à 10 mg n'a pas entraîné d'augmentation satisfaisante de la croissance, mais a entraîné la formation rapide d'anticorps anti-somatotropine.
Dans notre pays, des études sur l'hormone de croissance humaine sont menées depuis 1960. Deux schémas thérapeutiques ont été testés: continu et intermittent, avec des cures de 2 à 3 mois à intervalles réguliers. La croissance moyenne des patients au cours de la première année de traitement était de 9,52 ± 0,39 cm et la prise de poids de 4,4 ± 0,14 kg. Avec un traitement continu à long terme, la croissance moyenne était de 0,82 cm/mois et la prise de poids de 0,38 kg/mois; avec un traitement intermittent, de 0,75 cm/mois et de 0,4 kg/mois respectivement. Le traitement continu a permis une croissance plus rapide de la taille, avec une forte diminution de l'effet après 1 à 1,5 an; avec un traitement intermittent, l'efficacité s'est maintenue pendant 3 à 4 ans, ce qui nous permet de considérer le schéma thérapeutique le plus approprié. La détermination du taux d'IGF-I (somatomédine C) peut servir d'indicateur fiable de la sensibilité du patient au traitement par somatotropines. L'augmentation du taux d'IGF-I après l'introduction de l'hormone somatotrope permet de prédire un effet positif du traitement. Un avantage important du traitement par somatotropine est l'absence d'accélération de l'ossification squelettique dans ce contexte.
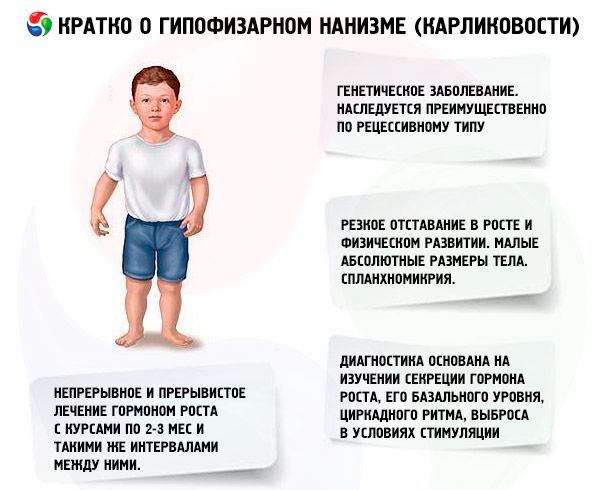
Le traitement le plus efficace contre le nanisme est l'utilisation de stéroïdes anabolisants. Ces médicaments stimulent la croissance en améliorant la synthèse protéique et en augmentant le taux d'hormone somatotrope endogène. Le traitement s'étend sur plusieurs années, avec un remplacement progressif de certains médicaments par d'autres, des composés moins actifs vers des composés plus actifs. Un changement d'anabolisant est indiqué lorsque l'effet sur la croissance diminue après 2 à 3 ans, entraînant une augmentation supplémentaire de la croissance. Le traitement se déroule par cures (la période de repos doit être la moitié de la durée du traitement). En cas d'addiction, des pauses plus longues sont également indiquées (jusqu'à 4 à 6 mois). Un seul stéroïde anabolisant est prescrit à la fois. L'association de deux médicaments ou plus est inappropriée, car elle n'améliore pas leurs effets sur le métabolisme et la croissance. Ce dernier dépend principalement de l'âge du patient et du degré de différenciation osseuse au début du traitement. L'effet le plus efficace est observé chez les patients de moins de 16 à 18 ans dont l'ossification squelettique ne dépasse pas le niveau caractéristique d'un adolescent de 14 ans. Il est conseillé de commencer le traitement immédiatement après le diagnostic, généralement entre 5 et 7 ans. Avant le traitement, il est nécessaire d'éviter la prescription de gonadotrophines et d'hormones sexuelles, qui, tout en stimulant la croissance, accélèrent simultanément la différenciation squelettique. Le principe de dosage des stéroïdes anabolisants est d'augmenter progressivement la dose minimale efficace. Les doses recommandées des médicaments les plus courants sont: le nérobol (méthandrosténol, dianabol): 0,1 à 0,15 mg par kg de poids corporel par jour par voie orale; le nérobolil (durabolin): 1 mg par kg de poids corporel par mois par voie intramusculaire, la dose mensuelle étant administrée en 2 à 3 prises, respectivement après 15 ou 10 jours; Retabolil (déca-durabolin): 1 mg par kg de poids corporel une fois par mois par voie intramusculaire. Le dépassement des doses indiquées peut entraîner une androgénisation. À doses physiologiques, ces composés n’ont pas d’effet significatif sur l’état des organes génitaux ni sur la différenciation osseuse, ce qui permet leur utilisation à long terme chez les patients des deux sexes. Les filles doivent être suivies par un gynécologue, car en cas de surdosage ou d’hypersensibilité individuelle, certaines patientes peuvent développer des signes de virilisation, qui régressent rapidement à l’arrêt du traitement. Les médicaments oraux méthylés en éthylés en 17e position peuvent parfois provoquer un effet cholestatique. Par conséquent, en cas d’affection hépatique, il convient de privilégier les composés anabolisants parentéraux ou d’associer les médicaments oraux à des agents cholérétiques. Très rarement, le traitement par stéroïdes anabolisants peut provoquer des réactions allergiques (démangeaisons, éruptions cutanées). En l'absence de complications, les stéroïdes anabolisants sont utilisés tant que l'effet de croissance est observé (jusqu'à 16-18 ans, et parfois plus). Le traitement s'inscrit dans le cadre d'une thérapie de renforcement général.
Si les patients présentent des signes d'hypothyroïdie, des médicaments pour la thyroïde (thyroxine, thyroïdine, thyrotom) sont prescrits simultanément à des doses sélectionnées individuellement.
Chez les garçons, l'étape suivante est l'administration de gonadotrophine chorionique humaine. Ce médicament est utilisé au plus tôt vers 15-16 ans, et souvent même plus tard, pour stimuler les cellules de Leydig, ce qui accélère le développement sexuel et la croissance (grâce à l'activité anabolique de leurs propres androgènes). Des doses de 1 000 à 1 500 UI sont administrées 1 à 2 fois par semaine par voie intramusculaire, en cures de 2 mois, à raison de 2 à 3 fois par an maximum. Si l'effet est incomplet, le traitement par gonadotrophine chorionique humaine chez les garçons de 16 ans et plus est alterné avec l'administration de faibles doses d'androgènes (méthyltestostérone à raison de 5 à 10 mg/jour par voie sublinguale).
Les filles de plus de 16 ans peuvent commencer un traitement par de faibles doses d'œstrogènes, simulant un cycle sexuel normal. Le traitement est effectué pendant 3 semaines par mois, suivies d'une pause. Au cours de la deuxième phase du cycle, à partir de la 3e semaine, de la gonadotrophine chorionique peut être prescrite à une dose de 1 000 à 1 500 UI, 3 à 5 fois par semaine, ou des médicaments à effet gestagène (prégnine, progestérone).
La dernière étape du traitement (après la fermeture des zones de croissance) consiste en l'administration continue d'hormones sexuelles à des doses thérapeutiques adaptées au sexe du patient, afin de développer pleinement les organes génitaux et les caractères sexuels secondaires, et d'assurer la libido et la puissance sexuelle. Les préparations combinées œstroprogestatives (Néovulin, Bisecurine, Infekundin, Rigevidon) conviennent aux femmes, et les préparations androgéniques à libération prolongée (Testenate, Sustanon-250, Omnadren-250) aux hommes.
Un traitement de renforcement général est mis en œuvre (régime, régime protéino-végétarien, vitaminothérapie, biostimulants). L'utilisation de préparations à base de zinc est indiquée, dont le mécanisme d'action est principalement basé sur l'augmentation de l'activité de l'IGF-1 (facteur de croissance insulinomimétique I).
En présence d'une pathologie organique du système nerveux central, un traitement anti-inflammatoire, résorbant et déshydratant est administré. Un traitement systématique ciblé donne un effet encourageant. Grâce à un traitement progressif à long terme, 148 (80,4 %) des 175 patients atteints de nanisme des deux sexes ont atteint une taille supérieure à 130 cm, 92 (52,5 %) à plus de 140 cm et 32 (18,3 %) à 150-160 cm ou plus. Parallèlement, 37 patients (21,2 %) ont augmenté leur taille de 30 cm, 107 (61,1 %) à 31-50 cm et 31 (17,7 %) à 51-60 cm ou plus.
Prévoir
Le pronostic dépend de la forme du nanisme. Dans les formes génétiques de nanisme, le pronostic vital est favorable. En présence d'une tumeur hypophysaire et d'une atteinte organique du système nerveux central, le pronostic est déterminé par la dynamique de développement du processus pathologique principal. Les méthodes thérapeutiques modernes ont considérablement amélioré les capacités physiques et professionnelles des patients, et prolongé leur espérance de vie. Pendant la période de traitement actif, les patients doivent être examinés par un médecin tous les 2 à 3 mois, et un traitement d'entretien tous les 6 à 12 mois.
L’emploi des patients qui correspond à leurs capacités intellectuelles et physiques est d’une importance primordiale pour leur adaptation sociale.
Il est conseillé de choisir des professions qui ne sont pas associées à un effort physique important, mais qui permettent de démontrer des capacités intellectuelles, la capacité à effectuer un travail précis et des langues.


 [
[