Expert médical de l'article
Nouvelles publications
Sténose mitrale
Dernière revue: 04.07.2025

Tout le contenu iLive fait l'objet d'un examen médical ou d'une vérification des faits pour assurer autant que possible l'exactitude factuelle.
Nous appliquons des directives strictes en matière d’approvisionnement et ne proposons que des liens vers des sites de médias réputés, des instituts de recherche universitaires et, dans la mesure du possible, des études évaluées par des pairs sur le plan médical. Notez que les nombres entre parenthèses ([1], [2], etc.) sont des liens cliquables vers ces études.
Si vous estimez qu'un contenu quelconque de notre contenu est inexact, obsolète ou discutable, veuillez le sélectionner et appuyer sur Ctrl + Entrée.
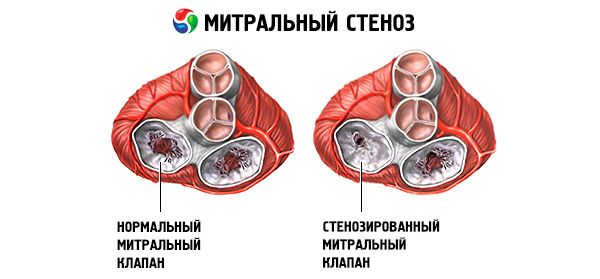
La sténose mitrale est un rétrécissement de l'orifice mitral qui empêche le flux sanguin de l'oreillette gauche vers le ventricule gauche. La cause la plus fréquente est le rhumatisme articulaire aigu. Les symptômes sont identiques à ceux de l'insuffisance cardiaque. Le ton d'ouverture et le souffle diastolique sont déterminés objectivement. Le diagnostic repose sur un examen physique et une échocardiographie. Le pronostic est favorable. Le traitement médicamenteux de la sténose mitrale comprend des diurétiques, des bêtabloquants ou des inhibiteurs calciques hypofréquencemétriques, et des anticoagulants. Le traitement chirurgical des cas plus sévères de sténose mitrale consiste en une valvulotomie par ballonnet, une commissurotomie ou un remplacement valvulaire.
Épidémiologie
La sténose mitrale est presque toujours une conséquence d'un rhumatisme articulaire aigu. Son incidence varie considérablement: dans les pays développés, on observe 1 à 2 cas pour 100 000 habitants, tandis que dans les pays en développement (par exemple, en Inde), les anomalies rhumatismales de la valve mitrale sont observées dans 100 à 150 cas pour 100 000 habitants.
Causes sténose mitrale
La sténose mitrale est presque toujours une conséquence d'un rhumatisme articulaire aigu (RAA). Une sténose mitrale isolée, dite « pure », survient dans 40 % des cas chez les patients atteints de cardiopathie rhumatismale; dans d'autres cas, elle est associée à une insuffisance et à des lésions d'autres valvules. Les causes rares de sténose mitrale comprennent les maladies rhumatismales (polyarthrite rhumatoïde, lupus érythémateux disséminé) et la calcification de l'anneau mitral.
Pathogénèse
Dans la sténose mitrale rhumatismale, on observe une compaction, une fibrose et une calcification des cuspides valvulaires, ainsi qu'une fusion le long des commissures, avec atteinte fréquente des cordes. Normalement, la surface de l'orifice mitral est de 4 à 6 cm² et la pression dans l'oreillette gauche ne dépasse pas 5 mm Hg. Lorsque l'orifice auriculo-ventriculaire gauche se rétrécit à 2,5 cm² , un obstacle au flux sanguin normal de l'oreillette gauche vers le ventricule gauche se forme et le gradient de pression valvulaire commence à augmenter. Par conséquent, la pression dans l'oreillette gauche augmente jusqu'à 20-25 mm Hg. Le gradient de pression qui en résulte entre l'oreillette gauche et le ventricule gauche favorise la circulation sanguine à travers l'orifice rétréci.
À mesure que la sténose progresse, le gradient de pression transmitral augmente, ce qui contribue à maintenir le flux sanguin diastolique à travers la valvule. Selon la formule de Gorlin, la surface valvulaire mitrale (5MC) est déterminée par les valeurs du gradient transmitral (MG) et du débit sanguin mitral (MBF):
BMK - MK/37,7 • ∆DM
La principale conséquence hémodynamique des anomalies de la valve mitrale est la congestion de la circulation pulmonaire (CP). Une augmentation modérée de la pression dans l'oreillette gauche (maximum 25-30 mmHg) entrave le flux sanguin dans la CP. La pression dans les veines pulmonaires augmente et se transmet par les capillaires à l'artère pulmonaire, entraînant le développement d'une hypertension pulmonaire veineuse (ou passive). Une augmentation de la pression dans l'oreillette gauche supérieure à 25-30 mmHg augmente le risque de rupture des capillaires pulmonaires et de développement d'un œdème pulmonaire alvéolaire. Pour prévenir ces complications, un spasme réflexe protecteur des artérioles pulmonaires se produit. En conséquence, le flux sanguin vers les capillaires cellulaires en provenance du ventricule droit diminue, mais la pression dans l'artère pulmonaire augmente fortement (une hypertension pulmonaire artérielle, ou active, se développe).
Aux premiers stades de la maladie, la pression artérielle pulmonaire n'augmente qu'en cas de stress physique ou émotionnel, alors que le flux sanguin dans le CCI devrait augmenter. Les stades avancés de la maladie se caractérisent par des valeurs élevées de pression artérielle pulmonaire, même au repos, et une augmentation encore plus importante en cas de stress. L'existence prolongée d'une hypertension pulmonaire s'accompagne du développement de processus prolifératifs et sclérotiques dans la paroi des artérioles du CCI, qui s'obstruent progressivement. Bien que l'apparition d'une hypertension artérielle pulmonaire puisse être considérée comme un mécanisme compensatoire, la diminution du flux sanguin capillaire entraîne une forte diminution de la capacité de diffusion pulmonaire, notamment en cas de stress. Le mécanisme de progression de l'hypertension pulmonaire par hypoxémie est alors activé. L'hypoxie alvéolaire provoque une vasoconstriction pulmonaire par des mécanismes directs et indirects. L'effet direct de l'hypoxie est associé à la dépolarisation des cellules musculaires lisses vasculaires (médiée par une modification de la fonction des canaux potassiques des membranes cellulaires) et à leur contraction. Le mécanisme indirect implique l'action de médiateurs endogènes (tels que les leucotriènes, l'histamine, la sérotonine, l'angiotensine II et les catécholamines) sur la paroi vasculaire. L'hypoxémie chronique entraîne un dysfonctionnement endothélial, qui s'accompagne d'une diminution de la production de facteurs relaxants endogènes, notamment la prostacycline, la prostaglandine E2 et le monoxyde d'azote. Un dysfonctionnement endothélial à long terme entraîne l'oblitération des vaisseaux pulmonaires et des lésions endothéliales, ce qui entraîne une augmentation de la coagulation sanguine, une prolifération des cellules musculaires lisses avec tendance à la formation de thrombus in situ, et un risque accru de complications thrombotiques avec développement ultérieur d'une hypertension pulmonaire post-thrombotique chronique.
Les causes de l’hypertension pulmonaire dans les anomalies de la valve mitrale, y compris la sténose mitrale, sont:
- transmission passive de la pression de l'oreillette gauche au système veineux pulmonaire;
- spasme des artérioles pulmonaires en réponse à une augmentation de la pression dans les veines pulmonaires;
- gonflement des parois des petits vaisseaux pulmonaires;
- oblitération des vaisseaux pulmonaires avec lésion endothéliale.
Le mécanisme de progression de la sténose mitrale reste à ce jour obscur. Certains auteurs considèrent que le facteur principal est une valvulite en cours (souvent infraclinique), tandis que d'autres attribuent le rôle principal à la traumatisation des structures valvulaires par un flux sanguin turbulent avec dépôt de masses thrombotiques sur les valvules, ce qui explique le rétrécissement de l'orifice mitral.
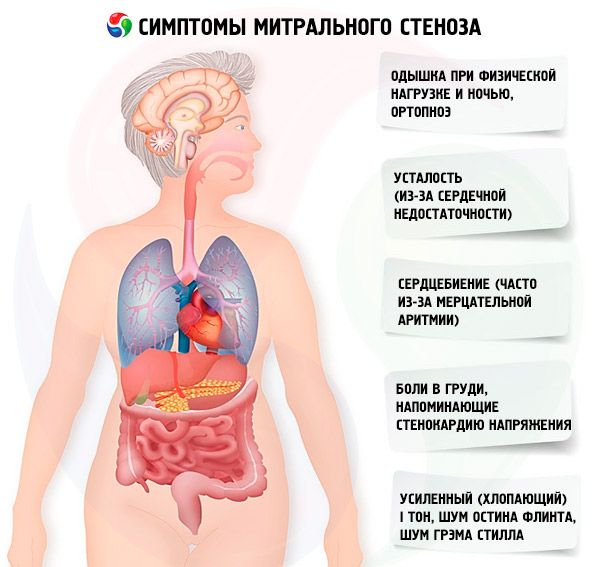
Symptômes sténose mitrale
Les symptômes de la sténose mitrale sont peu corrélés à la gravité de la maladie, car dans la plupart des cas, la pathologie évolue lentement et les patients réduisent leur activité sans s'en rendre compte. De nombreux patients ne présentent aucune manifestation clinique avant la grossesse ou l'apparition d'une fibrillation auriculaire. Les premiers symptômes sont généralement ceux d'une insuffisance cardiaque (dyspnée d'effort, orthopnée, dyspnée paroxystique nocturne, fatigue). Ils apparaissent généralement 15 à 40 ans après un épisode de rhumatisme articulaire aigu, mais dans les pays en développement, les symptômes peuvent même apparaître chez l'enfant. La fibrillation auriculaire paroxystique ou persistante aggrave la dysfonction diastolique existante, provoquant un œdème pulmonaire et une dyspnée aiguë si la fréquence ventriculaire est mal contrôlée.
La fibrillation auriculaire peut également se manifester par des palpitations; chez 15 % des patients ne recevant pas d'anticoagulants, cela provoque une embolie systémique avec ischémie des membres ou accident vasculaire cérébral.
Les symptômes moins courants comprennent l'hémoptysie due à la rupture de petits vaisseaux pulmonaires et l'œdème pulmonaire (en particulier pendant la grossesse lorsque le volume sanguin augmente); la dysphonie due à la compression du nerf laryngé récurrent gauche par une oreillette gauche ou une artère pulmonaire élargie (syndrome d'Ortner); les symptômes d'hypertension artérielle pulmonaire et d'insuffisance ventriculaire droite.
Les premiers symptômes de la sténose mitrale
Avec une surface de l'orifice mitral supérieure à 1,5 cm² , les symptômes peuvent être absents, mais une augmentation du débit sanguin transmitral ou une diminution du temps de remplissage diastolique entraînent une forte augmentation de la pression dans l'oreillette gauche et l'apparition de symptômes. Facteurs déclenchants de décompensation: effort physique, stress émotionnel, fibrillation auriculaire, grossesse.
Le premier symptôme d'une sténose mitrale (dans environ 20 % des cas) peut être une embolie, le plus souvent un accident vasculaire cérébral (AVC) avec apparition d'un déficit neurologique persistant chez 30 à 40 % des patients. Un tiers des thromboembolies se développent dans le mois suivant l'apparition de la fibrillation auriculaire, et les deux tiers dans la première année. L'embolie provient généralement de thrombus situés dans l'oreillette gauche, en particulier dans son appendice. Outre les accidents vasculaires cérébraux (AVC), des embolies spléniques, rénales et artérielles périphériques sont possibles.
En rythme sinusal, le risque d'embolie est déterminé par:
- âge;
- thrombose auriculaire gauche;
- zone de l'orifice mitral;
- insuffisance aortique concomitante.
En cas de fibrillation auriculaire permanente, le risque d'embolie augmente significativement, surtout si le patient présente des antécédents de complications similaires. Une prise de contraste spontanée de l'oreillette gauche lors d'une échocardiographie transœsophagienne est également considérée comme un facteur de risque d'embolie systémique.
Avec l'augmentation de la pression dans le CCI (en particulier au stade d'hypertension pulmonaire passive), des plaintes d'essoufflement apparaissent à l'effort physique. À mesure que la sténose progresse, un essoufflement apparaît à moindre effort. Il convient de rappeler que les plaintes d'essoufflement peuvent être absentes même en cas d'hypertension pulmonaire avérée, car le patient peut mener une vie sédentaire ou limiter inconsciemment son activité physique quotidienne. Une dyspnée paroxystique nocturne survient suite à une stagnation du sang dans le CCI en position allongée, manifestation d'un œdème pulmonaire interstitiel et d'une forte augmentation de la pression artérielle dans les vaisseaux du CCI. En raison de l'augmentation de la pression dans les capillaires pulmonaires et de l'exsudation de plasma et d'érythrocytes dans la lumière des alvéoles, une hémoptysie peut se développer.
Les patients se plaignent souvent d'une fatigue accrue, de palpitations et d'un rythme cardiaque irrégulier. Un enrouement transitoire de la voix (syndrome d'Ortner) peut être observé. Ce syndrome résulte de la compression du nerf récurrent par l'oreillette gauche dilatée.
Les patients atteints de sténose mitrale ressentent souvent des douleurs thoraciques ressemblant à une angine de poitrine. Les causes les plus probables sont l'hypertension artérielle pulmonaire et l'hypertrophie ventriculaire droite.
En cas de décompensation sévère, on peut observer un faciès mitral (une rougeur bleu-rose sur les joues associée à une fraction d'éjection diminuée, une vasoconstriction systémique et une insuffisance cardiaque droite), une pulsation épigastrique et des signes d'insuffisance cardiaque ventriculaire droite.
 [ 21 ]
[ 21 ]
Inspection et auscultation
À l'inspection et à la palpation, on peut détecter des bruits cardiaques distincts de type I (S1) et II (S2). La palpation de S1 est optimale à l'apex et de S2 au bord supérieur gauche du sternum. La composante pulmonaire de S3 (P) est responsable de l'influx et résulte d'une hypertension artérielle pulmonaire. Une pulsation ventriculaire droite visible, palpée au bord gauche du sternum, peut accompagner une distension veineuse jugulaire en cas d'hypertension artérielle pulmonaire et de dysfonction diastolique ventriculaire droite.
L'impulsion apicale dans la sténose mitrale est le plus souvent normale ou diminuée, ce qui reflète la fonction normale du ventricule gauche et une diminution de son volume. Un premier ton palpable dans la région précordiale indique une mobilité préservée du feuillet antérieur de la valve mitrale. En position fauve, un tremblement diastolique peut être palpé. En cas d'hypertension pulmonaire, une impulsion cardiaque est notée le long du bord droit du sternum.
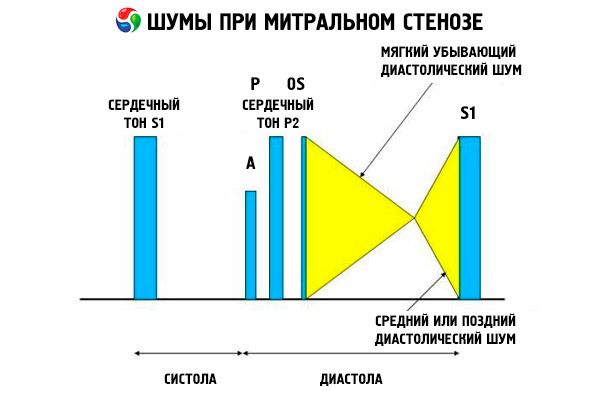
Le tableau auscultatoire de la sténose mitrale est assez caractéristique et comprend les signes suivants:
- 1er ton amplifié (claquement) dont l'intensité diminue au fur et à mesure que la sténose progresse;
- le ton d'ouverture de la valve mitrale suivant le deuxième ton, qui disparaît avec la calcification de la valve;
- souffle diastolique avec un maximum à l'apex (mésodiastolique, présystolique, pandiastolique), qui doit être écouté en position latérale gauche.
L'auscultation révèle un fort B1 provoqué par la fermeture brutale des cuspides de la valve mitrale sténosée, telle une voile qui se gonfle; ce phénomène est mieux perçu à l'apex. Un S divisé avec un P élargi dû à une hypertension artérielle pulmonaire est également fréquemment entendu. Le plus marquant est le claquement diastolique précoce des cuspides s'ouvrant dans le ventricule gauche (VG), plus intense au bord inférieur gauche du sternum. Il s'accompagne d'un souffle diastolique grave, en crescendo, qui s'entend mieux avec un stéthoscope en forme d'entonnoir placé à l'apex du cœur (ou au-dessus de l'impulsion apicale palpable) en fin d'expiration, lorsque le patient est allongé sur le côté gauche. Le bruit d'ouverture peut être faible, voire absent, si la valve mitrale est sclérosée, fibrotique ou épaissie. Le clic se rapproche du P (augmentant la durée du souffle) à mesure que la sténose mitrale et la pression auriculaire gauche augmentent. Le souffle diastolique augmente avec la manœuvre de Valsalva (lorsque le sang afflue dans l'oreillette gauche), après un effort, en s'accroupissant ou en tremblant. Il peut être moins prononcé si le ventricule droit dilaté déplace le ventricule gauche vers l'arrière et lorsque d'autres affections (hypertension artérielle pulmonaire, valvulopathie droite, fibrillation auriculaire avec fréquence ventriculaire rapide) réduisent le flux sanguin à travers la valve mitrale. L'augmentation présystolique est due au rétrécissement de l'orifice de la valve mitrale lors de la contraction du ventricule gauche, ce qui se produit également en cas de fibrillation auriculaire, mais seulement en fin de diastole courte, lorsque la pression auriculaire gauche est encore élevée.
Les souffles diastoliques suivants peuvent être associés au souffle de sténose mitrale:
- Souffle de Graham Still (souffle diastolique doux et decrescendo, mieux entendu au bord sternal gauche et causé par une régurgitation de la valve pulmonaire due à une hypertension pulmonaire sévère);
- Souffle d'Austin-Flint (souffle diastolique moyen à tardif entendu à l'apex du cœur et causé par l'effet du flux régurgitant aortique sur les feuillets de la valve mitrale) lorsque la cardite rhumatismale affecte les valves mitrale et aortique.
Les troubles qui provoquent des souffles diastoliques imitant le souffle de la sténose mitrale comprennent la régurgitation mitrale (due à un flux important à travers l'orifice mitral), la régurgitation aortique (provoquant un souffle d'Austin-Flint) et le myxome auriculaire (qui provoque un souffle qui change généralement de volume et de position à chaque battement de cœur).
La sténose mitrale peut provoquer des symptômes de cardiopathie pulmonaire. Le signe classique du faciès mitral (rougeur cutanée couleur prune au niveau de l'os malaire) n'apparaît que lorsque la fonction cardiaque est basse et l'hypertension pulmonaire sévère. Les causes du faciès mitral incluent la dilatation des vaisseaux cutanés et l'hypoxémie chronique.
Parfois, les premiers symptômes d'une sténose mitrale sont des manifestations d'un accident vasculaire cérébral embolique ou d'une endocardite. Cette dernière survient rarement en cas de sténose mitrale non accompagnée d'une régurgitation mitrale.
 [ 22 ], [ 23 ], [ 24 ], [ 25 ], [ 26 ], [ 27 ]
[ 22 ], [ 23 ], [ 24 ], [ 25 ], [ 26 ], [ 27 ]
Manifestations cliniques de l'hypertension pulmonaire dans la sténose mitrale
Les premiers symptômes de l’hypertension pulmonaire ne sont pas spécifiques, ce qui rend son diagnostic précoce beaucoup plus difficile.
La dyspnée est causée à la fois par une hypertension pulmonaire et par l'incapacité du cœur à augmenter son débit cardiaque à l'effort. La dyspnée est généralement inspiratoire, instable au début de la maladie et ne survient que lors d'un effort physique modéré. Puis, avec l'augmentation de la pression artérielle pulmonaire, elle apparaît lors d'un effort physique minimal et peut être présente au repos. En cas d'hypertension pulmonaire élevée, une toux sèche peut survenir. Il convient de rappeler que les patients peuvent inconsciemment limiter leur activité physique en s'adaptant à un certain mode de vie; de ce fait, les plaintes de dyspnée sont parfois absentes, même en cas d'hypertension pulmonaire avérée.
Faiblesse, fatigue accrue - les causes de ces plaintes peuvent être un débit cardiaque fixe (la quantité de sang éjectée dans l'aorte n'augmente pas en réponse à un effort physique), une résistance vasculaire pulmonaire accrue, ainsi qu'une diminution de la perfusion des organes périphériques et des muscles squelettiques en raison d'une circulation périphérique altérée.
Les étourdissements et les évanouissements sont causés par l’encéphalopathie hypoxique et sont généralement provoqués par un effort physique.
Une douleur persistante derrière le sternum et à sa gauche est causée par un étirement excessif de l'artère pulmonaire, ainsi que par un apport sanguin insuffisant au myocarde hypertrophié (insuffisance coronaire relative).
Palpitations cardiaques et battements cardiaques irréguliers. Ces symptômes sont associés à la survenue fréquente de fibrillation auriculaire.
L'hémoptysie survient suite à la rupture des anastomoses pulmonaires-bronchiques sous l'effet d'une hypertension pulmonaire veineuse élevée. Elle peut également être la conséquence d'une augmentation de la pression dans les capillaires pulmonaires et d'une fuite de plasma et d'érythrocytes dans la lumière des alvéoles. Elle peut également être un symptôme d'embolie pulmonaire et d'infarctus pulmonaire.
Pour caractériser la gravité de l’hypertension pulmonaire, la classification fonctionnelle proposée par l’OMS pour les patients présentant une insuffisance circulatoire est utilisée:
- Classe I: patients souffrant d'hypertension pulmonaire, mais sans limitation d'activité physique. L'activité physique normale ne provoque pas d'essoufflement, de faiblesse, de douleurs thoraciques ni de vertiges;
- Classe II: patients souffrant d'hypertension pulmonaire, entraînant une certaine réduction de l'activité physique. Au repos, ils se sentent bien, mais l'activité physique normale s'accompagne d'essoufflement, de faiblesse, de douleurs thoraciques et de vertiges.
- Classe III: patients souffrant d'hypertension pulmonaire, entraînant une limitation marquée de l'activité physique. Au repos, ils se sentent bien, mais une légère activité physique provoque un essoufflement, une faiblesse, des douleurs thoraciques et des vertiges.
- Classe IV – patients souffrant d'hypertension pulmonaire qui ne peuvent pratiquer aucune activité physique sans présenter les symptômes mentionnés. Un essoufflement ou une faiblesse sont parfois présents même au repos, et l'inconfort augmente avec une activité physique minimale.
Où est-ce que ça fait mal?
Formes
La sténose mitrale est classée en fonction de sa gravité (mise à jour des lignes directrices ACC/AHA/ASE 2003 pour l'application clinique de l'échocardiographie).
Classification de la sténose mitrale par degré
Degré de sténose |
Surface de l'orifice mitral, cm2 |
Gradient transmitral, mmHg |
Pression systolique dans l'artère pulmonaire, mm Hg |
Facile |
>1,5 |
<5 |
<30 |
Modéré |
1,0-1,5 |
5-10 |
30-50 |
Lourd |
<1 0 |
>10 |
>50 |
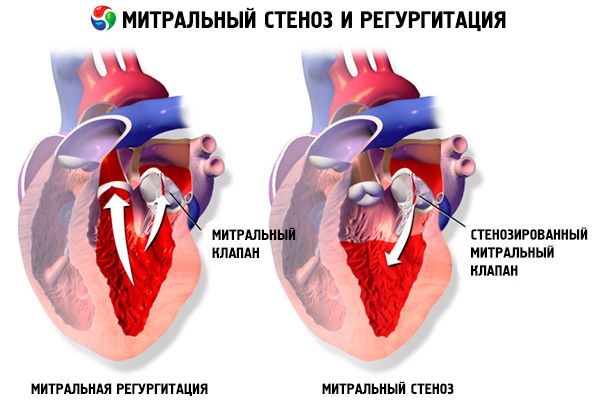
En cas de sténose mitrale, les feuillets de la valve mitrale s'épaississent et s'immobilisent, et l'orifice mitral se rétrécit en raison de la fusion des commissures. La cause la plus fréquente est le rhumatisme articulaire aigu, bien que la plupart des patients ne se souviennent pas d'avoir eu cette maladie. Parmi les causes plus rares, on peut citer la sténose mitrale congénitale, l'endocardite infectieuse, le lupus érythémateux disséminé, le myxome auriculaire, la polyarthrite rhumatoïde et le syndrome carcinoïde malin avec shunt auriculaire droite-gauche. Une régurgitation mitrale (RM) peut coexister avec une sténose mitrale si la valve ne se ferme pas complètement. De nombreux patients atteints de sténose mitrale due à un rhumatisme articulaire aigu présentent également une régurgitation aortique.
La surface normale de l'orifice de la valve mitrale est de 4 à 6 cm² . Une surface de 1 à 2 cm² indique une sténose mitrale modérée à sévère et provoque souvent des symptômes cliniques à l'effort. Une surface < 1 cm² représente une sténose critique et peut provoquer des symptômes au repos. La taille et la pression de l'oreillette gauche augmentent progressivement pour compenser la sténose mitrale. Les pressions veineuses et capillaires pulmonaires augmentent également et peuvent provoquer une hypertension pulmonaire secondaire, entraînant une insuffisance ventriculaire droite et une régurgitation tricuspide et pulmonaire. La vitesse de progression de la pathologie est variable.
La pathologie des valvules avec dilatation de l'oreillette gauche prédispose au développement de la fibrillation auriculaire (FA) et de la thromboembolie.
Diagnostics sténose mitrale
Le diagnostic préliminaire est posé cliniquement et confirmé par échocardiographie. L'échocardiographie bidimensionnelle renseigne sur le degré de calcification valvulaire, la taille de l'oreillette gauche et la sténose. L'échocardiographie Doppler renseigne sur le gradient transvalvulaire et la pression artérielle pulmonaire. L'échocardiographie transœsophagienne permet de détecter ou d'exclure de petits thrombus dans l'oreillette gauche, en particulier dans l'auricule gauche, souvent indétectables par examen transthoracique.
La radiographie thoracique montre généralement un effacement du bord gauche du cœur dû à une dilatation de l'auricule gauche. Le tronc principal de l'artère pulmonaire peut être visible; le diamètre de l'artère pulmonaire descendante droite peut dépasser 16 mm en cas d'hypertension pulmonaire sévère. Les veines pulmonaires des lobes supérieurs peuvent être dilatées, car les veines des lobes inférieurs sont comprimées, ce qui entraîne une congestion du lobe supérieur. Une double ombre d'une oreillette gauche élargie peut être observée le long du contour cardiaque droit. Des lignes horizontales dans les champs pulmonaires postérieurs inférieurs (lignes de Kerley) indiquent un œdème interstitiel associé à une pression auriculaire gauche élevée.
Le cathétérisme cardiaque est prescrit uniquement pour la détection préopératoire d'une maladie coronarienne: il est possible d'évaluer l'élargissement de l'oreillette gauche, la pression dans les artères pulmonaires et la zone valvulaire.
L'ECG du patient est caractérisé par l'apparition d'un P-mitral (large, avec une encoche PQ), une déviation de l'axe électrique du cœur vers la droite, notamment avec le développement d'une hypertension pulmonaire, ainsi qu'une hypertrophie des ventricules droit (avec sténose mitrale isolée) et gauche (avec association avec une insuffisance mitrale).
La sévérité de la sténose est évaluée par échographie Doppler. Le gradient de pression transmitrale moyen et la surface de la valve mitrale peuvent être déterminés avec une grande précision grâce à la technologie à onde continue. L'évaluation du degré d'hypertension pulmonaire, ainsi que des régurgitations mitrales et aortiques concomitantes, est essentielle.
Des informations complémentaires peuvent être obtenues grâce à une épreuve d'effort (échocardiographie d'effort) avec enregistrement du débit sanguin transmitral et tricuspidien. Si la surface de la valve mitrale est inférieure à 1,5 cm² et le gradient de pression supérieur à 50 mmHg (après effort), une valvuloplastie mitrale par ballonnet doit être envisagée.
De plus, le contraste écho spontané lors de l'échocardiographie transœsophagienne est un prédicteur indépendant de complications emboliques chez les patients atteints de sténose mitrale.
L'échocardiographie transœsophagienne permet de préciser la présence ou l'absence d'un thrombus auriculaire gauche et d'évaluer le degré d'insuffisance mitrale lors d'une valvuloplastie mitrale par ballonnet planifiée. De plus, l'examen transœsophagien permet d'évaluer avec précision l'état de l'appareil valvulaire et la gravité des modifications des structures sous-valvulaires, ainsi que d'évaluer le risque de resténose.
Le cathétérisme cardiaque et des gros vaisseaux est pratiqué lorsqu'une intervention chirurgicale est prévue et que les données des tests non invasifs ne permettent pas d'obtenir un résultat définitif. La mesure directe de la pression auriculaire et ventriculaire gauches nécessite un cathétérisme transseptal, associé à un risque injustifié. Une méthode indirecte de mesure de la pression auriculaire gauche est la pression artérielle pulmonaire bloquée.
Qu'est-ce qu'il faut examiner?
Diagnostic différentiel
Après un examen attentif, le diagnostic de maladie de la valve mitrale est généralement hors de doute.
La sténose mitrale est également différenciée du myxome auriculaire gauche, d'autres défauts valvulaires (insuffisance mitrale, sténose tricuspide), de la communication interauriculaire, de la sténose veineuse pulmonaire et de la sténose mitrale congénitale.
 [ 51 ], [ 52 ], [ 53 ], [ 54 ], [ 55 ], [ 56 ], [ 57 ]
[ 51 ], [ 52 ], [ 53 ], [ 54 ], [ 55 ], [ 56 ], [ 57 ]
Exemples de formulation de diagnostic
- Cardiopathie rhumatismale. Valvulopathie mitrale combinée avec sténose prédominante de l'orifice auriculo-ventriculaire gauche de grade III. Fibrillation auriculaire, forme permanente, tachysystolie. Hypertension artérielle pulmonaire modérée. Stade NK PB, FC III.
- Cardiopathie rhumatismale. Anomalie valvulaire mitrale combinée. Prothèse valvulaire mitrale (Medinzh - 23) à partir du JJ/MM/GG. Stade NK IIA, II FC.
Qui contacter?
Traitement sténose mitrale
Les principaux objectifs du traitement des patients atteints de sténose mitrale sont d’améliorer le pronostic et d’augmenter l’espérance de vie, ainsi que d’atténuer les symptômes de la maladie.
Il est conseillé aux patients asymptomatiques de limiter leur activité physique intense. En cas de décompensation et d'insuffisance cardiaque chronique, une restriction alimentaire en sodium est recommandée.
Traitement médicamenteux de la sténose mitrale
Un traitement médicamenteux peut être utilisé pour contrôler les symptômes de la sténose mitrale, par exemple en préparation à une intervention chirurgicale. Les diurétiques réduisent la pression auriculaire gauche et soulagent les symptômes associés à la sténose mitrale. Cependant, ils doivent être utilisés avec prudence, car ils peuvent réduire le débit cardiaque. Les bêtabloquants et les inhibiteurs calciques (vérapamil et diltiazem) réduisent la fréquence cardiaque au repos et à l'effort, améliorant le remplissage du ventricule gauche en prolongeant la diastole. Ces médicaments peuvent soulager les symptômes associés à l'activité physique et sont particulièrement indiqués en cas de tachycardie sinusale et de fibrillation auriculaire.
La fibrillation auriculaire est une complication fréquente de la sténose mitrale, en particulier chez les personnes âgées. Le risque de thromboembolie en présence de fibrillation auriculaire augmente significativement (la survie à 10 ans est de 25 % des patients contre 46 % chez les patients en rythme sinusal).
Les anticoagulants indirects (warfarine, dose initiale de 2,5 à 5,0 mg, sous contrôle de l'INR) sont indiqués;
- tous les patients présentant une sténose mitrale compliquée de fibrillation auriculaire (forme paroxystique, persistante ou permanente);
- patients ayant des antécédents d’événements emboliques, même avec un rythme sinusal préservé;
- patients présentant un thrombus dans l’oreillette gauche;
- les patients présentant une sténose mitrale sévère et les patients dont la taille de l'oreillette gauche est > 55 mm.
Le traitement est réalisé sous contrôle de l'INR, dont les valeurs cibles sont comprises entre 2 et 3. Si le patient développe des complications emboliques malgré le traitement anticoagulant, il est recommandé d'ajouter de l'acide acétylsalicylique à une dose de 75 à 100 mg/jour (les alternatives sont le dipyridamole ou le clopidogrel). Il convient de noter qu'aucun essai contrôlé randomisé n'a été mené sur l'utilisation d'anticoagulants chez les patients atteints de sténose mitrale; les recommandations reposent sur l'extrapolation des données obtenues dans des cohortes de patients atteints de fibrillation auriculaire.
Étant donné que le développement d'une fibrillation atriale chez un patient présentant une sténose mitrale s'accompagne d'une décompensation, un traitement visant à ralentir le rythme ventriculaire est primordial. Comme mentionné précédemment, les bêta-bloquants, le vérapamil ou le diltiazem peuvent être les médicaments de choix. La digoxine peut également être utilisée, mais son intervalle thérapeutique étroit et sa moindre capacité à prévenir l'accélération du rythme cardiaque à l'effort limitent son utilisation par rapport aux bêta-bloquants. La cardioversion électrique est également d'une utilité limitée en cas de fibrillation atriale persistante, car sans traitement chirurgical, le risque de rechute est très élevé.
Traitement chirurgical de la sténose mitrale
La principale méthode de traitement de la sténose mitrale est chirurgicale, car il n’existe aujourd’hui aucun traitement médicamenteux capable de ralentir la progression de la sténose.
Les patients présentant des symptômes plus graves ou des signes d’hypertension artérielle pulmonaire nécessitent une valvotomie, une commissurotomie ou un remplacement valvulaire.
La procédure de choix est la valvuloplastie mitrale percutanée par ballonnet. Il s'agit de la principale méthode de traitement chirurgical de la sténose mitrale. On utilise également la commissurotomie ouverte et le remplacement valvulaire mitral.
La valvotomie percutanée par ballonnet est la technique privilégiée chez les patients jeunes, les patients âgés intolérants aux interventions plus invasives et les patients sans calcification valvulaire significative, déformation sous-valvulaire, thrombus auriculaire gauche ou régurgitation mitrale importante. Lors de cette intervention, sous contrôle échocardiographique, un ballonnet est introduit à travers le septum auriculaire de l'oreillette droite à l'oreillette gauche et gonflé pour séparer les feuillets fusionnés de la valve mitrale. Les résultats sont comparables à ceux des interventions plus invasives. Les complications sont rares et incluent l'insuffisance mitrale, l'embolie, la perforation ventriculaire gauche et une communication interauriculaire, susceptible de persister en cas de différence de pression interauriculaire importante.
La valvuloplastie mitrale percutanée par ballonnet est indiquée pour les groupes de patients suivants dont la surface de l'orifice mitral est inférieure à 1,5 cm 2:
- patients décompensés présentant des caractéristiques favorables à la valvuloplastie mitrale percutanée (classe I, niveau de preuve B);
- patients décompensés présentant des contre-indications au traitement chirurgical ou un risque chirurgical élevé (classe I, niveau de preuve! IC);
- en cas de correction chirurgicale primaire planifiée du défaut chez les patients présentant une morphologie valvulaire inadaptée, mais avec des caractéristiques cliniques satisfaisantes (classe IIa, niveau de preuve C);
- patients « asymptomatiques » présentant des caractéristiques morphologiques et cliniques adaptées, un risque élevé de complications thromboemboliques ou un risque élevé de décompensation des paramètres hémodynamiques;
- avec des antécédents de complications emboliques (classe IIa, niveau de preuve C);
- avec phénomène d'écho de contraste spontané dans l'oreillette gauche (classe IIa, niveau de preuve C);
- avec fibrillation auriculaire permanente ou paroxystique (classe IIa, niveau de preuve C);
- avec une pression systolique de l'artère pulmonaire supérieure à 50 mmHg (classe IIa, niveau de preuve C);
- lorsque des interventions chirurgicales majeures non cardiaques sont nécessaires (classe IIa, niveau de preuve C);
- en cas de planification d'une grossesse (classe IIa, niveau de preuve C).
Les caractéristiques appropriées pour la valvuloplastie mitrale percutanée sont l'absence des caractéristiques suivantes:
- clinique: âge avancé, antécédents de commissurotomie, insuffisance cardiaque fonctionnelle de classe IV, fibrillation auriculaire, hypertension pulmonaire sévère;
- Morphologique: calcification de la valve mitrale de tout degré, évaluée par fluorographie, très petite surface de la valve mitrale, régurgitation tricuspide sévère.
Les patients présentant une maladie sous-valvulaire sévère, une calcification valvulaire ou des thrombus dans l'oreillette gauche peuvent être candidats à une commissurotomie. Cette intervention consiste à séparer les feuillets fusionnés de la valve mitrale à l'aide d'un dilatateur introduit dans l'oreillette et le ventricule gauches (commissurotomie fermée) ou manuellement (commissurotomie ouverte). Ces deux interventions nécessitent une thoracotomie. Le choix dépend de la situation chirurgicale et du degré de fibrose et de calcification.
La chirurgie plastique de la valve mitrale (commissurotomie ouverte) ou son remplacement est pratiqué pour les indications de classe I suivantes.
En présence d'insuffisance cardiaque III-IV FC et de sténose mitrale modérée ou sévère dans les cas où:
- la valvuloplastie par ballonnet mitral ne peut pas être réalisée;
- La valvuloplastie mitrale par ballonnet est contre-indiquée en raison d'un thrombus dans l'oreillette gauche malgré l'utilisation d'anticoagulants, ou en raison d'une régurgitation mitrale concomitante modérée ou sévère;
- la morphologie de la valve n'est pas adaptée à la valvuloplastie par ballonnet mitral.
En cas de sténose mitrale modérée à sévère et de régurgitation mitrale concomitante modérée à sévère (le remplacement valvulaire est indiqué si la réparation valvulaire n'est pas possible).
Le remplacement valvulaire est une solution de dernier recours. Il est prescrit aux patients présentant une surface mitrale inférieure à 1,5 cm² , des symptômes modérés à sévères et une pathologie valvulaire (par exemple, une fibrose) empêchant le recours à d'autres méthodes.
Le remplacement de la valve mitrale est recommandé (indications de classe IIa) en cas de sténose mitrale sévère et d'hypertension artérielle pulmonaire sévère (pression systolique artérielle pulmonaire supérieure à 60 mm Hg), symptômes d'insuffisance cardiaque de classe I-II, sauf si une valvuloplastie par ballonnet mitral ou un remplacement de la valve mitrale est proposé. Les patients atteints de sténose mitrale et ne présentant pas de symptômes de décompensation doivent être examinés annuellement. Cet examen comprend le recueil des plaintes, l'anamnèse, un examen, une radiographie thoracique et un ECG. Si l'état du patient a évolué au cours de la période précédente ou si les résultats de l'examen précédent indiquent une sténose mitrale sévère, une échocardiographie est indiquée. Dans tous les autres cas, une échocardiographie annuelle n'est pas nécessaire. Si le patient se plaint de palpitations, une surveillance ECG sur 24 heures (Holter) est recommandée pour détecter les paroxysmes de fibrillation auriculaire.
Pendant la grossesse, les patientes présentant une sténose légère à modérée ne peuvent recevoir qu'un traitement médicamenteux. L'utilisation de diurétiques et de bêtabloquants est sans danger. Si un traitement anticoagulant est nécessaire, des injections d'héparine sont prescrites, la warfarine étant contre-indiquée.
La prévention
L'enjeu le plus important de la prise en charge des patients atteints de sténose mitrale est la prévention des récidives de rhumatisme articulaire aigu grâce à des pénicillines à libération prolongée prescrites à vie, ainsi qu'à tous les patients après correction chirurgicale du défaut (y compris pour la prévention de l'endocardite infectieuse). La benzylpénicilline est prescrite à la dose de 2,4 millions d'unités chez l'adulte et de 1,2 million d'unités chez l'enfant, par voie intramusculaire, une fois par mois.
Tous les patients présentant une sténose mitrale sont indiqués en prévention secondaire des récidives de rhumatisme articulaire aigu. De plus, tous les patients sont indiqués en prévention de l'endocardite infectieuse.
Les patients asymptomatiques n'ont besoin que d'une prophylaxie contre le rhumatisme articulaire aigu récurrent [par exemple, des injections intramusculaires de benzylpénicilline (pénicilline G sel de sodium stérile) 1,2 million d'unités toutes les 3 ou 4 semaines] jusqu'à l'âge de 25 à 30 ans et d'une prophylaxie de l'endocardite avant les procédures à risque.
Prévoir
L'évolution naturelle de la sténose mitrale est variable, mais le délai entre l'apparition des symptômes et l'invalidité sévère est d'environ 7 à 9 ans. L'issue du traitement dépend de l'âge du patient, de son état fonctionnel, de son hypertension artérielle pulmonaire et du degré de fibrillation auriculaire. Les résultats de la valvotomie et de la commissurotomie sont équivalents, les deux méthodes rétablissant la fonction valvulaire chez 95 % des patients. Cependant, la fonction se détériore avec le temps chez la plupart des patients, et beaucoup nécessitent une nouvelle intervention. Les facteurs de risque de décès incluent la fibrillation auriculaire et l'hypertension pulmonaire. La cause du décès est généralement une insuffisance cardiaque ou une embolie pulmonaire ou cérébrovasculaire.
La sténose mitrale évolue généralement lentement et présente une longue période de compensation. Plus de 80 % des patients survivent 10 ans sans symptômes ni signes modérés d'ICC (classe I-II FC selon la NUHA). Le taux de survie à 10 ans des patients décompensés et non opérés est significativement plus faible et ne dépasse pas 15 %. En cas d'hypertension artérielle pulmonaire sévère, la survie moyenne ne dépasse pas 3 ans.
 [ 74 ]
[ 74 ]

