Expert médical de l'article
Nouvelles publications
Syndrome d'hyperstimulation ovarienne
Dernière revue: 05.07.2025

Tout le contenu iLive fait l'objet d'un examen médical ou d'une vérification des faits pour assurer autant que possible l'exactitude factuelle.
Nous appliquons des directives strictes en matière d’approvisionnement et ne proposons que des liens vers des sites de médias réputés, des instituts de recherche universitaires et, dans la mesure du possible, des études évaluées par des pairs sur le plan médical. Notez que les nombres entre parenthèses ([1], [2], etc.) sont des liens cliquables vers ces études.
Si vous estimez qu'un contenu quelconque de notre contenu est inexact, obsolète ou discutable, veuillez le sélectionner et appuyer sur Ctrl + Entrée.
Le syndrome d’hyperstimulation ovarienne (SHO) est une complication iatrogène basée sur la réponse hyperergique incontrôlée des ovaires à l’administration de gonadotrophines dans les cycles de stimulation de l’ovulation et les programmes de procréation assistée.
Le syndrome peut se manifester après l’induction de l’ovulation par le clomifène ou au début de la grossesse dans un cycle spontané.
 [ 1 ]
[ 1 ]
Épidémiologie
L'incidence du syndrome d'hyperstimulation ovarienne varie de 0,5 à 14 % selon les schémas de stimulation de l'ovulation et ne tend pas à diminuer. La maladie présente des degrés de gravité variables et peut être mortelle en raison de complications thromboemboliques ou d'un syndrome de détresse respiratoire aiguë (SDRA). Le taux de mortalité attendu est de 1 femme sur 450 000 à 500 000 femmes. Les formes sévères du syndrome, nécessitant une hospitalisation en unité de soins intensifs, surviennent chez 0,2 à 10 % des femmes. Selon le Registre national russe des techniques de procréation médicalement assistée, l'incidence du SHO sévère en 2004 était de 5,6 %.
Causes du syndrome d'hyperstimulation ovarienne
Facteurs de risque de développement du syndrome d’hyperstimulation ovarienne:
- âge inférieur à 35 ans,
- physique asthénique,
- la présence d'ovaires polykystiques ou multifolliculaires,
- maturation de plus de dix follicules dans le protocole de stimulation de l'ovulation,
- utilisation de médicaments agonistes de l'hormone de libération des gonadotrophines et de doses élevées de gonadotrophines,
- le début de la grossesse,
- soutien de la phase lutéale avec des préparations d'hCG,
- maladies allergiques.
Comment se développe le syndrome d’hyperstimulation ovarienne?
Le syndrome d'hyperstimulation ovarienne survient dans un contexte de concentration anormalement élevée d'hormones sexuelles dans le plasma sanguin, affectant négativement le fonctionnement de divers systèmes de l'organisme, principalement des ovaires. Il se caractérise par une augmentation de la taille des ovaires, parfois jusqu'à 20-25 cm de diamètre, avec formation de kystes folliculaires et lutéaux sur fond d'œdème stromal prononcé. Le déclencheur du syndrome est l'administration d'une dose ovulatoire de gonadotrophine chorionique. Le développement du syndrome repose sur le phénomène d'augmentation de la perméabilité vasculaire, entraînant une libération massive de liquide riche en protéines dans le troisième espace, l'interstitium, et son dépôt, avec apparition d'hypovolémie, d'hémoconcentration, d'oligurie, d'hypoprotéinémie, de déséquilibre électrolytique, d'augmentation de l'activité des enzymes hépatiques, de formation d'ascite, d'hydrothorax, d'hydropéricarde avec ou sans choc hypovolémique. Cependant, le « facteur X » responsable de la transsudation liquidienne reste inconnu. Dans les cas graves, une anasarque, une insuffisance rénale aiguë, des complications thromboemboliques et un SDRA peuvent survenir.
Actuellement, le syndrome d'hyperstimulation ovarienne est envisagé sous l'angle du syndrome d'hyperstimulation ovarienne systémique (SIRS), dans lequel des lésions massives de l'endothélium se produisent. Chez les patientes atteintes de SHO, des concentrations élevées d'interleukines (IL-1, IL-2, IL-6, IL-8) et de facteurs de nécrose tumorale (TNF-α, TNF-(3)), qui stimulent la synthèse des prostaglandines par les ovaires, la néovascularisation ovarienne et la perméabilité vasculaire, ont été observées dans le transsudat péritonéal. Sous l'influence des cytokines pro-inflammatoires, les processus de coagulation sont activés systémiquement. L'ampleur de la leucocytose est corrélée à la gravité du SIRS. Les lésions organiques et systémiques du SHO sont similaires à celles du sepsis. Le rôle du facteur microbien dans le SHO et sa contribution au développement du SIRS font actuellement l'objet de discussions. On suppose que les micro-organismes colonisant les intestins et les voies génito-urinaires peuvent pénétrer au-delà de leur habitat et avoir un effet sur le corps similaire à celui de la septicémie.
Symptômes du syndrome d'hyperstimulation ovarienne
La gravité du syndrome est directement liée à la gravité des troubles hémodynamiques à l'origine du tableau clinique. L'apparition du syndrome peut être progressive, avec une aggravation des symptômes, ou soudaine (aiguë), avec une redistribution brutale des liquides dans l'organisme en quelques heures, avec accumulation dans les cavités séreuses. Lors de son apparition, le syndrome se manifeste par des plaintes de faiblesse, de vertiges, de maux de tête, de visions vacillantes, d'essoufflement au repos et à l'effort, de toux sèche qui s'intensifie en position allongée, de sécheresse buccale, de nausées, de vomissements, de diarrhée, de ballonnements, de sensation de distension, de tension, de douleurs abdominales souvent mal localisées, de mictions rares, de fièvre, de gonflement des organes génitaux externes et des membres inférieurs.
Chez les patientes atteintes d'un syndrome d'hyperstimulation ovarienne, une insuffisance respiratoire peut se développer en raison d'une mobilité pulmonaire limitée due à une ascite, une hypertrophie ovarienne ou un épanchement pleural. L'évolution d'un SHO sévère au stade de manifestation peut se compliquer d'un hydrothorax aigu, d'un SDRA, d'une embolie pulmonaire, d'une atélectasie et d'une hémorragie intra-alvéolaire. Un épanchement pleural est diagnostiqué chez environ 70 % des femmes atteintes d'un SHO modéré à sévère. Cet épanchement peut être unilatéral ou bilatéral et survenir dans un contexte d'ascite. Dans le SHO, un déplacement et une compression des organes médiastinaux dus à un épanchement pleural droit massif avec apparition d'un état de choc ont été décrits, ainsi qu'une issue fatale chez une femme atteinte d'un SHO et d'un hydrothorax due à une atélectasie et à une hémorragie massive dans la lumière alvéolaire.
Troubles hémodynamiques. En cas de SHO modéré ou sévère, une hypotension artérielle et une tachycardie surviennent.
Ascite. L'abdomen est distendu, souvent tendu, douloureux dans toutes les régions, mais plus souvent dans l'hypogastre, au niveau de la projection des ovaires.
Dysfonctionnement rénal et hépatique. On observe une rétention urinaire, une oligurie, une anurie et une hépatomégalie.
L'évolution du SHO chez 80 % des patientes atteintes d'une forme sévère du syndrome s'accompagne de fièvre. Chez 20 % des femmes, la fièvre survient dans le contexte d'une infection urinaire, chez 3,8 % d'une pneumonie et chez 3,3 % d'une infection des voies respiratoires supérieures. Une thrombophlébite due à la pose d'un cathéter intraveineux provoque de la fièvre chez 2 % des patientes et une inflammation de la graisse sous-cutanée au point de ponction de la paroi abdominale lors d'une laparocentèse chez 1 % des patientes. Une infection de la plaie chirurgicale survient chez 1 % des patientes et des abcès post-injection (administration intramusculaire de progestérone) chez 0,5 % des patientes. Une fièvre d'origine non infectieuse chez une patiente sur deux atteinte de SHO est probablement associée à des mécanismes pyrogènes endogènes. Des cas isolés de sepsis au cours d'un SHO sévère ont été décrits.
Dans le contexte du développement du syndrome, une exacerbation des maladies somatiques chroniques latentes se produit.
Qu'est ce qui te tracasse?
Classification
Il n'existe pas de classification unique du syndrome d'hyperstimulation ovarienne. En fonction des symptômes cliniques et biologiques, on distingue quatre degrés de gravité du syndrome:
- SHO léger. Gêne abdominale, ovaires jusqu'à 8 cm de diamètre avec ou sans kystes, paramètres biologiques normaux. Le SHO léger est appelé « hyperstimulation ovarienne contrôlée », car cette affection est observée à tous les cycles de stimulation de superovulation et n'est actuellement pas considérée comme un syndrome pathologique nécessitant un traitement.
- SHO modéré. Douleurs abdominales modérées, nausées, vomissements, diarrhée, ovaires de 8 à 12 cm de diamètre avec kystes, signes échographiques et/ou cliniques d'ascite, hématocrite inférieur à 45 %, leucocytose: 10-16 x 10 9 /l, hypercoagulation (D-dimères: plus de 0,5 µg/ml, fibrinogène: plus de 400 mg/dl, TCA, INR: dans les limites de la normale).
- SHO sévère. Hématocrite supérieur à 45 %, leucocytose 17-24 x 109 /l, hypercoagulation (D-dimères supérieurs à 5 μg/ml, fibrinogène supérieur à 600 mg/dl), ovaires de plus de 12 cm de diamètre avec kystes, signes cliniques et biologiques d'un SHO modéré et ascite tendue, hydrothorax, dysfonctionnement hépatique, oligurie [diurèse inférieure à 0,5 ml/(kg·h)].
- SHO critique. Hématocrite supérieur à 55 %, leucocytose supérieure à 25 x 109/l, ascite tendue, hydrothorax bilatéral, hydropéricarde, anasarque, ovaires hypertrophiés jusqu'à 20-25 cm, oligurie ou anurie, insuffisance rénale aiguë, complications thromboemboliques, SDRA.
Le syndrome d’hyperstimulation ovarienne est également divisé en syndrome précoce et tardif.
Si le SHO survient en phase lutéale et qu'il n'y a pas d'implantation, le syndrome disparaît soudainement et spontanément avec l'apparition des règles, atteignant rarement une forme sévère. En cas d'implantation, une détérioration de l'état de la patiente est le plus souvent observée au cours des 12 premières semaines de grossesse. Le SHO tardif est causé par une augmentation significative du taux d'hCG dans le plasma sanguin et est généralement associé à l'implantation et à un début de grossesse.
Conséquences et complications
Les complications du syndrome d'hyperstimulation ovarienne peuvent évoluer vers des complications thromboemboliques. La cause de la thrombose dans le SHO reste inconnue, mais le rôle principal dans la pathogenèse de cette affection est attribué à des concentrations élevées d'hormones sexuelles, de cytokines pro-inflammatoires, à l'hémoconcentration et à une diminution de la PCV. Une hospitalisation prolongée, une activité motrice limitée, une diminution du retour veineux due à une hypertrophie ovarienne, une augmentation de l'activité des facteurs de coagulation, des inhibiteurs de la fibrinolyse et des plaquettes contribuent également au risque élevé de complications thrombotiques associées au SHO. Il a été démontré que chez 84 % des patientes présentant des complications thromboemboliques survenues après une induction de l'ovulation et dans le cadre de programmes de procréation médicalement assistée, leur apparition s'est produite pendant la grossesse. Dans 75 % des cas, la formation de thrombus a été observée dans le lit veineux, avec une localisation prédominante dans les vaisseaux des membres supérieurs, du cou et de la tête (60 %). Un certain nombre de patients ont été diagnostiqués avec une thrombose artérielle spontanée localisée dans les vaisseaux cérébraux. Plus rarement, des thrombus ont été observés dans les artères fémorale, poplitée, carotide, sous-clavière, iliaque, ulnaire, mésentérique et l'aorte. La littérature fait état d'une observation du développement d'une occlusion de l'artère centrale de la rétine avec perte de vision dans le cadre d'un SHO. L'incidence d'embolie pulmonaire chez les patients atteints de SHO et de thrombose veineuse profonde des membres inférieurs est de 29 %, tandis que chez les femmes atteintes de SHO et de thrombose veineuse profonde des membres supérieurs et de thrombose artérielle, le risque de cette complication est significativement plus faible, atteignant respectivement 4 et 8 %.
Les cas graves de syndrome d'hyperstimulation ovarienne peuvent s'accompagner de complications nécessitant une intervention chirurgicale - rupture d'un kyste ovarien et saignement intra-abdominal, torsion des appendices utérins, grossesse extra-utérine.
Diagnostic du syndrome d'hyperstimulation ovarienne
Le diagnostic du syndrome d'hyperstimulation ovarienne est établi sur la base des données de l'anamnèse, d'un examen clinique, de laboratoire et instrumental complet qui révèle des ovaires hypertrophiés avec de multiples kystes, une hémoconcentration prononcée et une hypercoagulation chez une patiente qui a utilisé des technologies de procréation assistée ou une induction contrôlée de l'ovulation dans ce cycle pour obtenir une grossesse.
Recherche en laboratoire
Test sanguin clinique
Hématocrite supérieur à 40 %, concentration d'hémoglobine supérieure à 140 g/l, leucocytose jusqu'à 50x10 9 /l sans déplacement vers la gauche, thrombocytose jusqu'à 500-600x10 6 /l. Une hémoconcentration (hématocrite supérieure à 55 %) indique une menace potentielle pour la vie.
Test sanguin biochimique
Déséquilibre électrolytique, incluant hyperkaliémie (plus de 5,3 mmol/l) et hyponatrémie (plus de 135 mmol/l), entraînant une diminution de l'osmolarité plasmatique. Hypoprotéinémie (protéines totales supérieures à 66 g/l), hypoalbuminémie (albumine inférieure à 35 g/l), protéine C-réactive élevée, augmentation des transaminases hépatiques jusqu'à 800 U/l, dans certains cas augmentation des GGT ou des phosphatases alcalines, chez certains patients - augmentation de la concentration de créatinine supérieure à 80 μmol/l et de l'urée supérieure à 8,3 mmol/l.
 [ 20 ], [ 21 ], [ 22 ], [ 23 ]
[ 20 ], [ 21 ], [ 22 ], [ 23 ]
Coagulogramme
Taux de fibrinogène augmentés de plus de 400 mg/dl, facteur de von Willebrand de plus de 140 %, concentrations d'antithrombine III diminuées de moins de 80 %, D-dimères de plus de 0,5 µg/ml. Valeurs normales pour le TCA, l'ITP et l'INR.
 [ 24 ]
[ 24 ]
Immunoglobulines sanguines
Diminution de la concentration plasmatique d'IgG et d'IgA. Analyse d'urine générale. Protéinurie.
Analyse de la composition du liquide ascitique
Teneur élevée en protéines (plus de 42 g/l) et en albumine (plus de 23 g/l), faible nombre de globules blancs, nombre relativement élevé de globules rouges, concentrations élevées de toutes les cytokines pro-inflammatoires, protéine C-réactive jusqu'à 135 mg/l (normale 0-8,2 mg/l), fraction globuline des protéines.
 [ 25 ], [ 26 ], [ 27 ], [ 28 ], [ 29 ], [ 30 ], [ 31 ]
[ 25 ], [ 26 ], [ 27 ], [ 28 ], [ 29 ], [ 30 ], [ 31 ]
Marqueurs tumoraux dans le plasma sanguin
La concentration de CA-125, reflétant une prolifération massive du tissu ovarien, atteint son maximum (jusqu'à 5 125 U/ml) dès la deuxième semaine de développement du SHO, lorsque les deux ovaires sont les plus hypertrophiés. Malgré le traitement, le taux élevé de ce marqueur tumoral persiste jusqu'à 15 à 23 semaines après l'apparition des signes du syndrome d'hyperstimulation ovarienne.
La procalcitonine dans le sérum sanguin est déterminée chez 50 % des patients dans la plage de 0,5 à 2,0 ng/ml, ce qui est considéré comme une réaction inflammatoire systémique modérée.
Recherche microbiologique
Lors de l'examen de l'urine sécrétée par le vagin et le canal cervical, des agents pathogènes atypiques Pseudomonas, Proteus, Klebsiella, Enterobacter, E. coli sont isolés en quantités supérieures à 10 000 UFC/ml.
Recherche instrumentale
Échographie des organes pelviens
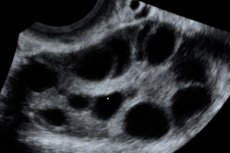
Ovaires élargis de 6 à 25 cm de diamètre avec kystes multiples, utérus de taille normale ou élargi, présence de liquide libre dans la cavité pelvienne et grossesse simple ou multiple évolutive normale.
Échographie des organes abdominaux
Présence de liquide libre dans la cavité abdominale (volume compris entre 1 et 5-6 litres). Taille et structure normales du foie ou hépatomégalie. Signes échographiques de dyskinésie biliaire. À l'examen des reins, le complexe calicio-pelvien est inchangé.
Échographie des cavités pleurales
Présence de liquide libre (EchoCG). Dans le contexte de troubles hémodynamiques, diminution de la FE, diminution du volume télédiastolique, diminution du retour veineux et, dans certains cas, présence de liquide libre dans la cavité péricardique.
ECG
Troubles du rythme tels qu'extrasystole ventriculaire, tachycardie, modifications diffuses du métabolisme et des électrolytes dans le myocarde. Radiographie thoracique. Réalisée en cas de suspicion de SDRA et de thromboembolie. Un signe radiographique caractéristique du SDRA est l'apparition d'un motif en verre dépoli et d'infiltrats multifocaux diffus de densité assez élevée (consolidation) avec des bronches aériennes bien définies, ce qui correspond à une atteinte étendue du parenchyme pulmonaire. En cas d'embolie pulmonaire, la radiographie révèle une position haute du dôme diaphragmatique, une atélectasie discoïde, une pléthore d'une racine pulmonaire ou une racine « sectionnée », une diminution du motif pulmonaire sur la zone ischémique du poumon et une ombre triangulaire périphérique d'inflammation.
Indications de consultation avec d'autres spécialistes
En raison de l'implication de tous les organes et systèmes dans le processus pathologique, un examen par un thérapeute est obligatoire. En cas de suspicion de complications thrombotiques, une consultation avec un chirurgien vasculaire est nécessaire. En cas d'hydrothorax prononcé, une consultation avec un chirurgien thoracique est nécessaire pour décider de la réalisation d'une ponction pleurale.
Qu'est-ce qu'il faut examiner?
Comment examiner?
Quels tests sont nécessaires?
Traitement du syndrome d'hyperstimulation ovarienne
L'absence d'une compréhension claire de la physiopathologie du SHO rend impossible la mise en œuvre d'un traitement efficace et pathogéniquement justifié, permettant d'enrayer rapidement et efficacement le développement du syndrome et des troubles multiviscérales accompagnant les formes sévères de syndrome d'hyperstimulation ovarienne. Actuellement, il n'existe pas de traitement spécifique pour le syndrome d'hyperstimulation ovarienne; le traitement de ces patientes se limite donc à un traitement pathogénique jusqu'à régression spontanée du syndrome, la concentration plasmatique d'hCG diminuant en 7 jours en l'absence de grossesse, ou en 10 à 20 jours en cas de grossesse. La plupart des patientes hospitalisées en unité de soins intensifs sont admises avec un diagnostic de SHO après un traitement ambulatoire, qui comprend une évaluation quotidienne du poids et de la diurèse, une limitation de l'activité physique et sexuelle excessive, une consommation abondante de boissons riches en électrolytes et des analyses de sang périodiques. La discussion de la stratégie de traitement pour ce groupe de patients implique un traitement symptomatique complet visant à prévenir le développement du PRF en restaurant le CCP, en éliminant l'hémoconcentration, le déséquilibre électrolytique, en prévenant l'insuffisance rénale aiguë, le SDRA et les complications thromboemboliques.
Étape 1 - évaluation de la gravité de l'état
La première étape pour déterminer la stratégie de prise en charge d'une patiente atteinte d'un syndrome d'hyperstimulation ovarienne consiste à évaluer l'hémodynamique et la fonction respiratoire. Un examen clinique complet, incluant une étude approfondie de l'état des membres, de la tête et du cou, est également nécessaire afin d'exclure une thrombose veineuse profonde et de mettre en place un cathéter veineux périphérique ou un cathétérisme veineux central. Le cathétérisme veineux sous-clavier est le plus indiqué, car le risque de thrombose est alors le plus faible. Un cathétérisme vésical est nécessaire pour évaluer la diurèse. Il est nécessaire d'examiner quotidiennement les paramètres sanguins, les électrolytes plasmatiques, les protéines, l'activité des enzymes hépatiques, la créatinine, l'urée et les paramètres du coagulogramme. Une échographie abdominale est réalisée pour déterminer le degré d'hypertrophie ovarienne et la présence d'ascite.
Étape 2 – thérapie par perfusion
Le traitement médicamenteux des patientes atteintes de SHO doit viser à maintenir l'hémodynamique et à mobiliser le liquide abdominal en créant un bilan hydrosodique négatif. L'objectif principal est de remplacer le volume de liquide circulant afin de réduire l'hémoconcentration et de maintenir une filtration rénale suffisante. Des solutions cristalloïdes et colloïdales sont utilisées pour le traitement par perfusion du syndrome d'hyperstimulation ovarienne.
Le choix de la solution cristalloïde est déterminé par le déséquilibre électrolytique. Pour déterminer la quantité de cristalloïdes administrée, il est nécessaire de prendre en compte qu'en cas de lésion endothéliale généralisée, le volume de ces solutions doit être 2 à 3 fois inférieur à celui des solutions colloïdales, car la prédominance des cristalloïdes aggrave l'accumulation de liquide dans les cavités séreuses et, dans certains cas, entraîne le développement d'une anasarque.
Le médicament de choix pour la restauration et le maintien du volume intravasculaire chez les patients atteints de SHO est l'hydroxyéthylamidon 130/0,42, en volume quotidien de 25 à 30 ml/kg. L'hydroxyéthylamidon 200/0,5 peut également être utilisé dans le traitement de base du SHO à raison de 20 ml/kg x jour. Cependant, il peut s'accumuler dans l'organisme et, en cas d'utilisation prolongée, provoquer un dysfonctionnement hépatique et augmenter le taux de transaminases hépatiques, parfois jusqu'à 800 U/l. Chez ce groupe de patients, l'utilisation de l'hydroxyéthylamidon 450/0,7 est inappropriée en raison du risque élevé de réactions allergiques, d'effets indésirables sur les fonctions rénale et hépatique, et de la détérioration des paramètres d'hémocoagulation (allongement du temps de coagulation, risque de complications hémorragiques). Les indications d'utilisation des solutions de dextrane sont limitées par la fréquence élevée des réactions allergiques, l'impact négatif sur le système hémostatique, la libération de facteur de von Willebrand, l'induction de la cascade pro-inflammatoire et l'absence d'impact sur les propriétés rhéologiques du sang aux doses utilisées. La perfusion de dextrane dans des conditions de perméabilité capillaire accrue peut entraîner le développement du syndrome de dextrane, accompagné d'OL, d'une altération des fonctions hépatique et rénale et de l'apparition d'une coagulopathie. Les solutions de gélatine ne sont pas non plus destinées au traitement par perfusion du SHO.
En cas d'hypoprotéinémie inférieure à 25 g/l, une solution d'albumine à 20 % est utilisée, le volume quotidien étant de 3 ml/kg. Il est recommandé d'utiliser exclusivement une solution d'albumine à 20 %, car la pression oncotique d'une solution à 20 % est d'environ 100 mm Hg et celle d'une solution à 5 % d'environ 20 mm Hg. Dans des conditions de forte perméabilité de l'endothélium vasculaire, la perfusion d'une solution d'albumine à 5 %, contrairement à une solution à 20 %, entraîne un échange plus intense avec le pool extravasculaire et une forte augmentation de la pression oncotique dans l'interstitium, ce qui entraîne une augmentation de l'hyperhydratation interstitielle des poumons.
Les diurétiques sont justifiés en cas d'oligurie, d'œdème périphérique, atteignant des valeurs d'hématocrite de 36 à 38 %. Une prescription prématurée ou excessive de diurétiques peut aggraver l'hypovolémie et l'hémoconcentration, augmentant ainsi le risque de complications thrombotiques. Le furosémide est principalement utilisé: 20 à 40 mg par voie intramusculaire unique ou par voie intraveineuse lente pendant 1 à 2 minutes.
Principes de la thérapie par perfusion pour le syndrome d'hyperstimulation ovarienne
Après l'administration de la dose initiale de solutions cristalloïdes et colloïdales, le volume de perfusion supplémentaire est déterminé en tenant compte des paramètres suivants: diurèse inférieure à 1 ml/(kg·h), hématocrite inférieur à 40 %, pression artérielle moyenne supérieure à 70 mm Hg, pression veineuse centrale de 8 à 10 mm H2O. Une fois ces paramètres atteints, le traitement par perfusion est arrêté. Il est conseillé d'administrer le volume quotidien total de solutions pour perfusion par fractions tout au long de la journée. Le non-respect de ces recommandations entraîne une hémodilution, provoquant une accumulation rapide de liquide dans les cavités séreuses et une aggravation de l'état de la patiente. Une erreur fréquente dans le traitement des femmes atteintes de SHO est la prolongation injustifiée du traitement par perfusion alors que les paramètres hémodynamiques sont normalisés et la tentative d'enrayer complètement l'évolution du SHO en tant que maladie iatrogène.
Étape 3 - prévention des complications
Prévention de la thrombose et de la thromboembolie
La prévention des complications thrombotiques du syndrome d'hyperstimulation ovarienne repose sur l'élimination de l'hémoconcentration. Un traitement antithrombotique est indiqué dès l'apparition de signes biologiques d'hypercoagulation. L'HBPM est utilisée à cet effet:
- nadroparine calcique (dose quotidienne - 100 UI anti-Xa/kg 2 fois par voie sous-cutanée),
- daltéparine sodique (100-150 UI anti-Xa/kg 2 fois par voie sous-cutanée),
- énoxaparine sodique (1 ml/kg/jour) 1 à 2 fois par voie sous-cutanée).
Surveillance biologique: détermination de l’activité anti-Xa plasmatique 3 heures après l’administration d’HBPM, ce qui permet de maintenir une dose efficace dans la fourchette thérapeutique et de minimiser ainsi le risque de saignement. Le traitement antithrombotique est poursuivi jusqu’à normalisation des paramètres de coagulation sanguine. La surveillance est réalisée par la détermination quantitative de la concentration plasmatique de D-dimères. La durée d’administration d’HBPM est déterminée individuellement et peut, dans certains cas, dépasser 30 jours.
Prévention des complications infectieuses
Compte tenu de l'effet positif de la prescription d'immunoglobulines dans la prévention des infections secondaires d'autres maladies accompagnées de pertes protéiques, on peut s'attendre à l'efficacité de ce traitement chez les patients atteints de SHO. Cependant, pour confirmer ou réfuter définitivement cette hypothèse du point de vue de la médecine factuelle, des études sont nécessaires. Actuellement, l'indication d'un traitement antibactérien empirique est le risque d'infection secondaire chez les patients en état critique ou présentant une hémodynamique instable. Le médicament choisi empiriquement est modifié en fonction des résultats des analyses bactériologiques. Lors de la prescription d'un traitement antibactérien empirique, il est nécessaire de se baser sur les informations relatives à la gravité de la maladie, aux facteurs de risque d'infection et aux caractéristiques de la résistance aux antibiotiques dans l'unité de soins intensifs concernée.
Soutien nutritionnel
Il est administré per os à tous les patients atteints de SHO sévère et critique. Il est nécessaire de suivre les recommandations suivantes:
- valeur énergétique 25-35 kcal/(kgxjour),
- glucose - moins de 6 g/(kg x jour),
- lipides - 0,5-1 g/(kg x jour),
- protéines - 1,2-2 g/(kg x jour),
- apport quotidien standard de microéléments et de vitamines.
Étape 4 - méthodes chirurgicales
Indications de la laparocentèse chez les femmes atteintes du syndrome d’hyperstimulation ovarienne:
- ascite tendue progressive,
- oligurie inférieure à 0,5 ml/jkg/min),
- une augmentation de la concentration de créatinine supérieure à 80 μmol/l ou une diminution de sa clairance,
- hémoconcentration avec une valeur d'hématocrite supérieure à 40 %, non susceptible de correction médicamenteuse.
La laparocentèse peut être réalisée par voie transabdominale ou transvaginale. L'hypertrophie ovarienne peut engendrer des difficultés techniques, d'où l'importance cruciale du contrôle échographique. Le drainage abdominal prolongé (laparocentèse transabdominale), d'une durée de 14 à 30 jours, avec prélèvement fractionné du transsudat péritonéal à l'aide d'un cathéter apyrogène cystoFix®, présente de nombreux avantages: il permet d'éviter l'évacuation ponctuelle d'un volume important de transsudat péritonéal et ainsi d'éliminer les fluctuations brutales de la pression intra-abdominale responsables de troubles hémodynamiques, de stabiliser l'état de la patiente et d'éviter les ponctions répétées de la cavité abdominale pour éliminer le liquide d'ascite chez cette catégorie de patientes. Le volume total de liquide d'ascite évacué lors du traitement d'un SHO sévère peut varier de 30 à 90 litres.
Chez les patientes présentant un hydrothorax sur fond de syndrome d'hyperstimulation ovarienne, une attitude attentiste est justifiée. En cas d'hydrothorax, une ponction de la cavité pleurale n'est pratiquée qu'en cas d'insuffisance respiratoire progressive sévère.
Critères d'initiation de l'assistance respiratoire dans le syndrome d'hyperstimulation ovarienne sévère et critique:
- absence de respiration spontanée et rythmes respiratoires pathologiques,
- diminution de l'index respiratoire à moins de 200 mm Hg,
- arythmies cardiaques potentiellement mortelles,
- tachycardie persistante supérieure à 120,
- hypotension sévère,
- tachypnée après 40 ans,
- atteinte des muscles respiratoires accessoires.
En cas de développement d'un SDRA et de transfert vers la ventilation mécanique, les éléments suivants sont utilisés:
- petits volumes respiratoires (6 ml/kg),
- pression inspiratoire < 30 cm H2O,
- PEEP (>10 cm H2O),
- La manœuvre de recrutement alvéolaire est utilisée.
Le traitement chirurgical du syndrome d'hyperstimulation ovarienne n'est justifié qu'en cas de pathologie aiguë de torsion de l'appendice, de rupture du kyste ovarien ou de saignement du kyste ovarien. En cas de torsion ovarienne, la détorsion ovarienne par laparoscopie est la plus efficace. Une erreur thérapeutique fréquente chez les patientes atteintes d'un SHO non compliqué est la chirurgie d'urgence et la résection d'environ 30 à 50 % du tissu ovarien, ou une ovariectomie bilatérale.

