Expert médical de l'article
Nouvelles publications
Malaria
Dernière revue: 04.07.2025

Tout le contenu iLive fait l'objet d'un examen médical ou d'une vérification des faits pour assurer autant que possible l'exactitude factuelle.
Nous appliquons des directives strictes en matière d’approvisionnement et ne proposons que des liens vers des sites de médias réputés, des instituts de recherche universitaires et, dans la mesure du possible, des études évaluées par des pairs sur le plan médical. Notez que les nombres entre parenthèses ([1], [2], etc.) sont des liens cliquables vers ces études.
Si vous estimez qu'un contenu quelconque de notre contenu est inexact, obsolète ou discutable, veuillez le sélectionner et appuyer sur Ctrl + Entrée.
Le paludisme (malaria en anglais; paludisme en français) est une maladie protozoaire transmissible anthroponotique aiguë avec un mécanisme d'infection transmissible, caractérisée par des symptômes prononcés d'intoxication, une évolution cyclique avec alternance de crises de fièvre et de périodes d'apyrexie, une hypertrophie de la rate et du foie, le développement d'une anémie hémolytique avec une évolution progressive et des rechutes de la maladie.
Épidémiologie
La source de l'agent infectieux est une personne malade ou un porteur de parasite dont le sang contient des gamétocytes. Le paludisme est une infection transmissible par piqûre de moustique. Les gamétocytes de P. vivax, P. ovale et P. malariae sont présents dans le sang dès les premiers jours de la maladie; leur nombre augmente après plusieurs cycles de schizogonie érythrocytaire. En cas d'infection par P. falciparum, une personne devient une source d'infection 10 à 12 jours après le début de la parasitémie et peut le rester pendant deux mois ou plus.
Dans le cas du paludisme, différents mécanismes de transmission de l’infection sont possibles:
Mécanisme de transmission (piqûre de moustique)
Ce mécanisme est le principal, assurant l'existence des plasmodes en tant qu'espèce biologique. La source de l'infection est une personne (maladie de paludisme ou porteur du parasite), dont le sang contient des gamétocytes matures (cellules reproductrices mâles et femelles du parasite). Les porteurs du paludisme sont uniquement les moustiques femelles du genre Anopheles.
Dans l'estomac du moustique, où les gamétocytes mâles et femelles contenus dans les érythrocytes pénètrent avec le sang, leur maturation ultérieure (après la lyse des érythrocytes), leur fusion et leur division multiple se produisent avec formation de sporozoïtes, qui s'accumulent dans les glandes salivaires du moustique. Les formes asexuées du parasite (trophozoïtes, schizontes), une fois entrées dans l'estomac du moustique, meurent.
Ainsi, dans le corps humain, une voie asexuée de développement du parasite (schizogonie) se produit avec la formation et l'accumulation de gamétocytes, et dans le corps du moustique, une voie sexuelle (sporogonie) se produit, la fusion des gamétocytes mâles et femelles avec leur développement ultérieur et la formation de sporozoïtes.
 [ 4 ], [ 5 ], [ 6 ], [ 7 ], [ 8 ], [ 9 ]
[ 4 ], [ 5 ], [ 6 ], [ 7 ], [ 8 ], [ 9 ]
Mécanisme de transmission verticale
Transmission verticale (de la mère au fœtus) ou de la mère au nouveau-né (pendant l'accouchement – mécanisme parentéral). En cas de transmission verticale, le fœtus est rarement infecté par le placenta. Le plus souvent, l'infection survient lors de l'accouchement, lorsqu'une certaine quantité de sang maternel pénètre dans la circulation sanguine du nouveau-né, dont les érythrocytes contiennent des formes asexuées du parasite.
Mécanisme de transmission parentérale
Le mécanisme parentéral d'infection conduit au développement du paludisme dit schizonte. Il survient lors de transfusions sanguines ou, plus rarement, lors de violations de l'asepsie lors d'injections (par exemple, chez des toxicomanes utilisant la même seringue). En cas d'infection lors d'une transfusion sanguine, la source de l'infection est un donneur porteur du parasite, souvent atteint d'une parasitémie sublatente (le nombre de parasites est inférieur à cinq dans un μl de sang). Par conséquent, dans les régions du monde où le paludisme est endémique, il est nécessaire d'utiliser, outre les méthodes parasitologiques (détection du parasite dans les préparations en gouttes épaisses et les frottis sanguins), des méthodes sérologiques (immunologiques) de diagnostic en laboratoire du paludisme (RNIF, ELISA, etc.) pour contrôler le sang des donneurs. Étant donné qu'avec une infection parentérale, seuls quelques parasites sont généralement introduits (en particulier avec des injections), la période d'incubation peut être prolongée jusqu'à 3 mois (avec une infection massive, la période d'incubation, au contraire, peut être très courte - plusieurs jours), ce qui est important à savoir lors du diagnostic du paludisme chez les patients ayant subi une intervention chirurgicale et les toxicomanes.
Conditions de propagation du paludisme
Pour que le paludisme se propage dans une certaine région (pays, territoire, zone), les conditions suivantes sont nécessaires:
- Source d’infection (un patient atteint de paludisme ou porteur de parasites).
- Présence d'un vecteur efficace (moustiques du genre Anophèles). La sensibilité aux parasites du paludisme est la principale caractéristique d'une espèce spécifique de moustiques du genre Anophèles. Le nombre de moustiques du genre Anophèles parmi les populations d'autres espèces est inférieur à celui des moustiques non porteurs du paludisme, et leurs piqûres sont rarement gênantes. Cependant, même de petites espèces, dans d'autres circonstances favorables (proximité des gîtes larvaires des moustiques et des habitations humaines), peuvent jouer un rôle important. Plus de 70 espèces de moustiques du genre Anophèles (sur plus de 200 espèces connues) peuvent être des vecteurs efficaces du paludisme.
- Conditions climatiques favorables: température moyenne quotidienne de l’air supérieure à 16 °C et présence de sites de reproduction pour les moustiques: plans d’eau, réservoirs, ouvrages d’irrigation, etc. La température moyenne quotidienne minimale requise pour le développement du moustique Pl. vivax est de 16 °C, contre 18 °C pour Pl. falciparum. À une température inférieure, la sporogonie ne se produit pas. La durée de la sporogonie est d’autant plus courte que la température est élevée (jusqu’à un certain niveau, car une température moyenne quotidienne de 30 °C et plus est défavorable à la sporogonie). À une température moyenne quotidienne optimale (25-26 °C), la sporogonie dure 8 à 9 jours chez Pl. vivax et 10 à 11 jours chez Pl. falciparum.
L'ensemble de l'aire de répartition du paludisme sur le globe (de 45° N et 40° S à 64° N et 45° S selon les années) est occupé par le paludisme à vivax. Les zones de paludisme à falciparum et à malariae malariae sont légèrement plus petites en raison de la température plus élevée requise pour une sporogonie efficace; l'aire de répartition du paludisme ovale est située dans deux régions qui ne sont pas reliées territorialement: l'Afrique tropicale et les États de la partie occidentale de l'océan Pacifique (Indonésie, Vietnam, Philippines, Nouvelle-Guinée, etc.). Dans les pays montagneux, des foyers de paludisme peuvent se former à des altitudes allant jusqu'à 1 000 m dans la zone climatique tempérée et jusqu'à 1 500-2 500 m dans la zone subtropicale et tropicale, les foyers de paludisme à vivax uniquement se produisant à haute altitude (1 000-1 500 m et plus).
Le paludisme se caractérise par une saisonnalité marquée. Dans les climats tempérés et subtropicaux, la saison du paludisme est divisée en périodes d'infestation active par les moustiques, de transmission de l'infection et de manifestations massives de la maladie. Le début de la période d'infestation active par les moustiques (en présence d'une source d'infection – patients, porteurs du parasite) coïncide avec une augmentation stable de la température moyenne quotidienne à 16 °C. Le début de la période de transmission est associé à la fin de la sporogonie dans le corps du moustique, qui dépend des températures moyennes quotidiennes spécifiques d'une année donnée. Dans la région de Moscou, la période de transmission du paludisme à vivax peut atteindre 1,5 à 2 mois, voire plus, jusqu'aux premières gelées d'automne. Les limites de la période de manifestations massives sont moins définies. Dans les foyers où le paludisme ne se transmet que sur trois jours, la morbidité massive peut débuter bien avant le début de la période de transmission. Les cas observés sont des manifestations primaires du paludisme à vivax avec une longue période d'incubation (3 à 10 mois) en raison d'une infection au cours de la saison précédente et de la préservation des hypnozoïtes dans le foie (sans manifestations primaires avec une courte période d'incubation), ainsi que des rechutes exoérythrocytaires à distance (après une série d'attaques de paludisme avec une courte période d'incubation au cours de la saison précédente, sans traitement anti-rechute adéquat).
La sensibilité au paludisme est universelle. L'issue de l'infection après la pénétration de l'agent pathogène dans la circulation sanguine et l'évolution clinique de la maladie sont déterminées par le statut immunologique individuel, l'activité des facteurs de résistance innée non spécifiques, l'intensité de l'immunité post-infection et, chez les nouveau-nés, par le taux d'anticorps spécifiques de classe G reçus de la mère. Les populations autochtones d'Afrique de l'Ouest et de Nouvelle-Guinée font exception: elles sont majoritairement immunisées contre l'infection par Pl. vivax, ce qui est dû à l'absence génétiquement déterminée d'isoantigènes érythrocytaires du groupe Duffy, récepteurs des mérozoïtes de Pl. vivax. Par conséquent, dans cette région, les cas d'infection par le paludisme à Pl. vivax sont nettement moins fréquents que dans d'autres régions d'Afrique tropicale.
Les personnes porteuses d'hémoglobine anormale (thalassémie, drépanocytose, hémoglobine E, C, etc.), présentant des anomalies de la structure du cytosquelette érythrocytaire (sphérocytose héréditaire, ovalocytose du Sud-Est, elliptocytose héréditaire) ou présentant un déficit en glucose-6-phosphate déshydrogénase des érythrocytes présentent une résistance relative à l'infection par tous les types de plasmodes. En cas d'infection palustre, la maladie est bénigne, le nombre de parasites dans le sang reste relativement faible et les cas de progression maligne (neuralpaludisme - falciparum) sont pratiquement absents. En revanche, les personnes présentant un déficit en glucose-6-phosphate déshydrogénase présentent un risque d'hémolyse aiguë lors de l'utilisation de certains antipaludiques (primaquine, quinine, etc.). Les mécanismes de résistance naturelle aux différents types de paludisme restent encore largement obscurs et font l'objet d'études.
Les nouveau-nés présentent également une certaine résistance à l'infection par toutes les formes de paludisme. Cela est dû à:
- la présence d’une immunité passive due aux anticorps de classe G reçus par le nouveau-né d’une mère hyperimmune (dans les zones à forte incidence de paludisme);
- maintien d'une immunité spécifique après la naissance grâce aux anticorps de classe A reçus par le nouveau-né avec le lait maternel;
- la présence d'hémoglobine fœtale chez le nouveau-né, qui est peu utile pour nourrir le parasite du paludisme.
Après les trois à six premiers mois de vie, les nouveau-nés présentent un risque significativement accru de développer des formes graves et malignes de paludisme à falciparum (changement des globules rouges contenant de l'hémoglobine fœtale en globules rouges contenant de l'hémoglobine normale; transition vers une alimentation mixte - apport d'acide para-aminobenzoïque, nécessaire au développement du parasite, qui est absent dans le lait maternel).
 [ 10 ], [ 11 ], [ 12 ], [ 13 ]
[ 10 ], [ 11 ], [ 12 ], [ 13 ]
L'immunité contre le paludisme
L'immunité contre le paludisme est non stérile, spécifique à l'espèce et à la souche, instable et de courte durée. Pour maintenir le niveau protecteur d'anticorps, une stimulation antigénique constante, sous forme d'infections paludéennes répétées, est nécessaire. L'immunité contre Pl. malariae et Pl. vivax s'établit plus tôt et se maintient plus longtemps que contre Pl. falciparum. L'immunité antipaludique comprend des réponses cellulaires et humorales. Les processus immunitaires qui stimulent la synthèse des anticorps commencent par la phagocytose des parasites du paludisme par les macrophages. Cela se manifeste par une hyperplasie du système histiophagocytaire de la rate, du foie et de la moelle osseuse.
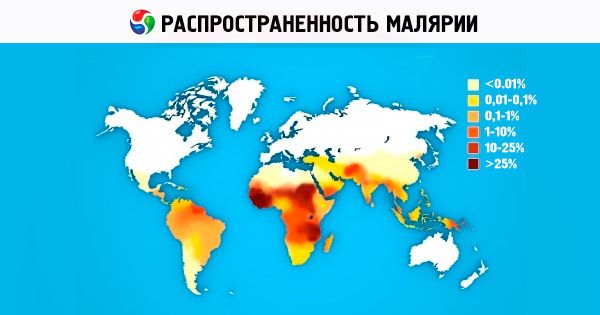
Prévalence du paludisme
Parmi les quatre espèces d'agents pathogènes du paludisme humain, P. vivax est la plus répandue au monde. Dans les régions subtropicales et tropicales, les sporozoïtes prédominent dans le patrimoine génétique de la population de P. vivax. Ils provoquent la maladie après une courte incubation (10 à 21 jours). Sur le continent africain, P. vivax est constamment présent dans les pays d'Afrique de l'Est, chez les Arabes, les Indiens, les Éthiopiens et les Européens. En Afrique de l'Ouest, principalement peuplée de représentants de la race négroïde, P. vivax est absent, ce qui s'explique par l'immunité innée génétiquement déterminée des Noirs africains contre P. vivax [les érythrocytes sont dépourvus de récepteur pour les mérozoïtes de P. vivax – isoantigènes de Duffy (Fy d ou Fy b )]. L'aire de répartition de P. ovale est limitée et se compose de deux parties. La principale partie africaine occupe l'Afrique tropicale, de la Gambie au nord au Congo au sud du continent. La deuxième partie de l'aire de répartition comprend les pays de l'océan Pacifique occidental et de l'Asie du Sud-Est. L'aire de répartition géographique du paludisme tropical s'étend de 40° de latitude nord à 20° de latitude sud. P. falciparum est responsable de jusqu'à 50 % des cas de paludisme dans le monde. Le paludisme de quatre jours est actuellement présent en Afrique, dans certaines régions d'Amérique centrale et d'Amérique du Sud, ainsi que dans les Caraïbes et en Asie du Sud-Est.
La plupart des populations sont sensibles au paludisme. Les populations autochtones d'Afrique de l'Ouest font exception. Les zones hyperendémiques d'Afrique tropicale, où P. falciparum prédomine, se caractérisent par une structure immunitaire relativement stable de la population autochtone:
- Les enfants de moins de 6 mois ne tombent pas malades grâce à l’immunité passive reçue de la mère:
- La plupart des enfants âgés de 6 à 24 mois sont infectés par P. falciparum; l’immunité passive s’est estompée, l’immunité active ne s’est pas encore développée; ce groupe présente la mortalité la plus élevée due au paludisme:
- Chez les enfants de plus de 2 ans, P. falciparum est détecté moins fréquemment, l’évolution du paludisme est atténuée grâce à l’immunité acquise et l’intensité de la parasitémie diminue avec l’âge:
- Chez l'adulte, P. falciparum est rarement détecté en raison d'une tension immunitaire élevée; en cas d'infection, il n'y a pas de manifestations cliniques.
Le paludisme tropical est également facilement toléré par les porteurs d’hémoglobine S anormale (anémie falciforme) et les personnes présentant certaines autres anomalies génétiquement déterminées de l’hémoglobine et des enzymes des globules rouges (déficit en G-6-PDH).
Histoire de la recherche sur le paludisme
L'étude du paludisme (l'une des plus anciennes maladies humaines) est inextricablement liée à l'histoire de la civilisation humaine. On suppose que le paludisme a commencé à se propager sur Terre (depuis la région africaine méditerranéenne) il y a environ 10 000 ans, en raison du développement intensif de l'agriculture, du commerce et de l'exploration de nouvelles terres. Dans les papyrus égyptiens anciens, la littérature chinoise ancienne et les canons de la médecine classique indienne (Ayurveda), des descriptions du tableau clinique et des épidémies de paludisme ont survécu jusqu'à nos jours; déjà à cette époque, des hypothèses étaient émises quant à un lien possible entre le développement de la maladie et les piqûres de moustiques. Plus tard (Ve-VIe siècles av. J.-C.), des médecins grecs anciens: Hippocrate, Héradote et Empédocle ont décrit en détail le tableau clinique du paludisme. Hippocrate est crédité d'avoir distingué le paludisme du groupe des maladies fébriles: il a proposé de distinguer trois formes de la maladie: « quotidienne » (crises quotidiennes), « tertiaire » (crises tous les deux jours) et « quartan » (crises tous les deux jours).
Le début des découvertes scientifiques dans l'étude du paludisme remonte à 1640, lorsque le médecin et conquistador espagnol Juan del Vego utilisa pour la première fois une infusion d'écorce de quinquina pour traiter les patients atteints de paludisme, auparavant utilisée par les Indiens du Pérou et d'Équateur comme antipyrétique. Le nom de « malaria » (en italien: « mal aria » – « mauvais air ») fut donné à la maladie par l'Italien Lancisi (1717), qui associa l'infection des personnes au paludisme par les vapeurs « toxiques » des marais. En 1880, le médecin français A. Laveran, travaillant en Algérie, décrivit en détail la morphologie de l'agent pathogène du paludisme. En 1897, le médecin militaire anglais Ronald Ross, en Inde, établit le mécanisme de transmission du paludisme.
Actuellement, le paludisme est l'un des problèmes de santé les plus graves dans plus de 100 pays d'Afrique, d'Asie et d'Amérique du Sud. Environ la moitié de la population mondiale est exposée au risque de contracter le paludisme. Presque tous les pays d'Europe et d'Amérique du Nord enregistrent chaque année des centaines de cas importés de paludisme parmi les personnes arrivant de régions où il est répandu, et le nombre de cas de paludisme d'aéroport est en augmentation. Selon l'OMS, 200 à 250 millions de personnes dans le monde contractent le paludisme chaque année, et au moins 80 % des cas sont enregistrés dans les pays africains situés au sud du Sahara. Chaque année, 1 à 2 millions de personnes meurent du paludisme, principalement des enfants de moins de 5 ans. Les pertes sociales et économiques, rien qu'en Afrique, sont estimées à 2 milliards de dollars américains par an. Depuis 1998, sous l'égide de l'OMS, de la Banque mondiale et de l'UNICEF, un programme scientifique et pratique (Initiative Faire reculer le paludisme) de lutte contre le paludisme (principalement dans les pays en développement) a été mis en œuvre. Ce programme est prévu pour la période 2010-2015. Les recherches visant à créer un vaccin antipaludique efficace sont en cours, mais cela nécessitera au moins 10 à 15 ans supplémentaires. La recherche, le développement et l'amélioration de médicaments contre le paludisme constituent l'un des programmes prioritaires de l'OMS, de diverses sociétés pharmaceutiques et d'instituts de recherche du monde entier. Ces dernières années, la Russie a constaté une augmentation des cas importés de paludisme en raison de l'augmentation des migrations et du développement intensif du tourisme international.
Causes malaria
Le nom de la maladie « paludisme » généralise en fait quatre maladies protozoaires distinctes causées respectivement par quatre types d’agents pathogènes.
Le paludisme est causé par des parasites appartenant au type Protozoaires, à la classe des Sporozoaires, à la famille des Plasmodiidae et au genre Plasmodium. Quatre types de pathogènes parasitent l'homme: P. vivax, responsable du paludisme de trois jours, P. malariae, responsable du paludisme de quatre jours, P. falciparum, responsable du paludisme tropical; P. ovale, responsable du paludisme ovale de trois jours.
Agents pathogènes du paludisme
Excitateur |
Forme de paludisme (selon la CIM-10) |
Plasmodium (Laverania) falciparum |
Paludisme causé par Plasmodium falciparum (paludisme à falciparum) |
Plasmodium (Plasmodium) vivax |
Paludisme causé par Plasmodium vivax (malaria-vivax) |
Plasmodium (Plasmodium) ovale |
Paludisme causé par Plasmodium ovale (malaria-ovale) |
Plasmodium (Plasmodium) paludisme |
Paludisme causé par Plasmodium malariae (malaria-malariae) |
Dans la plupart des publications nationales (manuels, manuels, ouvrages de référence), les anciens noms des formes de paludisme sont conservés: paludisme tropical (malaria-falciparum), paludisme de trois jours (malaria-vivax), paludisme ovale (malaria-ovale) et paludisme de quatre jours (malaria-malariae).
Chacune des quatre formes de paludisme présente ses propres caractéristiques cliniques, pathogéniques et épidémiologiques. La forme la plus répandue est le paludisme à falciparum, responsable de 80 à 90 % des cas de paludisme dans le monde. Son agent pathogène appartient à un sous-genre particulier (Laverania). Seul le paludisme à falciparum peut évoluer vers une forme maligne et entraîner une issue fatale.
Au cours de leur cycle de vie, les agents pathogènes du paludisme subissent le cycle de développement suivant avec un changement d’hôtes:
- le développement asexué (schizogonie) se produit dans le corps de l'hôte intermédiaire - un humain;
- Le développement sexuel (sporogonie) se produit dans le corps de l'hôte final - le moustique femelle du genre Anopheles.
Les sporozoïtes pénètrent dans l'organisme humain par la piqûre d'un moustique porteur du paludisme. Après avoir pénétré dans la circulation sanguine, les sporozoïtes pénètrent dans les hépatocytes à partir des vaisseaux sinusoïdaux du foie en 15 à 45 minutes et entament le cycle exoérythrocytaire (schizogonie tissulaire). La sélectivité et la rapidité de l'invasion sont dues à la présence de récepteurs spécifiques sur les membranes des hépatocytes. Les parasites grossissent, se divisent à plusieurs reprises et forment de nombreuses petites formations mononucléaires, les mérozoïtes. La durée minimale du cycle exoérythrocytaire est de 5 à 7 jours pour P. falciparum, 6 à 8 jours pour P. vivax, 9 jours pour P. ovale et 14 à 16 jours pour P. malariae. Les mérozoïtes quittent ensuite les hépatocytes pour passer dans la circulation sanguine et pénètrent dans les érythrocytes, où se produit la schizogonie érythrocytaire. Le paludisme de trois jours et le paludisme ovale se caractérisent par un type particulier de développement exoérythrocytaire: tous les parasites, ou certains d'entre eux, peuvent rester longtemps (7 à 14 mois, voire plus) dans les hépatocytes à l'état dormant (hypnozoïtes), et ce n'est qu'après cette période qu'ils commencent à se transformer en mérozoïtes capables d'infecter les érythrocytes. Ceci entraîne donc une incubation prolongée et la survenue de rechutes à distance pouvant durer jusqu'à trois ans.
La schizogonie érythrocytaire s'accompagne d'un développement cyclique et de multiples divisions des parasites, les plasmodes paludéens passant par les stades suivants: jeune trophozoïte (en forme d'anneau); trophozoïte en développement; trophozoïte mature (à gros noyau); schizonte en développement; schizonte mature. Une fois le processus de schizogonie terminé, l'érythrocyte est détruit. Les mérozoïtes libres pénètrent activement dans les nouveaux érythrocytes, mais la plupart d'entre eux meurent sous l'effet des mécanismes immunitaires protecteurs de l'hôte. La durée de la schizogonie érythrocytaire est de 48 heures chez P. vivax, P. ovale, P. falciparum et de 72 heures chez P. malae. Au cours du cycle érythrocytaire, certains mérozoïtes se transforment en formes sexuées – femelles (macrogamétocytes) ou mâles (microgamétocytes).
Les gamétocytes pénètrent dans l'organisme du moustique porteur lorsqu'il se nourrit du sang d'un patient atteint de paludisme ou d'un parasite. Ils contiennent des gamétocytes matures. Dans l'estomac du moustique, après 9 à 12 minutes, le gamétocyte mâle éjecte huit flagelles mobiles et fins. Les flagelles libres (microgamètes) pénètrent dans la cellule femelle (macrogamète); après la fusion des noyaux, un zygote se forme, une cellule fécondée ronde. Ensuite, des ookinètes, des oocystes contenant des sporozoïtes, se développent successivement; leur maturation a lieu dans les glandes salivaires du moustique. À une température ambiante optimale (25 °C), la sporogonie dure 10 jours chez P. vivax, 12 jours chez P. falciparum, 16 jours chez P. malae et P. ovale; à une température inférieure à 15 °C, les sporozoïtes ne se développent pas.
Pathogénèse
Tous les symptômes du paludisme sont causés par une schizogonie érythrocytaire, c'est-à-dire la croissance et la reproduction de formes érythrocytaires asexuées du parasite dans le sang. La schizogonie tissulaire ne se manifeste pas cliniquement.
Une crise de paludisme est associée à l'achèvement de la schizogonie érythrocytaire, à la désintégration massive des érythrocytes et à la pénétration dans le sang d'un grand nombre de mérozoïtes, produits métaboliques des parasites aux propriétés pyrogènes et toxiques, provoquant le développement d'une réaction fébrile. En raison du caractère cyclique de la schizogonie érythrocytaire, les crises fébriles se répètent toutes les 48 heures dans le paludisme de trois jours, ovale et tropical, et toutes les 72 heures dans le paludisme de quatre jours. Lorsqu'une personne est infectée, une population hétérogène de parasites paludéens pénètre dans l'organisme, et la schizogonie initiale se produit de manière asynchrone, ce qui peut entraîner une irrégularité du type de fièvre. À mesure que les réactions immunitaires se développent, la capacité à parasiter les érythrocytes est préservée dans une génération principale de plasmodes, ce qui détermine le rythme fébrile caractéristique de cette espèce. Seul le paludisme tropical peut comporter plusieurs (2-3) générations principales de plasmodes, ce qui explique souvent l'irrégularité de la fièvre.
L'anémie, caractéristique du paludisme, résulte de la destruction des globules rouges par les parasites qui y sont présents. On sait que P. vivax et P. ovale pénètrent principalement dans les globules rouges jeunes, tandis que P. malariae pénètre dans les globules rouges matures. P. falciparum infecte les globules rouges de différents degrés de maturité, ce qui contribue à leur dégradation et à leur hémolyse. Par conséquent, dans le paludisme tropical, l'hémolyse joue un rôle majeur dans la genèse de l'anémie. D'autres facteurs d'hémolyse des globules rouges sont également des mécanismes auto-immuns qui endommagent les globules rouges non infectés. L'hyperplasie des éléments réticulo-endothéliaux de la rate, qui se développe dans le paludisme, inhibe l'hématopoïèse, ce qui aggrave l'anémie et la thrombocytopénie.
L'hypertrophie du foie et de la rate est initialement causée par une congestion des organes, mais une hyperplasie lymphoïde et réticulo-endothéliale apparaît rapidement. L'hémolyse des érythrocytes et les lésions des hépatocytes entraînent un ictère. Une diminution de l'absorption des glucides et une inhibition de la néoglucogenèse hépatique provoquent une hypoglycémie. L'activation de la glycolyse anaérobie entraîne une accumulation de lactate dans le sang et le liquide céphalorachidien, ainsi que l'apparition d'une acidose lactique, l'une des causes du paludisme tropical sévère.
Dans le paludisme tropical, les propriétés des érythrocytes changent, ce qui entraîne une perturbation de la microcirculation (cytoadhésion, séquestration, formation de rosettes). La cytoadhésion est l'adhésion d'érythrocytes infectés aux cellules endothéliales, responsable de la séquestration dans les capillaires et les veinules post-capillaires. Le rôle principal dans la cytoadhésion est attribué à des protéines ligands spécifiques (leur expression à la surface des érythrocytes est induite par le parasite) et à des récepteurs situés à la surface externe des cellules endothéliales. L'occlusion des vaisseaux sanguins provoque une ischémie des organes affectés. Des protubérances (boutons) apparaissent sur les membranes des érythrocytes, qui entrent en contact avec des excroissances en forme de pseudopodes formées sur les cellules endothéliales. Certaines variétés de P. falciparum provoquent l'adhésion d'érythrocytes sains à ceux infectés, entraînant la formation de « rosettes ». Les globules rouges se rigidifient, ce qui altère les propriétés rhéologiques du sang et aggrave les troubles de la microcirculation. L'hypoxie, causée par une fonction insuffisante de transport de l'oxygène des globules rouges infectés, constitue un facteur préjudiciable important. Le tissu cérébral est le moins résistant à l'hypoxie, ce qui contribue au développement du neuropaludisme. Des troubles de la coagulation sanguine apparaissent: en cas de paludisme tropical sévère, on observe des signes de syndrome de coagulation intravasculaire disséminée (CIVD), de thrombocytopénie et d'hypofibrinogénémie. La réaction inflammatoire généralisée non spécifique joue un rôle important dans la pathogenèse du paludisme tropical. Les lésions vasculaires sont principalement causées par l'action de médiateurs inflammatoires, dont les plus actifs sont les produits de peroxydation lipidique et les protéases sécrétées par les granulocytes. Dans la pathogenèse du paludisme sévère, une attention particulière est portée aux cytokines, en particulier au TNF et à l'IL-2 et à l'IL-6. Les modifications les plus caractéristiques du paludisme tropical sévère se produisent au niveau du cerveau, où l'on observe un œdème, un gonflement de la substance cérébrale et des excroissances périvasculaires et périganglionnaires de la névroglie (granulomes de Durk). Les capillaires sont obstrués par des érythrocytes envahis et des parasites; une hémostase importante est observée. Un œdème périvasculaire avec hémorragies et nécrose focale se développe. Le tableau anatomopathologique permet de conclure qu'en cas de coma paludéen, une méningo-encéphalite spécifique se développe.
L'infection palustre peut perturber la réponse immunitaire de l'hôte, ce qui déclenche une cascade de réactions immunopathologiques. La fixation des immunoglobulines et du complément sur les membranes basales glomérulaires provoque une néphropathie aiguë. Le syndrome néphrotique, qui se développe chez les patients atteints d'un paludisme de quatre jours, est classé comme une glomérulopathie à complexes immuns.
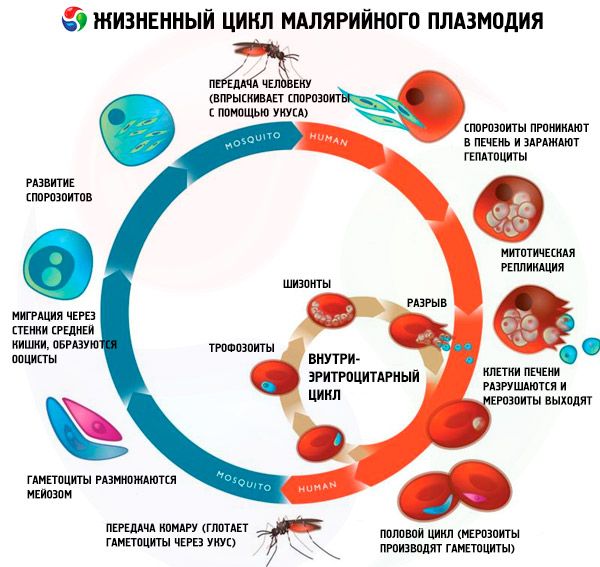
Cycle de vie de tous les agents pathogènes du paludisme
Le cycle de vie de tous les agents pathogènes du paludisme comprend deux hôtes: l’homme (schizogonie - cycle de développement asexué) et les moustiques du genre Anopheles (sporogonie - cycle de développement sexuel).
Traditionnellement, on distingue trois stades dans le cycle schizogonique de toutes les espèces de parasites du paludisme: la schizogonie exoérythrocytaire (EESh), la schizogonie érythrocytaire (ESH) et la gamétocytogonie. De plus, on distingue un stade distinct dans les cycles biologiques de Pl. vivax et Pl. ovale – l'hibernation – en raison de l'introduction possible d'un groupe morphologiquement hétérogène de sporozoïtes (tachysporozoïtes et bradysporozoïtes, ou seulement des bradysporozoïtes) dans le corps humain lors d'une piqûre de moustique. Dans ces cas, les bradysporozoïtes (hypnozoïtes) sont conservés dans les hépatocytes pendant une longue période à l'état inactif jusqu'à l'apparition de l'EES.
 [ 19 ], [ 20 ], [ 21 ], [ 22 ]
[ 19 ], [ 20 ], [ 21 ], [ 22 ]
Schizogone exoérythrocytaire
Les sporozoïtes introduits dans le corps humain par la salive de moustique pénètrent très rapidement (en 15 à 30 minutes) dans le foie par la circulation sanguine, où ils pénètrent activement les hépatocytes sans les endommager. Les sporozoïtes de Pl. falciparum, Pl. malariae et les tachysporozoïtes de Pl. vivax et Pl. ovale déclenchent immédiatement une EES avec la formation d'un grand nombre de mérozoïtes exoérythrocytaires (jusqu'à 40 000 à partir d'un sporozoïte dans le paludisme à falciparum). Les hépatocytes sont détruits et les mérozoïtes pénètrent à nouveau dans la circulation sanguine, puis rapidement (en 15 à 30 minutes) dans les érythrocytes. La durée de l'EES pour le paludisme à falciparum est généralement de 6 jours, pour le paludisme à vivax de 8 jours, pour le paludisme à ovafe de 9 jours et pour le paludisme à malariae de 15 jours.
 [ 23 ], [ 24 ], [ 25 ], [ 26 ], [ 27 ], [ 28 ], [ 29 ]
[ 23 ], [ 24 ], [ 25 ], [ 26 ], [ 27 ], [ 28 ], [ 29 ]
Stade dormant
Dans le paludisme à P. vivax et à P. ovale, les bradysporozoïtes ayant pénétré les hépatocytes se transforment en formes inactives – les hypnozoïtes – qui peuvent rester sans se diviser pendant plusieurs mois, voire plusieurs années, jusqu'à leur réactivation (division et formation de mérozoïtes). Ainsi, les hypnozoïtes sont associés à une longue incubation (jusqu'à 3 à 10 mois, voire plus) et au développement de rechutes exoérythrocytaires à distance, caractéristiques uniquement de ces formes de paludisme.
Schizogonymie érythrocytaire
Après l'introduction des mérozoïtes dans les érythrocytes, les parasites du paludisme passent successivement (cycliquement) par les stades suivants: trophozoïte (cellule mononucléaire se nourrissant), schizonte (cellule multinucléaire en division) et morula (parasites formés à l'intérieur de l'érythrocyte). Par la suite, après la destruction des érythrocytes, les mérozoïtes pénètrent dans le plasma sanguin. Le plus grand nombre de mérozoïtes filles se forme dans le paludisme tropical: jusqu'à 40 par érythrocyte. Le stade ES dure une durée strictement définie: 48 heures pour le paludisme à falciparum, à vivax et à ovale et 72 heures pour le paludisme à malariae.
Caractéristiques du cycle de schizogonie érythrocytaire et principaux mécanismes pathogéniques du développement des formes sévères et compliquées du paludisme à P. falciparum:
- accumulation (séquestration) d'érythrocytes envahis contenant des trophozoïtes adultes (du stade trophozoïte amiboïde), des schizontes dans les vaisseaux des organes internes, principalement le cerveau, ainsi que les reins, le foie, les intestins, la moelle osseuse, le placenta, etc.
- la formation de ce que l'on appelle des rosettes, constituées d'érythrocytes envahis et non infectés;
- développement de troubles de la microcirculation, hypoxie tissulaire, acidose métabolique (accumulation importante d'acide lactique);
- activation du MFS (principalement la réponse immunitaire Th-1) avec une synthèse accrue du facteur de nécrose tumorale-a, de l'interféron-y, de l'interleukine-1 et d'autres cytokines qui endommagent l'endothélium vasculaire et provoquent l'adhésion des érythrocytes à l'endothélium des vaisseaux sanguins.
Ces dernières années, le rôle particulier de la synthèse accrue d’oxyde nitrique (NO) par les cellules endothéliales vasculaires cérébrales dans le développement de la forme cérébrale du paludisme à falciparum a été étudié.
Un mécanisme physiopathologique important dans le développement des formes sévères de paludisme à falciparum, par rapport aux autres formes de paludisme, est l'hypoglycémie, qui aggrave les troubles microcirculatoires et métaboliques (acidose métabolique) chez les patients, en particulier les enfants et les femmes enceintes. Trois facteurs principaux sont à l'origine de l'hypoglycémie dans le paludisme à falciparum: une diminution de la glucogénèse hépatique, l'utilisation du glucose par les parasites et la stimulation de la sécrétion d'insuline. Parallèlement, l'hypoglycémie pourrait être la conséquence d'une hyperinsulinémie se développant après l'administration de quinine pour enrayer les crises de paludisme à falciparum.
En raison de la persistance prolongée du parasite (sans traitement adéquat) dans le paludisme-malariae, un syndrome néphrotique peut se développer à la suite d'un mécanisme immunitaire (dépôt de complexes immuns contenant des antigènes du parasite sur la membrane basale des glomérules rénaux).
Il convient de noter que les principales manifestations cliniques de toutes les formes de paludisme (intoxication, hypertrophie du foie et de la rate, anémie) sont associées au stade de schizogonie érythrocytaire (reproduction asexuée répétée des parasites dans les érythrocytes). Plus la teneur en parasites dans 1 μl de sang du patient, déterminée par microscopie sur goutte épaisse, est élevée, plus le paludisme est généralement grave. Par conséquent, lors du diagnostic en laboratoire du paludisme, il est important non seulement d'établir le type de plasmodium paludique, mais aussi de déterminer le niveau de parasitémie. Selon le niveau maximal de parasitémie, les formes de paludisme sont réparties par ordre décroissant: paludisme à falciparum (jusqu'à 100 000 μl ou plus), paludisme à vivax (jusqu'à 20 000 μl, plus rarement plus), paludisme ovale et paludisme à malariae (jusqu'à 10 000 à 15 000 μl). Dans le paludisme à falciparum, survenant avec un niveau élevé de parasitémie (100 000 par μl et plus), le risque de développer des complications graves et mortelles augmente considérablement, ce qui détermine la tactique d'un traitement antipaludique intensif (parentéral).
L'apparition de paroxysmes fébriles dans le paludisme est provoquée par l'hémolyse des érythrocytes, la libération de mérozoïtes dans le plasma, la destruction de certains d'entre eux (l'autre partie des mérozoïtes est à nouveau introduite dans les érythrocytes), l'activation du MFS et l'augmentation de la synthèse d'interleukine-1, -6, du facteur de nécrose tumorale a et d'autres pyrogènes endogènes (cytokines inflammatoires) qui affectent le centre de thermorégulation de l'hypothalamus.
En présence d'une génération de plasmodes dans le sang, des paroxysmes alternant régulièrement surviennent dès les premiers jours de la maladie. Souvent, en cas de paludisme à P. falciparum et à P. vivax (dans les régions hyperendémiques à transmission intensive du paludisme), les personnes non immunisées présentent une fièvre initiale associée au développement simultané de plusieurs générations d'agents pathogènes dans les érythrocytes des patients, avec des délais de fin de cycle de développement différents, ce qui entraîne une superposition des crises, un lissage de la période d'apyrexie et une distorsion du paroxysme typique.
Au fur et à mesure que la maladie se développe, les facteurs de défense spécifiques et non spécifiques augmentent (vers la fin de la 1ère ou 2ème semaine), certaines générations meurent et une (deux) générations principales de parasites subsistent avec le développement de paroxysmes typiques tous les deux jours (ou tous les jours).
L'hypertrophie du foie et de la rate dans toutes les formes de paludisme est associée à leur remplissage sanguin important, à un œdème et à une hyperplasie de l'articulation métastatique.
Le paludisme conduit généralement toujours à une anémie hémolytique hypochrome, dans la pathogenèse de laquelle un certain nombre de facteurs sont importants:
- hémolyse intravasculaire des érythrocytes infectés;
- phagocytose des érythrocytes infectés et non infectés par les cellules réticuloendothéliales de la rate;
- séquestration (accumulation) d'érythrocytes contenant des parasites matures dans la moelle osseuse, suppression de l'hématopoïèse;
- mécanisme immunitaire (destruction des érythrocytes non affectés suite à l'adsorption de complexes immuns contenant la fraction C-3 du complément sur la membrane érythrocytaire).
Le stade de gamétocytogonie est une sorte de ramification du stade ES. Certains mérozoïtes (un processus génétiquement déterminé), au lieu de répéter le cycle de développement asexué après leur introduction dans l'érythrocyte, se transforment en formes sexuées – les gamétocytes (mâles et femelles).
Caractéristiques du stade gamétocytogonial dans le paludisme à falciparum:
- les gamétocytes apparaissent dans le sang périphérique au plus tôt 10 à 12 jours après le début de la maladie;
- Les gamétocytes, s'accumulant au cours de la maladie, peuvent circuler dans la circulation sanguine pendant une longue période (jusqu'à 4 à 6 semaines ou plus).
Dans d'autres formes de paludisme (vivax, ovale, malariae), les gamétocytes peuvent être détectés dans le sang périphérique dès les premiers jours de la maladie et mourir rapidement (en quelques heures à quelques jours).
Symptômes malaria
Compte tenu des caractéristiques spécifiques des parasites du paludisme et des symptômes correspondants du paludisme, on distingue quatre formes de la maladie: le paludisme de trois jours (vivax-malaria, malaria tertiana), le paludisme de quatre jours (malaria quartana), le paludisme tropical (falciparum-malaria, malaria tropica), le paludisme ovale de trois jours (ovale-malaria).
L'évolution du paludisme primaire comprend la période initiale, le pic de la maladie et la guérison. Sans traitement ou avec un traitement étiotrope inadéquat, le paludisme entre en période de rechute. On distingue des rechutes exoérythrocytaires et érythrocytaires, précoces et tardives selon le stade d'évolution. Les rechutes érythrocytaires sont observées en cas d'infection par tous les types de plasmodes. Les premières surviennent dans les deux mois suivant les crises primaires; les rechutes ultérieures sont considérées comme tardives. Sans traitement ou avec un traitement inadapté du paludisme de trois jours et du paludisme ovale, une période d'accalmie dure de 6 à 11 mois, avec disparition des parasites du sang et rétablissement de l'état clinique. Viennent ensuite des rechutes tardives (provoquées par l'activation des hypnozoïtes hépatiques), à nouveau remplacées par une période de latence sans traitement, après laquelle la maladie réapparaît.
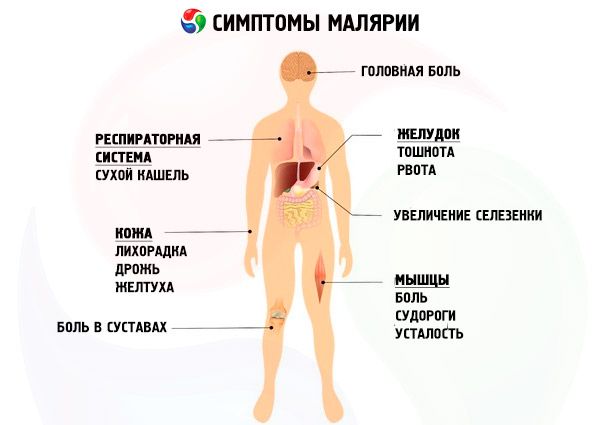
P. falciparum vit dans le corps humain (sans traitement) jusqu'à 1,5 an, P. vivax et P. ovale - jusqu'à 3 ans, P. malariae - pendant de nombreuses années, parfois à vie.
Qu'est ce qui te tracasse?
Formes
Selon les recommandations de l'OMS, le paludisme est classé en formes simples, graves et compliquées. Les formes malignes et les complications sont principalement caractéristiques de l'infection à P. falciparum. La maladie causée par P. vivax, P. ovale et P. malariae a généralement une évolution bénigne.
Paludisme de trois jours
La période d'incubation du paludisme de trois jours varie de 10 à 21 jours à 6 à 14 mois. Les symptômes prodromiques du paludisme avant la première crise sont rares, mais ils précèdent souvent les rechutes et se manifestent par une sensation de malaise général, une faiblesse, une fatigue, des douleurs lombaires et des douleurs dans les membres, une légère augmentation de la température corporelle, une perte d'appétit et des maux de tête. La durée moyenne de la période prodromique est de 1 à 5 jours.
Au début, la courbe de température est irrégulière (fièvre initiale), ce qui est associé à la libération asynchrone de plusieurs générations de P. vivax dans le sang. Par la suite, les accès palustres typiques débutent par une fièvre intermittente de trois jours, signe de la formation de la principale génération de parasites dans le sang. Lors d'un accès fébrile palustre, trois phases se succèdent immédiatement: les frissons, la chaleur et la transpiration. Un accès palustre débute par des frissons, dont l'intensité peut varier, allant de légers frissons à des frissons vertigineux. À ce moment, le patient se couche et tente en vain de se réchauffer, mais les frissons s'intensifient. La peau devient sèche, rugueuse ou « chair de poule » au toucher, froide, les extrémités et les muqueuses visibles sont cyanosées. Les symptômes suivants du paludisme sont observés: maux de tête intenses, parfois vomissements, douleurs articulaires et lombaires. La phase de frissons dure de quelques minutes à une à deux heures, puis est remplacée par la phase fébrile. Le patient retire ses vêtements et ses sous-vêtements, mais cela ne le soulage pas. La température corporelle atteint 40-41 °C, la peau devient sèche et chaude, et le visage rougit. Les maux de tête, les douleurs lombaires et articulaires s'intensifient; délire et confusion sont possibles. La fièvre dure d'une à plusieurs heures et est remplacée par une période de transpiration. La température chute fortement, la transpiration est souvent abondante, obligeant le patient à changer de sous-vêtements à plusieurs reprises. Affaibli par la crise, il s'endort rapidement. La crise dure de 6 à 10 heures. Un début de crise le matin et l'après-midi est considéré comme typique. Après la crise, une période d'apyrexie commence, qui dure environ 40 heures. Après 2 ou 3 poussées de fièvre, le foie et la rate présentent une augmentation marquée du volume. Modifications sanguines: anémie, se développant progressivement à partir de la deuxième semaine de la maladie, leucopénie, neutropénie avec déplacement des cellules en bandelettes vers la gauche, lymphocytose relative, anéosinophilie et augmentation de la VS.
Au cours de l'évolution naturelle de la maladie sans traitement étiotrope, après 12 à 14 crises (4 à 6 semaines), l'intensité de la fièvre diminue, les crises s'atténuent progressivement et la taille du foie et de la rate diminue. Cependant, après 2 semaines à 2 mois, des rechutes précoces surviennent, caractérisées par une courbe de température synchrone, une hypertrophie du foie et de la rate, et une anémie. Par la suite, avec le développement de l'immunité, les parasites disparaissent du sang et une période de latence s'installe. Si aucun traitement par médicaments histoschizotropes n'est administré à ce stade, après 6 à 8 mois (et parfois 1 à 3 ans), les formes tissulaires « dormantes » des parasites s'activent et des rechutes à distance se développent. Elles se caractérisent par un début brutal, une évolution plus modérée, une hypertrophie précoce de la rate, un nombre réduit de crises (jusqu'à 7-8), une parasitémie moins intense et plus longue, et la présence de gamétocytes dans le sang.
Paludisme ovale
Par de nombreux aspects cliniques et pathogéniques, le paludisme ovale est similaire au paludisme à vivax de trois jours. La période d'incubation du paludisme ovale est de 11 à 16 jours. Dans le cas du paludisme ovale, l'agent pathogène a tendance à être en latence primaire. La période d'incubation peut durer de 2 mois à 2 ans, voire plus. Les symptômes du paludisme comprennent une fièvre intermittente de trois jours, plus rarement quotidienne. Les crises fébriles surviennent souvent le soir, plutôt qu'en début de journée, comme c'est le cas pour d'autres formes de paludisme. Le paludisme ovale se caractérise principalement par une évolution bénigne, avec un petit nombre de paroxysmes, sans frissons prononcés et une température plus basse au plus fort des crises. Il est caractéristique que les paroxysmes de la crise primaire cessent très souvent spontanément. Ceci s'explique par la formation rapide d'une immunité stable. En l'absence de traitement par médicaments histoschizotropes, une à trois rechutes sont possibles, espacées de 17 jours à 7 mois.
Quartan
L'évolution est généralement bénigne. La période d'incubation est de 3 à 6 semaines. Les symptômes prodromiques du paludisme sont rares. Le début de la maladie est aigu. Dès la première crise, une fièvre intermittente s'installe, avec une fréquence de crises tous les 2 jours. Le paroxysme débute généralement à midi et dure en moyenne environ 13 heures. La période de frissons est longue et intense. La chaleur peut durer jusqu'à 6 heures et s'accompagne de céphalées, de myalgies, d'arthralgies, parfois de nausées et de vomissements. Les patients sont parfois agités et délirants. En période intercritique, l'état des patients est satisfaisant. L'anémie et l'hépatosplénomégalie se développent lentement, au plus tôt 2 semaines après le début de la maladie. Sans traitement, on observe 8 à 14 crises, mais la schizogonie érythrocytaire, à un faible niveau, persiste pendant de nombreuses années. Le plus souvent, l'infection se manifeste par un portage parasitaire sans activation de la schizogonie érythrocytaire, ce qui fait de ces individus des donneurs potentiellement dangereux. Dans les foyers endémiques, le paludisme de quatre jours provoque un syndrome néphrotique avec un pronostic défavorable chez l'enfant.
Paludisme tropical
Forme la plus grave d'infection palustre. La période d'incubation est de 8 à 16 jours. À la fin de celle-ci, certains individus non immunisés présentent des symptômes prodromiques du paludisme durant de quelques heures à 1 à 2 jours: malaise, faiblesse, fatigue, courbatures, myalgies et arthralgies, céphalées. Chez la plupart des patients, le paludisme tropical débute de manière aiguë, sans période prodromique, avec une élévation de la température corporelle à 38-39 °C. Si les cycles de schizogonie érythrocytaire de plusieurs générations de P. falciparum chez un organisme infecté ne se terminent pas simultanément, cela se traduit souvent cliniquement par l'absence de périodicité cyclique des accès fébriles. Les accès, alternant les phases, débutent par des frissons d'une durée de 30 minutes à 1 heure. Durant cette période, la peau est pâle à l'examen, froide au toucher, souvent avec une rugosité semblable à la chair de poule. Les frissons s'accompagnent d'une élévation de la température corporelle à 38-39 °C. Avec la fin des frissons, la deuxième phase du paroxysme commence: la fièvre. Les patients ressentent une légère sensation de chaleur, parfois même une véritable sensation de chaleur. La peau devient chaude au toucher et le visage est hyperhémique. Cette phase dure environ 12 heures, suivie d'une légère transpiration. La température corporelle chute à des valeurs normales et inférieures à la normale, puis remonte après 1 à 2 heures. Dans certains cas, l'apparition du paludisme tropical s'accompagne de nausées, de vomissements et de diarrhée. Des symptômes catarrhaux du paludisme au niveau des voies respiratoires supérieures sont parfois observés: toux, écoulement nasal, maux de gorge. À un stade plus avancé, des éruptions herpétiques sont observées sur les lèvres et les ailes du nez. Au stade aigu, les patients notent une hyperhémie conjonctivale; dans les cas graves, elle peut s'accompagner de pétéchies ou d'hémorragies sous-conjonctivales plus importantes.
Au pic du paludisme tropical, les frissons sont moins prononcés que durant les premiers jours de la maladie et durent de 15 à 30 minutes. La fièvre persiste plusieurs jours, les périodes d'apyrexie étant rares. En cas d'évolution bénigne de la maladie, la température corporelle atteint son pic à 38,5 °C et la fièvre dure de 3 à 4 jours; en cas d'évolution modérée, elle atteint respectivement 39,5 °C et 6 à 7 jours. L'évolution sévère se caractérise par une élévation de la température corporelle à 40 °C et plus, et dure huit jours ou plus. La durée des accès isolés (voire de plusieurs) dans le paludisme tropical atteint 30 à 40 heures. Une courbe de température irrégulière prédomine, plus rarement des formes rémittentes, occasionnellement intermittentes et constantes.
L'hypertrophie hépatique est généralement constatée au troisième jour de la maladie, tout comme l'hypertrophie splénique, mais elle est généralement enregistrée uniquement par percussion; une palpation nette n'est possible qu'au cinquième ou sixième jour. Lors de l'échographie abdominale, l'hypertrophie hépatique et splénique est constatée dès le deuxième ou le troisième jour suivant l'apparition des signes cliniques du paludisme tropical. Les troubles du métabolisme pigmentaire ne sont observés que chez les patients atteints de paludisme tropical sévère et, plus rarement, modéré. Une augmentation de plus de trois fois l'activité des aminotransférases sériques est considérée comme un indicateur de pronostic défavorable. Les troubles métaboliques du paludisme tropical incluent des modifications du système hémostatique et une hypoglycémie. Les troubles cardiovasculaires sont de nature fonctionnelle et se manifestent par une tachycardie, des bruits cardiaques étouffés et une hypotension. Un souffle systolique transitoire est parfois perçu à l'apex du cœur. Dans les formes sévères de la maladie, des modifications de l'ECG sont observées sous forme de déformation de la partie terminale du complexe ventriculaire: aplatissement et configuration inverse de l'onde T, abaissement du segment ST. Parallèlement, la tension des ondes R dans les dérivations standard diminue. Chez les patients atteints de la forme cérébrale, les modifications de l'onde P sont de type P-pulmonaire.
Dans le paludisme tropical, des troubles du système nerveux central associés à une forte fièvre et à une intoxication sont souvent observés: céphalées, vomissements, méningisme, convulsions, somnolence, parfois syndrome délirant, mais la conscience du patient est préservée.
Les signes caractéristiques d'une infection palustre modérée à sévère sont l'anémie hémolytique et la leucopénie, l'éosinophilie et la neutropénie. Une lymphocytose relative est observée dans la formule leucocytaire. Dans les formes sévères de la maladie, une leucocytose neutrophile est possible; la VS est constamment et significativement élevée. La thrombopénie est un signe typique de tous les types de paludisme. Comme pour d'autres maladies infectieuses, les patients présentent une protéinurie transitoire.
Le paludisme tropical récurrent est dû soit à un traitement étiotrope inadéquat, soit à une résistance de P. falciparum aux agents chimiothérapeutiques utilisés. L'évolution naturelle du paludisme tropical, avec une évolution favorable, ne dure pas plus de deux semaines. En l'absence de traitement étiotrope, les rechutes surviennent après 7 à 10 jours.
La grossesse est un facteur de risque généralement reconnu du paludisme tropical. Cela s'explique par son incidence élevée, sa tendance aux formes cliniques sévères, le risque pour la santé et la vie de l'enfant, et un arsenal thérapeutique limité. Le paludisme tropical chez les enfants de moins de cinq ans doit être considéré comme une maladie potentiellement mortelle. Chez les enfants plus jeunes (jusqu'à 3-4 ans), en particulier les nourrissons, le paludisme présente un tableau clinique particulier: il est dépourvu du symptôme clinique le plus frappant, le paroxysme palustre. Parallèlement, des symptômes palustres tels que convulsions, vomissements, diarrhée et douleurs abdominales sont observés, avec une détérioration rapide de l'état de l'enfant. L'apparition de convulsions et d'autres symptômes cérébraux n'indique pas nécessairement le développement d'un neuropaludisme; il s'agit souvent d'un symptôme de neurotoxicose. La parasitémie chez les jeunes enfants est généralement élevée: P. falciparum peut affecter jusqu'à 20 % des globules rouges. La maladie peut rapidement évoluer vers un cancer et entraîner le décès de l'enfant.
Complications et conséquences
Enregistré à tous les stades du paludisme tropical. Symptômes pronostiques défavorables du paludisme, indiquant la possibilité de développer une forme maligne. - fièvre quotidienne, absence d'apyrexie entre les crises, céphalées sévères, convulsions généralisées récidivant plus de deux fois en 24 heures, rigidité de décérébration, choc hémodynamique (pression artérielle systolique inférieure à 70 mm Hg chez l'adulte et inférieure à 50 mm Hg chez l'enfant). Ceci est également mis en évidence par une parasitémie élevée (plus de 100 000 P. falciparum dans 1 μl de sang), la détection de différents stades d'âge du parasite dans le sang périphérique, la présence de gamétocytes et une leucocytose accrue (supérieure à 12,0 x 10 9 /l). Une hypoglycémie inférieure à 2,2 mmol/L, une acidose métabolique décompensée, une augmentation de plus de trois fois de l'activité des aminotransférases sériques, ainsi qu'une diminution du taux de glucose dans le liquide céphalo-rachidien et un taux de lactate supérieur à 6 μmol/L sont également pronostiquement défavorables.
Les lésions graves du système nerveux central (SNC) associées au paludisme tropical sont regroupées sous le nom de « paludisme cérébral ». Son principal symptôme est l'apparition d'un état comateux. Le coma paludique peut être une complication du paludisme primaire, récurrent ou récidivant, mais il est plus fréquent en cas de paludisme primaire, principalement chez les enfants, les femmes enceintes et les personnes jeunes et d'âge moyen.
La forme cérébrale est la complication la plus fréquente du paludisme grave à falciparum. Dans les conditions actuelles, elle se développe dans 10 % des cas de paludisme à falciparum dans le monde, et 60 à 80 % des décès sont associés à cette complication. La forme cérébrale peut se développer dès les premiers jours, mais elle est plus fréquente dès la deuxième semaine de la maladie en raison de l'absence de traitement spécifique ou inadéquat. Une issue fatale peut survenir en 1 à 2 jours. Le tableau clinique du paludisme cérébral se distingue par trois phases: l'étourdissement, la stupeur et le coma véritable.
La phase de stupeur se caractérise par une léthargie mentale et physique du patient, ainsi qu'un épuisement rapide. Il s'oriente dans le temps et l'espace, mais prend contact avec lui à contrecœur, répond aux questions par monosyllabes et se fatigue rapidement. Les réflexes tendineux sont préservés.
Le stade sopor se manifeste par une prostration profonde du patient, accompagnée de rares éclairs de conscience. Une ataxie, une amnésie et des convulsions, parfois de nature épileptiforme, sont possibles. Les réflexes cornéens sont préservés et les pupilles sont normales. Les réflexes tendineux sont augmentés et des réflexes pathologiques apparaissent.
Dans le coma, le patient est inconscient et ne réagit pas aux stimuli externes. On observe un trouble de la convergence, un strabisme divergent, des mouvements flottants des globes oculaires avec les paupières ouvertes (comme si le patient regardait le plafond), un nystagmus horizontal et vertical, une paralysie de la sixième paire de nerfs crâniens; les réflexes tendineux et abdominaux sont absents, et les fonctions végétatives sont fortement altérées. Des symptômes méningés de paludisme et des réflexes pathologiques de Babinski, Rossolimo, etc. sont exprimés. Une incontinence urinaire et fécale est notée. Une ponction lombaire révèle une augmentation de la pression intracrânienne sans altération marquée de la composition protéique et cellulaire du liquide céphalorachidien. Une parasitémie élevée à différents stades d'âge de P. falciparum est détectée dans un collyre épais et un frottis sanguin de patients atteints de paludisme comateux. Parallèlement, des cas d'issue fatale de paludisme cérébral avec une très faible parasitémie sont connus. Le paludisme cérébral chez l'enfant s'accompagne souvent d'anémie. L'anémie aggrave l'état neurologique et somatique de l'enfant. Avec un traitement efficace, la conscience revient généralement subitement.
Dans le paludisme cérébral, des psychoses peuvent se développer suite à des modifications dystrophiques du parenchyme cérébral. En période aiguë, les psychoses se manifestent par un délire, une amentie, des crises d'épilepsie et des états maniaques. Les psychoses post-paludiques se caractérisent par une dépression, une faiblesse mentale, une hystérie, des syndromes schizophréniques et, chez l'enfant, un retard temporaire du développement mental. Parfois, des conséquences à long terme du paludisme cérébral sont observées: hémiplégie, ataxie, symptômes focaux des nerfs crâniens, troubles extrapyramidaux, mono- et polynévrite.
L'anémie hypochrome est une complication fréquente de toutes les formes d'infection palustre. Une anémie sévère est diagnostiquée lorsque l'hématocrite tombe en dessous de 20 % et le taux d'hémoglobine est inférieur à 50 g/l. Le degré d'anémie dépend du type de parasite, ainsi que de l'intensité et de la durée de l'infection. Chez les populations autochtones des pays tropicaux, la gravité du paludisme est souvent aggravée par une carence en fer et en acide folique dans l'alimentation. Après les premières crises, une anémie peut se développer, plus prononcée dans le paludisme tropical que dans les autres formes.
Le choc toxique infectieux (STI) avec développement d'un syndrome de coagulation intravasculaire disséminée (CIVD) est une complication caractéristique du paludisme à P. falciparum, survenant avec une parasitémie élevée. Le développement d'une insuffisance surrénalienne aiguë est caractéristique. L'évolution du choc toxique infectieux dans les climats chauds s'accompagne d'hypovolémie.
L'apparition d'une insuffisance rénale aiguë est généralement observée dans l'évolution maligne et compliquée du paludisme à P. falciparum. L'apparition d'une oligurie et d'une anurie, accompagnées d'une augmentation des taux de créatinine et d'urée dans le sang, est caractéristique; l'analyse d'urine révèle une protéinurie, une cylindrurie, une pyurie et une microhématurie prononcées.
Le syndrome néphrotique est une complication caractéristique du paludisme, caractérisée par une évolution lente et progressive, accompagnée d'œdème, d'hypertension artérielle, de protéinurie et du développement d'une insuffisance rénale.
La fièvre hémoglobinurique est la conséquence d'une hémolyse intravasculaire massive, associée à une invasion intense et à l'utilisation de certains antipaludiques (quinine, primaquine, sulfamides), chez les personnes présentant un déficit en glucose-6-phosphate déshydrogénase. Dans sa forme sévère, un ictère intense, un syndrome hémorragique sévère, une anémie et une anurie se développent, accompagnés de frissons, de fièvre (40 °C), de douleurs lombaires, de vomissements biliaires répétés, de myalgies et d'arthralgies. Les urines prennent une couleur brun foncé, due à la présence d'oxyhémoglobine. Dans les cas graves, le nombre d'érythrocytes est réduit à 1 x 10 12 /l et le taux d'hémoglobine à 20-30 g /l. Les parasites présents dans le sang sont très rares, voire absents, en cas d'hémoglobinurie paludéenne. Avec l'arrêt rapide de l'antipaludéen responsable de l'hémolyse des globules rouges, l'état du patient s'améliore sans conséquences graves. Dans les cas graves, en raison du développement d'une insuffisance rénale aiguë, le pronostic peut être défavorable. Ces dernières années, la nature auto-immune du développement de l'hémolyse aiguë, associée à l'utilisation prolongée et fréquente d'antipaludéens (quinine et primaquine), a été évoquée. Une forte fièvre est observée (avec une parasitémie mineure), les urines deviennent noires, une anémie, une leucocytose, une VS accélérée sont déterminées lors des analyses de sang, et l'insuffisance rénale progresse rapidement, entraînant une issue fatale en l'absence de traitement adéquat.
L'algid paludique se caractérise par des manifestations cliniques typiques d'un choc toxique infectieux: troubles hémodynamiques et microcirculatoires, troubles de l'hémostase, défaillance multiviscérale et hypothermie. Contrairement au paludisme cérébral, la conscience est préservée, bien qu'un coma puisse survenir ultérieurement. L'algid peut se développer sur fond d'œdème pulmonaire, d'acidose métabolique et de déshydratation sévère. Une parasitémie élevée est observée. Le pronostic dépend en grande partie d'un traitement rapide et adapté.
L'œdème pulmonaire aigu chez les patients atteints de paludisme tropical est souvent mortel. Le mécanisme de cette complication grave n'a pas été entièrement étudié. L'œdème pulmonaire peut être provoqué par une réhydratation excessive, mais il peut également se développer dans un contexte de pression artérielle pulmonaire normale. Actuellement, la plupart des chercheurs considèrent l'insuffisance respiratoire aiguë associée au paludisme tropical comme une manifestation du syndrome de détresse respiratoire de l'adulte.
Une complication rare mais grave de toute forme clinique de paludisme, avec ou sans splénomégalie hyperréactive, est la rupture splénique. Cette rupture peut être causée par une torsion du pédicule splénique avec stase sanguine aiguë et développement d'un hématome sous-capsulaire.
Dans le paludisme tropical, des lésions de la cornée de l'œil, une iritis, une iridocyclite, une opacification du corps vitré, une névrite optique, une choriorétinite et des hémorragies rétiniennes sont possibles; des cas de paralysie des muscles oculaires causés par des lésions des paires III, IV et VI de nerfs crâniens et de paralysie de l'accommodation ont été rapportés.
Rechutes du paludisme
Le niveau de parasitémie lors d'une rechute est généralement plus faible que lors des premiers symptômes du paludisme. En raison de l'augmentation du seuil pyrogène au cours de l'infection, les manifestations cliniques d'une rechute s'accompagnent généralement d'une parasitémie plus élevée. Les rechutes sont généralement bénignes, avec un syndrome toxique modéré et une alternance régulière de crises palustres dès le début; le nombre de crises est nettement inférieur à celui des premières manifestations de la maladie. Selon le moment d'apparition, on distingue les rechutes précoces (apparition des manifestations cliniques dans les deux premiers mois suivant les premières manifestations du paludisme) et tardives (après deux mois). Selon leur origine, les rechutes sont classées en rechutes érythrocytaires (toutes formes de paludisme) et exoérythrocytaires (uniquement pour les paludismes vivax et ovale).
Diagnostics malaria
Le diagnostic du paludisme repose sur des données épidémiologiques (séjour dans un foyer de paludisme, absence ou insuffisance de chimioprophylaxie), sur le tableau clinique de la maladie (crises caractéristiques) et est confirmé par des examens de laboratoire.
Le diagnostic du paludisme doit prendre en compte:
- début brutal de la maladie, symptômes prononcés d'intoxication, évolution cyclique avec alternance d'attaques de fièvre et de périodes d'apyrexie, hypertrophie du foie et de la rate, développement d'une anémie hémolytique progressive;
- données d’histoire épidémiologique (séjour dans une zone à haut risque de paludisme, transfusion sanguine, toxicomanie);
Durée du paludisme, en tenant compte du développement de rechutes avec une seule infection et sans traitement étiotrope adéquat
Forme de paludisme |
Durée de l'infection |
|
Normale |
Maximum |
|
Paludisme à falciparum |
Jusqu'à 1 an |
Jusqu'à 3 ans |
Paludisme-malariae |
Jusqu'à 2-3 ans |
Possible pour la vie |
Paludisme-vivax et ovale |
Jusqu'à 1,5 à 2 ans |
Jusqu'à 4-5 ans |
- résultats des tests de laboratoire:
- résultats de l'hémogramme: diminution du taux d'hémoglobine, leucopénie, lymphomonocytose, augmentation de la VS;
- résultats de la microscopie d'une goutte de sang épaisse (visualisation d'au moins 100 champs de vision en cas de faible parasitémie): détection de plasmodes et détermination du taux de parasitémie dans 1 µl de sang (100 champs de vision - 0,2 µl de sang).
C'est nécessaire:
- Pour sélectionner le degré d'intensité du traitement antipaludique spécifique (en cas de niveau élevé de parasitémie chez les patients atteints de paludisme tropical, l'administration parentérale des médicaments est préférable).
- Pour surveiller l’efficacité d’une thérapie spécifique.
Le niveau de parasitémie peut également être évalué en comptant le pourcentage d'érythrocytes affectés pour 100 leucocytes dans une goutte épaisse de sang (dans ce cas, pour évaluer le nombre de parasites dans 1 μl, il est nécessaire de connaître le nombre total de leucocytes et d'érythrocytes dans 1 μl chez le patient);
- Données microscopiques d'un frottis sanguin pour déterminer le type de plasmodium. La goutte épaisse et le frottis sanguin sont colorés selon la méthode de Romanovsky-Giemsa.
En raison de l'accumulation d'érythrocytes envahis contenant des trophozoïtes et des schizontes adultes dans les vaisseaux des organes internes, lors de l'examen d'une préparation en gouttes épaisses dans le paludisme à P. falciparum léger, seuls des trophozoïtes jeunes (juvéniles) au stade annulaire sont détectés dans les érythrocytes. L'apparition dans le sang périphérique d'érythrocytes envahis contenant des stades adultes de développement du parasite (trophozoïtes adultes ou amiboïdes, schizontes) est un signe biologique défavorable indiquant une évolution sévère (compliquée) du paludisme à P. falciparum.
Degrés de parasitémie dans le paludisme
Degrés de parasitémie |
Désignation conventionnelle |
Nombre de parasites dans les champs visuels |
Le nombre de parasites dans 1 µl de sang |
IV |
+ |
1 à 20 sur 100 champs |
5-50 |
III |
+ + |
10-100 dans 100 champs |
50-500 |
II |
+++ |
1 à 10 dans 1 champ |
500-5000 |
Je |
+ + + + |
Plus de 10 dans 1 champ |
Plus de 5000 |
Chez les individus ayant eu un premier contact (non immunisés) avec cette infection, les jeunes enfants, les premières crises peuvent survenir avec une parasitémie très faible, parfois non détectable au microscope; cela nécessite un nouveau test sanguin (goutte épaisse) après 6 à 12 heures, mais au plus tard dans les 24 heures.
Le diagnostic en laboratoire du paludisme implique l'examen microscopique d'échantillons de sang (méthodes de goutte épaisse et de frottis mince) colorés selon la méthode Romanovsky-Giemsa.
Les patients suivants sont soumis à un dépistage du paludisme: les patients fébriles dont le diagnostic n'a pas été précisé pendant 3 jours en période épidémique et 5 jours le reste de l'année; les patients présentant des augmentations périodiques et continues de la température corporelle malgré un traitement conforme au diagnostic établi; les receveurs de sang présentant une augmentation de la température corporelle au cours des 3 derniers mois suivant la transfusion; les personnes vivant dans un foyer actif présentant une augmentation de la température corporelle. Il convient de noter que lors des premières crises de paludisme, le nombre de parasites dans le sang périphérique est faible; un examen approfondi est donc nécessaire. Le paludisme à faible parasitémie survient également chez les personnes ayant pris des antipaludiques à titre prophylactique (traitement suppressif) ou des médicaments (tétracycline, sulfamides) ayant un effet suppresseur sur les plasmodes paludiques avant la maladie. Il est recommandé de réaliser un prélèvement sanguin pour examen en cas de fièvre et d'apyrexie. Pour détecter les parasites, on examine une goutte épaisse, car son volume sanguin est 30 à 40 fois supérieur à celui d'un frottis fin. En cas de parasitémie élevée, l'agent pathogène du paludisme est détecté même lors de l'examen d'un frottis fin. Les caractéristiques morphologiques et les propriétés tinctoriales (colorabilité) des différents stades d'âge des formes asexuées dans les érythrocytes sont clairement identifiables sur un frottis fin. Il est nécessaire de déterminer le type de parasite, ce qui est particulièrement important pour P. falciparum. Dans le paludisme tropical non compliqué, P. falciparum n'est observé dans le sang périphérique qu'au stade de jeunes trophozoïtes annulaires. En cas de primo-infection, des stades plus matures du parasite sont détectés dans le sang périphérique lorsque la maladie évolue vers une forme maligne sévère. La parasitémie augmente plus rapidement qu'en cas d'infection par d'autres types d'agents pathogènes. Les gamétocytes de P. falciparum mûrissent lentement, mais vivent longtemps (jusqu'à 6 semaines), tandis que les gamétocytes des autres espèces meurent quelques heures après leur maturation. Les gamétocytes détectés dans le paludisme tropical permettent de déterminer la durée de la maladie: au début (évolution simple), seuls des trophozoïtes annulaires sont détectés; au pic, on observe des anneaux et des gamétocytes (en cas de primo-infection et d'absence de traitement, cela indique une durée du paludisme d'au moins 10 à 12 jours); en période de guérison, seuls des gamétocytes sont détectés. Pendant le traitement, le taux de parasitémie dans le sang périphérique est déterminé dynamiquement. Un jour après le début du traitement étiotrope, il devrait diminuer de 25 % ou plus, et au troisième jour, il ne devrait pas dépasser 25 % de la valeur initiale. La présence de parasites dans la préparation sanguine au quatrième jour après le début du traitement, sous réserve de toutes les conditions de réussite du traitement, est un signe de résistance de l'agent pathogène au médicament utilisé.
Ces dernières années, des tests rapides (méthodes immunochromatographiques) basés sur la détection de la protéine spécifique HRP-2a et de l'enzyme pLDH de P. falciparum ont été utilisés dans les foyers d'endémie afin d'obtenir rapidement une réponse préliminaire. Les tests KAT-PF (KAT MEDICAL, Afrique du Sud), un test rapide réputé, ont montré une efficacité et une spécificité élevées contre P. falciparum. La comparaison des résultats du test rapide, de la microscopie et de la PCR a montré que son efficacité diagnostique atteint 95 à 98 %. L'utilisation de tests rapides permet d'obtenir le résultat en seulement 10 minutes. Le personnel de laboratoire maîtrise la réaction en 1 à 2 heures. Ces méthodes rapides permettent aux personnes vivant ou voyageant dans des régions endémiques de réaliser un autodiagnostic; elles peuvent être réalisées sur le terrain. En Russie, le diagnostic rapide du paludisme est actuellement limité à des études cliniques individuelles.
Dans les conditions modernes, notamment dans les études de masse, la méthode PCR basée sur la détection de l'ADN du parasite du paludisme revêt une importance particulière. Elle permet de déterminer le portage en cas de faible parasitémie et d'infection mixte par différents types de plasmodes, ainsi que de différencier une rechute du paludisme à P. falciparum résistant aux médicaments d'une réinfection par P. falciparum. Actuellement, elle est principalement utilisée dans les études épidémiologiques.
Quels tests sont nécessaires?
Diagnostic différentiel
Le diagnostic différentiel du paludisme est effectué en fonction de la gravité des manifestations cliniques et de la durée de la maladie. On distingue tout d'abord le paludisme des maladies qui se manifestent par une fièvre prolongée, une hypertrophie du foie et de la rate, et un possible développement d'anémie: fièvre typhoïde et paratyphoïde, brucellose, leptospirose, septicémie, lymphogranulomatose. Dans les cinq premiers jours suivant le début de la maladie, un diagnostic erroné fréquent de paludisme dans les régions non endémiques est la grippe (ou d'autres infections virales respiratoires aiguës).
Dans les pays tropicaux d’Amérique du Sud, d’Afrique, d’Asie du Sud-Est et d’Inde, un diagnostic différentiel du paludisme avec les fièvres virales hémorragiques (fièvre jaune, dengue, etc.) est réalisé.
Dans la forme cérébrale du paludisme à falciparum, le diagnostic différentiel du paludisme est réalisé avec une encéphalopathie (coma) se développant avec un diabète sucré décompensé, une insuffisance hépatique et rénale, ainsi qu'un œdème et un gonflement du cerveau avec une méningite ou une méningo-encéphalite d'étiologie bactérienne ou virale.
Qui contacter?
Traitement malaria
Le traitement du paludisme comprend l’arrêt des crises aiguës de la maladie, la prévention des rechutes et du portage de gamètes, et la restauration des fonctions corporelles altérées.
Les médicaments antipaludiques sont divisés en groupes suivants en fonction de leur effet sur un stade particulier du développement du parasite: agents hématoschizotropes, efficaces contre les stades érythrocytaires asexués des plasmodes; agents histoschizotropes, efficaces contre les stades tissulaires asexués des plasmodes; médicaments gamotropes, provoquant la mort des gamétocytes dans le sang du patient ou perturbant la maturation des gamémonts et la formation de sporozoïtes dans le corps du moustique.
Traitement étiotrope
Le traitement étiotrope du paludisme chez les patients atteints de paludisme doit être prescrit immédiatement après l’établissement d’un diagnostic clinique et épidémiologique et une prise de sang pour examen parasitologique.
Les médicaments actuellement utilisés appartiennent à six groupes de composés chimiques: les 4-aminoquinoléines (chloroquine-délagyl, phosphate de chloroquine, nivaquine), les quinoléinométhanols (quinine-dichlorhydrate de quinine, sulfate de quinine, quinimax, méfloquine), les phénanthrèneméthanols (halfan, halofantrine), les dérivés de l’artémisinine (artésunate, artéméther, artééther), les antimétabolites (proguanil), les 8-aminoquinoléines (primaquine, tafénoquine). De plus, des antipaludiques combinés sont utilisés: la savarine (chloroquine + proguanil), la malarone (atovaquone + proguanil), le coartem ou le riamet (artéméther + luméfantrine).
Si P. vivax, P. ovale ou P. malariae sont détectés chez le patient, des médicaments du groupe des 4-aminoquinoléines sont utilisés, le plus souvent la chloroquine (délagyl). Le traitement du paludisme est le suivant: les deux premiers jours, le médicament est utilisé à une dose quotidienne de 10 mg/kg de la base (quatre comprimés de délagyl à la fois), puis le troisième jour, à une dose de 5 mg/kg (deux comprimés de délagyl) une fois. Des cas isolés de résistance de souches de P. vivax à la chloroquine ont été signalés en Birmanie, en Indonésie, en Papouasie-Nouvelle-Guinée et au Vanuatu. Dans ces cas, le traitement doit être administré par méfloquine ou quinine, conformément au schéma thérapeutique du paludisme simple. Les crises cessent après 24 à 48 heures et les parasites disparaissent du sang 48 à 72 heures après le début de la prise de chloroquine.
Pour le traitement radical (prévention des rechutes à distance) du paludisme à P. vivax ou P. ovale, après la fin du traitement à la chloroquine, on utilise un schizontocide tissulaire, la primaquine. Ce traitement est administré pendant 14 jours à la dose de 0,25 mg/kg (base) par jour. Des souches de P. vivax résistantes à la primaquine (souches dites de type Chesson) sont présentes dans les îles du Pacifique et dans les pays d'Asie du Sud-Est. Dans ces cas, l'un des schémas thérapeutiques recommandés consiste à prendre de la primaquine à la dose de 0,25 mg/kg par jour pendant 21 jours.
Si P. falciparum est détecté dans le sang de personnes non immunisées dans des cas bénins, les médicaments de choix, selon les recommandations de l'OMS, sont la méfloquine et les dérivés de l'artémisinine (artéméther, artésunate, artééther); l'halofantrine peut également être utilisée. En l'absence de méfloquine et d'halofantrine et/ou en présence de contre-indications à l'utilisation de ces médicaments, la quinine est prescrite en association avec des antibiotiques (tétracycline, doxycycline). La tétracycline est prise à raison de 0,5 g deux fois par jour pendant 7 à 10 jours; elle peut être remplacée par la doxycycline à une dose quotidienne de 0,1 g, la durée d'administration étant de 7 à 10 jours. Dans les régions où P. falciparum est résistant à la méfloquine et à la quinine, une association de méfloquine et de préparations d'artémisinine (artésunate, artéméther) est recommandée pour le traitement du paludisme tropical non compliqué. L'association de fansidar et d'artésunate est efficace dans le traitement du paludisme tropical non compliqué. Les préparations à base d'artémisinine sont largement utilisées pour traiter le paludisme tropical multirésistant en Asie du Sud-Est, dans plusieurs pays d'Amérique du Sud et en Afrique. Elles agissent très rapidement sur les stades sanguins et les gamétocytes. Cependant, ces médicaments sont rapidement éliminés de l'organisme, ce qui explique les rechutes du paludisme. Il est plus approprié de les prescrire en association avec la méfloquine aux doses suivantes:
- artésunate: 4 mg/kg deux fois par jour pendant 3 jours; méfloquine: 15 mg/kg une fois le jour 2 ou 25 mg/kg en deux prises les jours 2 et 3;
- artéméther: 3,2 mg/kg une fois par jour pendant 3 jours; méfloquine: 15 mg/kg une fois le jour 2 ou 25 mg/kg en deux prises les jours 2 et 3.
Schémas thérapeutiques pour le paludisme non compliqué
Schémas d'application |
|||
Préparation |
Première dose, mg/kg |
Doses ultérieures, mg/kg (intervalle, h) |
Durée du cours, jours |
Chloroquine |
10 (terrains) |
10- 1-2 jours 5 - 3 jours |
3 |
Fansidar (sulfadoxine + pyriméthamine) |
2,50-1,25 |
- |
1 |
Quinine, Kinimax, Kinoform |
10 (terrains) |
7,5 (8) |
7-10 |
Méfloquine |
15 (terrains) |
- |
1 |
Halofantrine |
8 (sel) |
8 (6) |
1 |
Artésunate |
4 |
2 (12) |
7 |
Artéméther |
3.2 |
1,6 (24) |
7.0 |
Quinine-tétracycline |
10,0-1,5 |
10,0 (8)+5,0 (6) |
10,0+7,0 |
Coartem (artéméther + luméfantrine) |
1,3+8 0 |
1,3-8,0 (8) |
3.0 |
Lorsque le type d'agent pathogène n'est pas établi, il est recommandé d'appliquer le traitement selon les schémas thérapeutiques du paludisme tropical. Si le patient vomit moins de 30 minutes après la prise du médicament antipaludique prescrit, il doit reprendre la même dose. Si des vomissements surviennent 30 à 60 minutes après la prise des comprimés, la moitié de la dose du médicament est alors prescrite.
Les patients atteints de paludisme tropical sévère doivent être hospitalisés en unité de soins intensifs ou en service de réanimation. La quinine reste le médicament de choix pour le traitement du paludisme tropical sévère. Dans les formes compliquées (neuralisme, algide), la première dose (7 mg/kg) de quinine base est administrée par voie intraveineuse pendant 30 minutes. Une dose supplémentaire de 10 mg/kg est ensuite administrée par voie intraveineuse en perfusion pendant 4 heures. Ainsi, le patient reçoit 17 mg/kg de quinine base pendant les 4,5 heures suivant le début du traitement. Selon un autre schéma, la dose initiale de 20 mg/kg de quinine base est administrée sur 4 heures. Les deux schémas sont bien tolérés par les patients, sans troubles cardiovasculaires ni autres troubles. Une dose d'entretien de 10 mg/kg de quinine base est administrée à intervalles de 8 heures, pour une durée d'administration de 1,5 à 2 heures. Il est conseillé d'associer la quinine à la tétracycline (250 mg quatre fois par jour pendant 7 jours) ou à la doxycycline (0,1 g par jour pendant 7 à 10 jours). Chez l'enfant, il est recommandé d'administrer une dose de charge (15 mg/kg) de quinine base par voie intraveineuse, en perfusion intraveineuse, dans une solution de glucose à 5 % pendant 4 heures. Une dose d'entretien (10 mg/kg) est administrée pendant 2 heures à 12 heures d'intervalle. La même dose est utilisée pour l'administration intramusculaire, mais il est recommandé de diluer la quinine cinq fois dans de l'eau distillée et de la répartir en deux injections dans des fesses différentes.
L'artéméther est utilisé comme médicament alternatif pour le traitement du paludisme tropical compliqué, à la dose quotidienne de 3,2 mg/kg le premier jour de traitement. Les six jours suivants, il est administré à la dose de 1,6 mg/kg par voie intramusculaire, en association avec une dose de méfloquine.
Les patients atteints de formes graves et compliquées de paludisme se voient prescrire un traitement pathogénique intensif. Lors de la réhydratation, il convient de se méfier des œdèmes pulmonaires et cérébraux, mais l'hypovolémie n'en est pas moins dangereuse. En cas d'échec de la réhydratation, ces patients peuvent présenter une insuffisance de perfusion tissulaire, une acidose, une hypotension, un choc et une insuffisance rénale. L'apparition d'une anémie n'engage généralement pas le pronostic vital, mais si l'hématocrite est réduit à 15-20 %, une transfusion de globules rouges ou de sang total est nécessaire. La transfusion de sang total frais ou de concentrés de facteurs de coagulation et de plaquettes est utilisée dans le syndrome de coagulation intravasculaire disséminée (CIVD). En cas d'hypoglycémie, une solution glucosée à 40 % doit être administrée par voie intraveineuse.
Le traitement de l'œdème cérébral repose sur la détoxification, la déshydratation, le contrôle de l'hypoxie cérébrale et des troubles respiratoires (oxygénothérapie, ventilation artificielle). Des anticonvulsivants sont administrés selon les indications. L'expérience du traitement du paludisme cérébral a démontré l'inefficacité, voire le danger, de l'utilisation de diurétiques osmotiques: dextranes de bas poids moléculaire; adrénaline; prostacycline; pentoxifylline; ciclosporine; sérums hyperimmuns. L'oxygénation hyperbare est également déconseillée.
En cas d'insuffisance rénale aiguë ou d'insuffisance rénale-hépatique aiguë, la dose quotidienne de quinine doit être réduite à 10 mg/kg en raison d'une possible accumulation du médicament, et les solutions doivent être administrées à raison de 20 gouttes par minute. Au début de l'insuffisance rénale aiguë, une diurèse forcée est pratiquée. En l'absence d'effet et en cas d'augmentation de l'azotémie, une hémodialyse ou une dialyse péritonéale est utilisée, ce qui donne généralement de bons résultats. En cas de fièvre hémoglobinurique, le médicament responsable de l'hémolyse est arrêté. Si nécessaire, il est remplacé par d'autres antipaludiques, et des glucocorticoïdes (prednisolone 1-2 mg/kg) et un traitement de désintoxication sont prescrits simultanément.
En cas de rupture de la rate, qui se développe généralement en cas d'élargissement rapide et important de l'organe, une intervention chirurgicale d'urgence est indiquée.
Pour traiter les rechutes de paludisme tropical, on choisit un médicament non utilisé auparavant ou on utilise le précédent, mais en association avec d'autres antipaludiques. Le portage des gamètes est éliminé par la primaquine pendant 1 à 3 jours aux doses thérapeutiques habituelles.
L'efficacité du traitement antipaludique est contrôlée par l'examen d'une goutte de sang épaisse contenant 1 μl de parasitémie. Ces analyses sont réalisées quotidiennement du 1er au 7e jour suivant le début du traitement étiotrope. Si les parasites disparaissent pendant cette période, d'autres analyses des préparations sanguines sont réalisées les 14e, 21e et 28e jours suivant le début du traitement.
Évaluation de l'efficacité
L'efficacité du traitement étiotrope du paludisme chez les patients atteints de paludisme est évaluée par trois paramètres: l'échec précoce (EF), l'échec tardif (LF) et le traitement efficace.
Après la prise d'un antipaludique, le patient peut vomir (surtout chez l'enfant). Il est important de rappeler que si des vomissements surviennent moins de 30 minutes après la prise du médicament, il faut reprendre la même dose, puis, après 30 à 60 minutes, la moitié de la dose utilisée.
Évaluation de l'efficacité du traitement du paludisme (OMS, 1996)
Échec précoce (EF) |
Aggravation ou persistance des signes cliniques du paludisme en présence de parasitémie au cours des 3 premiers jours suivant le début du traitement spécifique |
Échec tardif (LF) |
Réapparition des signes cliniques caractéristiques du paludisme (y compris le développement d'une affection grave) en présence d'une parasitémie du 4e au 14e jour après le début du traitement spécifique |
Efficacité du traitement |
Absence de parasitémie après 14 jours à compter du début du traitement spécifique en l'absence de critères RN et PN |
Traitement radical du paludisme
Le traitement radical du paludisme est effectué simultanément au traitement d'arrêt ou immédiatement après celui-ci.
- Pour la prévention des rechutes exoérythrocytaires du paludisme à P. vivax et du paludisme ovale, afin d'agir sur les hyptozoïtes, la primaquine est prescrite à raison de 45 mg (27 mg de la forme base) par jour (3 comprimés) – cure de 14 jours ou 6 comprimés – 1 fois par semaine – pendant 6 à 8 semaines (en cas de déficit en glucose-6-phosphate déshydrogénase). La tafénoquine, analogue de la primaquine, est en cours d'essais cliniques, mais présente une efficacité clinique supérieure et une fréquence d'effets secondaires plus faible.
- Pour prévenir la transmission du paludisme à P. falciparum (en affectant les gamétocytes), la primaquine est utilisée à raison de 45 mg (27 mg de la forme base) par jour (3 comprimés) pendant 3 jours. Le traitement est administré dans les régions d'endémie palustre tropicale. Chez les patients ayant contracté le paludisme à P. falciparum, la primaquine n'est pas prescrite en raison de l'effet efficace de la pyriméthamine, qui entre dans sa composition, sur les gamétocytes de P. falciparum.
Le traitement du paludisme à P. falciparum sévère et/ou compliqué est réalisé en unité de soins intensifs. Si l'administration orale est impossible, un traitement parentéral est administré avec l'un des médicaments suivants:
- dichlorhydrate de quinine - 10-20 mg/kg (jusqu'à 2,0 g par jour) par voie intraveineuse dans 500 ml de solution de glucose à 5 %, lentement, 2 à 3 fois par jour jusqu'à ce que le patient se rétablisse d'une affection grave, puis l'un des médicaments oraux selon le schéma thérapeutique du paludisme à falciparum non compliqué;
- Dans les conditions modernes, de nouvelles préparations à base de plantes sont utilisées dans certains pays pour traiter les formes graves de paludisme à falciparum (ces préparations ne sont pas certifiées en Russie): Artéméther (Artenam) - 160 mg par voie intramusculaire le premier jour, puis 80 mg pendant 6 jours; Artésunate - 50 mg par voie intramusculaire (intraveineuse) 2 fois par jour pendant 7 jours; Artémisinine - 1200 mg par voie intramusculaire pendant 7 jours.
Le traitement pathogénique du paludisme dépend de sa gravité et de l'évolution de ses complications. Une désintoxication, une correction de l'acidose métabolique, une hypoglycémie, des diurétiques, des antihistaminiques, des glucocorticoïdes (selon les indications), des vitamines, des médicaments cardiovasculaires et d'autres médicaments sont prescrits. En cas d'anurie, une dialyse péritonéale peut être réalisée. Dans le traitement de la fièvre hémoglobinurique, il convient d'arrêter les médicaments responsables de l'hémolyse et de procéder à une transfusion massive de globules rouges.
Les convalescents quittent l'hôpital après l'achèvement complet du traitement parasitologique étiotrope (arrêt du traitement) en présence de deux ou trois analyses sanguines négatives (goutte épaisse). Les patients ayant eu un paludisme à P. vivax et à P. ovale peuvent suivre un traitement complémentaire par primaquine en ambulatoire. Les patients ayant eu un paludisme sont suivis pendant un mois à un mois et demi avec des analyses parasitologiques répétées d'une goutte épaisse de sang tous les 7 à 10 jours. Les patients ayant eu un paludisme à P. vivax, à P. ovale et à P. malariae sont suivis pendant deux ans, avec des analyses parasitologiques obligatoires d'une goutte épaisse à chaque augmentation de température.
La prévention
L'OMS lutte contre le paludisme dans le monde entier dans le cadre du programme Faire reculer le paludisme, adopté en 1998. Actuellement, l'OMS a fixé un nouvel objectif pour la Région européenne: éliminer le paludisme à P. vivax d'ici 2010 et le paludisme tropical d'ici 2015. Le maillon le plus important de cet ensemble de mesures est la détection et le traitement rapides des sources d'infection.
Les mesures préventives contre l'épidémie visent à détecter et traiter rapidement le paludisme, ainsi que les porteurs de parasites (sources d'infection), et à lutter contre ces derniers. Il n'existe actuellement aucun vaccin efficace pour une immunisation active contre le paludisme.
La prophylaxie individuelle du paludisme lors d'un séjour dans un foyer d'endémie vise à prévenir l'infection et les accès palustres. La prévention consiste à prendre des mesures pour se protéger des piqûres de moustiques (utilisation de répulsifs, moustiquaires aux fenêtres et aux portes, rideaux de lit, vêtements couvrant les bras et les jambes lors des sorties nocturnes). Conformément aux recommandations de l'OMS, la prévention des accès palustres repose sur la prise d'antipaludéens. Cette mesure est recommandée uniquement aux personnes non immunisées se rendant dans des foyers à haut risque d'infection palustre et où l'accès aux soins médicaux est difficile (éloignement des établissements médicaux, impossibilité de réaliser un test sanguin rapide pour le paludisme).
La nécessité, la durée et la fréquence de prise des médicaments ne sont déterminées qu'après consultation d'un infectiologue. Il est important d'identifier les contre-indications à la chimiothérapie et la présence de maladies concomitantes graves. Les femmes enceintes non immunisées et les jeunes enfants ne doivent pas se rendre dans les régions où le paludisme est endémique.
Compte tenu de la forte résistance de Pl. falciparum à la chloroquine, la norme de prévention du paludisme à P. falciparum, recommandée par l'OMS, est actuellement la méfloquine (250 mg une fois par semaine, deux semaines avant le départ pour une région d'endémie et pendant quatre semaines après le retour). L'utilisation d'autres médicaments (doxycycline, chloroquine associée au proguanil, atovaquine associée au proguanil, primaquine et autres) est déterminée par un infectiologue, en tenant compte de la situation épidémiologique de la région de séjour et des autres facteurs mentionnés ci-dessus.
Prévoir
Dans la plupart des cas, la mortalité est due au paludisme tropical, ou plus précisément à sa forme cérébrale, qui survient dans 10 % des cas de paludisme grave à falciparum. Les décès dus aux autres types de paludisme sont très rares. Cependant, le paludisme tropical, diagnostiqué à temps et traité correctement, permet une guérison complète.
Pour les patients ayant déjà eu un paludisme tropical, il est recommandé d'établir une observation au dispensaire pendant 1 à 1,5 mois et de réaliser des analyses sanguines parasitologiques à intervalles d'une à deux semaines. L'observation au dispensaire des patients ayant déjà eu un paludisme à P. vivax, P. ovale ou P. malariae doit être maintenue pendant deux ans. Toute augmentation de la température corporelle nécessite une analyse sanguine en laboratoire afin d'identifier rapidement les plasmodes paludéens.

