Expert médical de l'article
Nouvelles publications
Médicaments
Médicaments prévenant la thrombose et améliorant la rhéologie sanguine
Dernière revue: 07.07.2025

Tout le contenu iLive fait l'objet d'un examen médical ou d'une vérification des faits pour assurer autant que possible l'exactitude factuelle.
Nous appliquons des directives strictes en matière d’approvisionnement et ne proposons que des liens vers des sites de médias réputés, des instituts de recherche universitaires et, dans la mesure du possible, des études évaluées par des pairs sur le plan médical. Notez que les nombres entre parenthèses ([1], [2], etc.) sont des liens cliquables vers ces études.
Si vous estimez qu'un contenu quelconque de notre contenu est inexact, obsolète ou discutable, veuillez le sélectionner et appuyer sur Ctrl + Entrée.
Dans la prévention de la formation de microthrombus multiples lors d'un choc et de leur destruction, diverses approches pharmacologiques peuvent être utilisées, qui utilisent des médicaments qui empêchent la formation de thrombus et améliorent la rhéologie sanguine:
- élimination des troubles hémodynamiques et de la microcirculation systémiques à l’aide d’agents vasoactifs et inotropes;
- mesures visant à améliorer la rhéologie sanguine à l’aide d’une thérapie par perfusion rationnelle et de médicaments qui restaurent l’élasticité des membranes érythrocytaires (trental ou pentoxifylline);
- prévention de l’agrégation plaquettaire et de la formation de thrombus « blancs » initiaux dans les petits vaisseaux artériels avec initiation ultérieure de la cascade de coagulation;
- inhibition de la formation de thrombus après activation de la cascade de coagulation systémique;
- activation de la fibrinolyse dans le but de dissoudre les caillots sanguins nouvellement formés (fibrinolysine, streptokinase, streptodécase, urokinase, etc.) ou, au contraire, inhibition de la fibrinolyse lorsqu'elle est généralisée chez certains patients présentant un choc traumatique et un sepsis (acide aminocaproïque, amben, contrical, etc.).
La plupart des approches mentionnées sont traditionnelles, bien développées dans la pratique du traitement du choc, ont leurs propres indications hémorrhéologiques et sont détaillées dans les chapitres correspondants. Par conséquent, dans cette section, il est conseillé de s'attarder sur l'approche générale de la prévention de la formation de thrombus en cas de choc, à l'aide d'agents pharmacologiques agissant sur la prophase de la coagulation sanguine. C'est ce niveau de prévention des complications de la coagulation – l'apparition, la formation et la croissance de « thrombus artériels blancs » – qui retient le plus l'attention des chercheurs.
Différents types de choc se caractérisent par des troubles variés et souvent multidirectionnels de la coagulation sanguine, avec détérioration de sa rhéologie. Le plus caractéristique des chocs septiques, endotoxiniques, de brûlure, traumatiques et hémorragiques est la formation de multiples microthrombus dans les plus petits vaisseaux, provoquée par des troubles de l'hémodynamique systémique, des vasospasmes et des troubles de la microcirculation, un épaississement du sang, une boue, une diminution de l'élasticité des membranes érythrocytaires, ainsi que par de nombreux facteurs généraux et locaux (autocoïdes) initiant des modifications locales de l'hémostase et l'inclusion de la prophase de la coagulation sanguine.
Sous une forme schématique (abrégée), le stade initial de l'hémocoagulation et le mécanisme de l'homéostasie de l'hémocoagulation locale sont présentés comme suit.
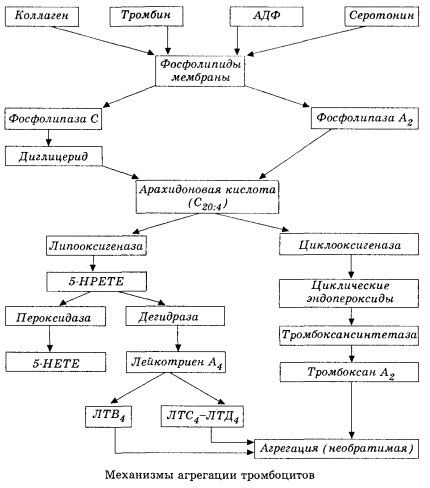
Elle débute par l'activation de la phospholipase membranaire A2 sous l'effet d'une combinaison de facteurs dommageables (dommages membranaires directs, hypoxie, peroxydation lipidique, influence de facteurs chimiques endogènes, etc.). La dégradation des phospholipides membranaires libère des acides gras à longue chaîne non estérifiés, dont l'acide arachidonique est le substrat initial le plus important. Sa transformation (cascade de l'acide arachidonique) s'effectue par les voies de la lipoxygénase (synthèse des leucotriènes) et de la cyclooxygénase (synthèse des prostaglandines, des thromboxanes, de la prostacycline).
Les leucotriènes (B4, C4, E4, D4, etc.) qui en résultent – des substances à l'activité biologique extrêmement élevée, parmi lesquelles figure la substance à réaction lente appelée anaphylaxie – jouent un rôle crucial dans le déclenchement des réactions vasculaires, inflammatoires et immunitaires locales, y compris les processus auto-immuns. Les leucotriènes provoquent des troubles de la microcirculation, une augmentation de la coagulation sanguine, la libération d'enzymes lysosomales autolytiques et la libération dans le sang d'un facteur inhibant la contractilité myocardique et les spasmes bronchiques.
En raison de leur capacité à provoquer une contraction des muscles lisses, les leucotriènes affectent considérablement l'hémodynamique systémique, les vaisseaux coronaires et le myocarde, exerçant un puissant effet constricteur coronaire et inotrope négatif, qui s'accompagne d'une diminution du débit cardiaque et joue un rôle important dans le développement de l'hypotension.
La diminution du débit cardiaque et la réponse hypotensive aux leucotriènes sont associées à un affaiblissement du muscle cardiaque et à une limitation du retour veineux vers le cœur. La capacité des leucotriènes à augmenter la perméabilité de la paroi vasculaire et à provoquer une extravasation plasmatique joue un rôle important dans la limitation du retour veineux. Les leucotriènes sont considérés comme importants dans la pathogenèse de l'infarctus du myocarde.
En cas de choc anaphylactique et septique (endotoxinique), leur rôle semble encore plus important, comme en témoignent la capacité des leucotriènes à s'accumuler en quantités importantes dans le plasma lors de réactions allergiques et à provoquer des modifications du flux sanguin systémique caractéristiques du choc anaphylactique, ainsi que les effets protecteurs des inhibiteurs des récepteurs des leucotriènes et des inhibiteurs de la lipoxygénase. Le développement d'inhibiteurs sélectifs des récepteurs des leucotriènes est en cours et constitue une voie scientifique prometteuse. Dans ce domaine, des progrès ont déjà été réalisés et l'efficacité de ces inhibiteurs dans l'ischémie myocardique, l'endotoxine et le choc hémorragique a été confirmée expérimentalement. Cependant, il faudra probablement encore plusieurs années avant que cette voie ne soit mise en œuvre cliniquement.
Si, dans les vaisseaux veineux, les thrombus se forment avec la participation égale des thrombocytes et des facteurs de coagulation plasmatiques, dans les artères, les thrombocytes sont les principaux initiateurs du processus. Ils contiennent de l'ADP, du Ca2+, de la sérotonine, des phospholipides, des enzymes de synthèse des prostaglandines et de la thromboxane, de la thrombosthénine (comme l'actomyosine musculaire, qui assure la contractilité de ces cellules), un facteur de croissance thrombogène de l'épithélium et des cellules musculaires de la paroi vasculaire, ainsi que plusieurs autres substances. La régulation humorale des fonctions thrombocytaires s'effectue par l'intermédiaire de récepteurs spécialisés de leurs membranes (récepteurs alpha2- et bêta2-adrénergiques, récepteurs de l'histamine et de la sérotonine, acétylcholine, thromboxane, adénosine, etc.). Une caractéristique particulière des thrombocytes est leur forte affinité pour le collagène et d'autres éléments sous-endothéliaux de la paroi vasculaire, ainsi que pour les surfaces non mouillantes et chargées négativement. Cette propriété confère aux thrombocytes une capacité exceptionnelle à adhérer (coller) à une section de vaisseau dont l'endothélium est endommagé, ce qui a de nombreuses chances d'être endommagé lors d'un choc. Dans ce cas, les thrombocytes se dispersent et libèrent des pseudopodes, qui peuvent adhérer entre eux et à la paroi vasculaire. La perméabilité membranaire augmente, et l'ADP, la sérotonine, le thromboxane et certains facteurs de coagulation adsorbés à la surface des thrombocytes sont libérés par les thrombocytes. Ces substances interagissent avec les récepteurs correspondants sur la membrane et, avec la participation des ions calcium, provoquent l'agrégation (initialement réversible). Le processus devient auto-entretenu, facilité par des facteurs de régulation humorale; d'autres facteurs, au contraire, peuvent l'arrêter, voire l'inverser, provoquant ainsi la désagrégation.
Avec la prédominance des influences et des conditions de formation de thrombus, les phases d'adhésion et d'agrégation réversible sont remplacées par la troisième phase - l'agrégation irréversible, qui est réalisée avec la participation de la thrombosthénine et conduit à la constriction du caillot; la réaction de renforcement de l'agrégat et de constriction se produit également avec la participation de Ca +, ATP et conduit à la formation d'un thrombus blanc.
La voie de conversion de l'acide arachidonique par la cyclooxygénase dans les plaquettes, les cellules endothéliales vasculaires et d'autres tissus assure l'homéostasie locale de la coagulation (la demi-vie des métabolites est très courte), car de puissantes substances pro- et antiagrégantes sont formées au cours de ce métabolisme. Le principal facteur activant l'agrégation plaquettaire dans la chaîne de réactions de la cyclooxygénase est le thromboxane A2, et son antagoniste tout aussi puissant est la prostacycline, produite par les cellules endothéliales et, dans une moindre mesure, les prostaglandines des séries E et G. Enfin, l'agrégation plaquettaire est fortement influencée par d'autres facteurs humoraux locaux et systémiques.
Activateurs et inhibiteurs de l'agrégation plaquettaire
Initiateurs et activateurs de l'agrégation plaquettaire |
Inhibiteurs de l'agrégation plaquettaire |
Collagène |
- |
ADP |
L'adénosine et ses stabilisateurs |
Norépinéphrine (via les récepteurs alpha2) |
Agents alpha-bloquants |
Sérotonine |
Agents antisérotonine |
Histamine |
Antihistaminiques |
Thrombine |
Héparine |
Ca2+ |
Antagonistes du Ca2+ |
CGMP - ses inducteurs (acétylcholine?) et ses stabilisateurs |
CAM - ses inducteurs (via les récepteurs bêta-adrénergiques) et ses stabilisateurs (inhibiteurs de la phosphodiestérase) |
Acide arachidonique |
Dextrans, albumine |
Thromboxane A2 |
Prostacycline I2 |
Les interventions pharmacologiques dans la phase initiale de formation de thrombus en cas de choc et de processus ischémiques aigus dans le cœur et le cerveau suggèrent la possibilité suivante:
- inhibition des réactions initiales (totales et partielles) de la cascade de l'acide arachidonique;
- inhibition d'une réaction particulière de synthèse de thromboxane;
- blocage des récepteurs des leucotriènes et des thromboxanes dans les plaquettes, les muscles lisses et d’autres cellules;
- l'utilisation de substances qui modulent l'agrégation plaquettaire, c'est-à-dire qui affaiblissent d'une autre manière la réaction de ces dernières à l'influence de facteurs initiateurs (collagène, thromboxane A2, leucotriènes, etc.).
La mise en œuvre des méthodes décrites ci-dessus pour corriger les troubles des propriétés rhéologiques du sang permet de résoudre la principale tâche tactique: protéger les récepteurs d'agrégation et d'adhésion plaquettaires de l'effet des activateurs ou inhiber les mécanismes intracellulaires de synthèse de ces récepteurs. L'inhibition des réactions initiales de la cascade de l'acide arachidonique peut être obtenue en protégeant les récepteurs plaquettaires réagissant aux activateurs polymères, à l'aide de dextranes de faible poids moléculaire, dont les molécules entrent en compétition avec la fibrine, le collagène, les immunoglobulines agrégées (IgE) et les composants du système du complément.
En masquant les récepteurs de la membrane plaquettaire et en entrant en compétition avec les protéines largement dispersées à la surface des érythrocytes, les dextranes de faible poids moléculaire les déplacent et détruisent les ponts entre les cellules. Cela est dû au fait que les dextranes, en enveloppant l'endothélium vasculaire et la surface des éléments cellulaires sanguins, augmentent leur charge négative, renforçant ainsi leurs propriétés antiagrégantes.
Dextrans
Les dextranes de faible poids moléculaire réduisent l'agrégation plaquettaire induite par le collagène et l'ADP, ainsi que l'effet activateur de la thrombine sur les plaquettes, inhibent la croissance du thrombus plaquettaire blanc initial, améliorent le flux sanguin, réduisent l'augmentation postopératoire de la teneur en fibrinogène plasmatique et modifient la structure et la stabilité de la fibrine.
Les perfusions intraveineuses de dextranes en cas de traumatisme et de choc réduisent non seulement l'agrégation et l'adhésion plaquettaires, mais mobilisent également l'héparine endogène, favorisant ainsi la formation d'un caillot sanguin lâche et difficilement rétractile, facilement lysé par les fibrinolytiques. L'activité antithrombinique des dextranes de faible poids moléculaire est associée à leur effet spécifique sur la structure et la fonction du facteur VIII de coagulation sanguine. Le facteur VIII (globuline antihémophilique), une grosse molécule à la structure et à la fonction complexes, participe à l'agrégation plaquettaire et à la stabilité du caillot. Les dextranes interfèrent avec l'action du facteur VIII, ralentissant ainsi l'agrégation plaquettaire et réduisant la stabilité du caillot.
Les dextranes de faible poids moléculaire ne sont pas de véritables anticoagulants et leur effet correcteur dans les troubles hémorrhéologiques est principalement associé à l'hémodilution, à la reconstitution du volume plasmatique circulant et à l'amélioration du flux sanguin dans le système de microcirculation.
La capacité des dextranes à améliorer le flux sanguin en cas de troubles hémodynamiques (choc, perte sanguine) est due à un ensemble de facteurs. L'apparition d'une concentration transitoire élevée du polymère dans le sang entraîne non seulement une hémodilution directe, mais crée également les conditions nécessaires à l'écoulement du liquide dans la circulation sanguine depuis l'espace interstitiel et à l'équilibre ultérieur de l'effet osmotique du dextrane. Suite à l'hémodilution, la viscosité sanguine diminue, le flux veineux vers le cœur augmente et le débit cardiaque augmente. Parallèlement à ces effets, les dextranes forment des complexes avec le fibrinogène et ont un effet hypolipémiant.
Ainsi, l'action antiagrégante et les effets hémodynamiques des dextranes de bas poids moléculaire contribuent à réduire la viscosité sanguine, ce qui est particulièrement important à faibles taux de cisaillement. La désagrégation des cellules sanguines améliore le flux sanguin systémique et la microcirculation, notamment dans sa partie veineuse, où les gradients de vitesse sont les plus faibles. L'utilisation de solutions de dextranes de bas poids moléculaire lors de divers types de chocs, lors du traitement chirurgical des blessures et de leurs conséquences, puis en période postopératoire, contribue à prévenir l'hypercoagulation et à réduire le risque de thrombose et d'embolie.
Il convient toutefois de noter que, dans certains cas, les perfusions de solutions de dextrane s'accompagnent de réactions anaphylactiques et allergiques (dangereuses en cas de sensibilisation et de choc anaphylactique). Cela est dû au fait que les dextranes, qui ont un poids moléculaire élevé et de nombreuses chaînes latérales, peuvent agir comme antigène. Par conséquent, pour établir la sensibilité individuelle, il est recommandé d'administrer au préalable par voie intraveineuse jusqu'à 20 ml d'une solution de dextrane de faible poids moléculaire sous forme d'haptène (solution à 15 %, poids moléculaire 1000) et de procéder à des perfusions d'un substitut plasmatique avant l'anesthésie.
 [ 9 ], [ 10 ], [ 11 ], [ 12 ], [ 13 ], [ 14 ], [ 15 ], [ 16 ], [ 17 ], [ 18 ]
[ 9 ], [ 10 ], [ 11 ], [ 12 ], [ 13 ], [ 14 ], [ 15 ], [ 16 ], [ 17 ], [ 18 ]
Inhibiteurs de la thrombine
La protection pharmacologique des récepteurs plaquettaires interagissant avec les activateurs plaquettaires peut également être obtenue par l'utilisation d'agents qui entrent en compétition avec les activateurs plaquettaires non polymériques ou les inhibent. Parmi ces agents figurent les inhibiteurs de la thrombine (héparine et hirudine, plusieurs inhibiteurs synthétiques, antagonistes de l'adrénaline), les alpha-bloquants (phentolamine, dihydroergotamine), les antagonistes de l'ADP (dipyridamole, adénosine et ses analogues structuraux, phosphocréatine) et les antagonistes de la sérotonine (méthysergide). Seuls quelques-uns de ces agents sont effectivement utilisés pour la prévention et le traitement des chocs d'origines diverses.
La protection des mécanismes intracellulaires de synthèse des récepteurs protéiques qui réagissent avec les activateurs de l'agrégation et de l'adhésion plaquettaires, ainsi que l'inhibition des processus de synthèse du thromboxane sont possibles avec des médicaments de différents groupes:
- inducteurs et stabilisateurs de cATP, de prostacycline et de prostaglandine PgE2;
- inhibiteurs de la phospholipase et de la phosphodiestérase.
Le développement intensif d'agents antiplaquettaires spécifiques a débuté relativement récemment et n'a pas encore donné de résultats fiables. Actuellement, en pratique clinique, outre les solutions de dextrane, des agents antiplaquettaires tels que l'acide acétylsalicylique, l'indométacine, le dipyradamole, la sulfinpyrazone (persantine), la prostacycline (eicoprosténone) et l'héparine sont largement utilisés pour prévenir la formation de thrombus plaquettaires blancs.
Médicaments anti-inflammatoires non stéroïdiens
Il a été établi que les effets pharmacologiques des anti-inflammatoires non stéroïdiens (AINS) – acide acétylsalicylique et indométacine – sont dus à leur action sur le métabolisme des eicosanoïdes (thromboxanes et prostaglandines). Presque tous les médicaments de ce groupe inhibent le complexe enzymatique appelé prostaglandine synthétase, exerçant ainsi leurs effets spécifiques et antiagrégants.
L'acide acétylsalicylique est absorbé très rapidement après administration orale. Le produit de son hydrolyse, l'acide salicylique, inhibe la cyclooxygénase plaquettaire, ce qui perturbe la conversion de l'acide arachidonique en prostaglandine O₂ et, finalement, en thromboxane A₂. L'acide acétylsalicylique inhibe l'agrégation induite par le collagène, l'ADP, l'adrénaline et la sérotonine. Bien que sa GG0₂ soit de 15 minutes, son effet antiagrégant dure plusieurs jours, ce qui s'explique apparemment par l'inhibition irréversible des réactions de synthèse des prostaglandines et la suppression de la fonction d'agrégation plaquettaire tout au long de leur vie (6 à 10 jours). Parallèlement à l'inhibition de la cyclooxygénase plaquettaire, l'acide acétylsalicylique à fortes doses inhibe la cyclooxygénase de la paroi vasculaire et, simultanément à la suppression de la synthèse de thromboxane A₂, il inhibe la synthèse de prostacycline dans les cellules endothéliales. Par conséquent, l'acide acétylsalicylique doit être prescrit comme antiagrégant à petites doses (3 000 à 5 000 mg/jour), qui inhibent principalement l'agrégation plaquettaire.
Étant donné que l'acide acétylsalicylique bloque la cyclooxygénase plaquettaire pendant plusieurs jours et la cyclooxygénase endothéliale pendant un jour maximum, il est rationnel de prescrire le médicament non pas quotidiennement, mais tous les 3 à 4 jours. Le choix de la dose optimale d'acide acétylsalicylique doit être individuel, car la sensibilité à l'effet antiplaquettaire du médicament varie d'un patient à l'autre. Chez les patients réactifs, l'acide acétylsalicylique à la dose de 0,5 g inhibe l'agrégation plaquettaire de 40 à 50 %, chez les patients hyperréactifs, totalement ou de 80 à 90 %, et chez les patients aréactifs, l'absence d'effet antiplaquettaire est caractéristique à dose constante.
Les inhibiteurs sélectifs de la thromboxane synthétase sont l'imidazole et ses analogues, qui ne bloquent pas la cyclooxygénase. Le dipyridamole, utilisé en pratique clinique comme dilatateur coronaire dans le traitement des cardiopathies ischémiques chroniques, inhibe sélectivement, comme l'imidazole, la thromboxane synthétase, empêchant la synthèse de thromboxane A2. Ce médicament et ses analogues inhiberaient également la phosphodiestérase plaquettaire, augmentant ainsi la concentration d'AMPc dans les plaquettes. De plus, le dipyridamole inhibe l'activité de l'adénosine désaminase et la captation de l'adénosine par les plaquettes, et bloque l'absorption de la sérotonine par les plaquettes ainsi que leur agrégation induite par l'adrénaline et le collagène. Une faible activité antiplaquettaire du médicament a été rapportée, ainsi que sa capacité à favoriser l'agrégation plaquettaire à faibles doses. L'effet antiplaquettaire le plus fiable peut être obtenu par l'association de dipyridamole et d'acide acétylsalicylique.
Héparine
Parmi les agents antithrombotiques, l'héparine est l'un des régulateurs les plus efficaces de l'état agrégé du sang, surtout lorsqu'elle est utilisée précocement. L'héparine possède une charge négative élevée et est capable d'interagir avec les ions et molécules de toutes tailles (enzymes, hormones, amines biogènes, protéines plasmatiques, etc.), de sorte que son spectre d'action biologique est assez large. Ce médicament possède des effets antithrombiniques, antithromboplastiques et antiprothrombiniques, empêche la conversion du fibrinogène en fibrine, inhibe la rétraction du caillot et augmente la fibrinolyse.
Le mécanisme d'action anticoagulante de l'héparine est assez complexe. Il est désormais établi que les effets anticoagulants de l'héparine sont associés à la potentialisation de l'action de l'antithrombine III et à l'amélioration de la capacité du complexe héparine-antithrombine III à inactiver rapidement la plupart des sérine protéases du système de coagulation sanguine. L'effet antithrombotique de l'héparine repose sur sa capacité à augmenter et à maintenir un potentiel électronégatif élevé de l'intima vasculaire, empêchant ainsi l'adhésion plaquettaire et la formation de microthrombus plaquettaires. L'héparine inhibe très activement la formation de thrombus dans les veines, prévenant à la fois la formation de thrombus local et la coagulation intravasculaire disséminée.
Prostacycline et ses analogues stables
Parmi les agents antiplaquettaires, les inhibiteurs d'agrégation les plus puissants sont la prostacycline et ses analogues stables. L'effet antiplaquettaire de la prostacycline est dû à la stimulation de l'adénylate cyclase et, par conséquent, à une augmentation de la concentration d'AMPc dans les plaquettes, à une diminution de la teneur en thromboxane, à une diminution de la teneur en thromboxane A2 et au blocage de ses récepteurs. La prostacycline étant instable et s'hydrolysant rapidement en produits inactifs, elle est administrée par voie intraveineuse en perfusion à un débit de 2 à 20 ng/kg par minute pendant 30 à 60 minutes jusqu'à 6 fois par jour.
La prostacycline, associée à un puissant effet antiagrégant, possède un puissant effet vasodilatateur et bronchodilatateur. Ce médicament dilate les vaisseaux du cerveau, du cœur, des reins, des muscles squelettiques et des vaisseaux mésentériques. Sous l'influence de la prostacycline, le flux sanguin coronaire augmente, l'apport énergétique du myocarde augmente et ses besoins en oxygène diminuent. Malgré son instabilité dans l'organisme, ses effets cliniquement favorables peuvent durer plusieurs semaines, voire plusieurs mois. Le mécanisme d'une telle action prolongée n'est pas encore élucidé.
La prostacycline est un médicament peu toxique, mais son utilisation peut entraîner des effets secondaires: rougeurs au visage, maux de tête, baisse de la tension artérielle, douleurs abdominales, anorexie. Tout comme la prostacycline, ses analogues synthétiques stables (iloprost, etc.) sont des inhibiteurs prometteurs de l’agrégation plaquettaire.
Médicaments qui améliorent la viscosité du sang
Les perturbations des propriétés rhéologiques du sang lors d'un traumatisme ou d'un choc sont causées non seulement par des modifications de l'activité fonctionnelle des plaquettes, mais aussi par une augmentation de la viscosité sanguine. La viscosité structurale du sang, système dispersé dynamique complexe, est largement déterminée par la viscosité du plasma et la capacité des érythrocytes à se déformer. La viscosité plasmatique dépend principalement de la concentration en protéines dans le sang. Les protéines de faible poids moléculaire, comme l'albumine, ont peu d'effet sur la viscosité plasmatique, tandis que les protéines de grande taille (fibrinogène, alpha- et gamma-globulines, et autres macromolécules) l'augmentent significativement.
À de faibles taux de cisaillement, l'adsorption du fibrinogène et des globulines à la surface des érythrocytes entraîne la formation de ponts entre les cellules adjacentes et la formation d'agrégats à partir des érythrocytes. La vitesse de formation des agrégats est un processus biophysique complexe qui dépend non seulement de l'intensité du cisaillement, mais aussi des propriétés électrocinétiques des érythrocytes, de la concentration, de la masse et de la capacité de sorption des macromolécules agrégatrices, ainsi que de la forme et de la plasticité des érythrocytes.
Le maintien de la forme et des propriétés mécaniques de la membrane érythrocytaire nécessite une dépense énergétique importante. On pense que l'énergie produite dans les érythrocytes lors de la glycolyse est consacrée à la phosphorylation de la spectrine, ce qui entraîne des modifications de la structure secondaire de la protéine et une interaction avec les composants voisins de la membrane interne. L'interaction entre les protéines structurales de la membrane, la spectrine et l'actine, joue un rôle important dans la formation des propriétés mécaniques de la membrane érythrocytaire, en maintenant une surface et une épaisseur constantes de l'érythrocyte, quelle que soit sa déformation.
En cas de troubles hémodynamiques systémiques et de la circulation sanguine organique, l'augmentation de la rigidité des membranes érythrocytaires et la formation d'agrégats érythrocytaires entraînent une diminution du débit capillaire, perturbant ainsi la fonction de transport gazeux du sang. Par conséquent, la correction des troubles rhéologiques du sang en état de choc doit inclure, outre la prévention de l'agrégation érythrocytaire, la normalisation de la viscosité plasmatique et sanguine, ainsi que l'agrégation et la déformation des érythrocytes.
Outre les dextranes de bas poids moléculaire, les solutions d'albumine constituent un moyen efficace d'augmenter la stabilité de la suspension sanguine. À la fin du choc, une agrégation généralisée des érythrocytes se produit dans un contexte de diminution de la concentration d'albumine dans le plasma sanguin et d'augmentation de la concentration de fibrinogène et de globulines, en particulier de la fraction alpha2, des lipoprotéines et des lipides. Dans ces conditions, les effets rhéologiques de l'albumine sont dus à deux facteurs principaux: l'hémodilution et la normalisation du rapport entre les protéines micro- et macroglobulaires plasmatiques. Parallèlement, l'albumine se lie aux acides libres, dont la labilisation lors d'un traumatisme ou d'un choc stimule l'agrégation des structures cellulaires du sang et la coagulation intravasculaire, pouvant provoquer une embolie graisseuse.
Les mesures antichoc visant à reconstituer le volume sanguin circulant et à éliminer l'hypoxie tissulaire et l'acidose métabolique contribuent à la normalisation de l'élasticité des membranes érythrocytaires, car l'hypoxie et l'acidose réduisent significativement leur déformabilité. L'augmentation de la rigidité des membranes érythrocytaires en état de choc est probablement associée à une inhibition de la synthèse d'ATP dans les érythrocytes. À son tour, une diminution de la concentration d'ATP contribue à une augmentation de la concentration de Ca2+ dans les érythrocytes, ce qui, en se liant aux protéines membranaires, augmente la rigidité de la membrane.
L’un des médicaments pharmacologiques qui augmente la teneur en ATP dans les érythrocytes et l’élasticité des membranes érythrocytaires est le Trental (pentoxifylline), qui est utilisé en pratique clinique pour traiter les troubles ischémiques.
En plus de réduire la rigidité des membranes érythrocytaires, Trental provoque une vasodilatation, améliore l'oxygénation des tissus, inhibe l'activité de la phosphodiestérase dans les tissus, augmente la concentration d'AMPc et inhibe l'agrégation plaquettaire.
Parmi les autres agents pharmacologiques qui maintiennent l'élasticité de la membrane érythrocytaire, il convient de noter les antagonistes du Ca2+, qui limitent le flux d'ions dans les érythrocytes (flunarizine, nifédipine, etc.).
 [ 19 ], [ 20 ], [ 21 ], [ 22 ], [ 23 ], [ 24 ], [ 25 ], [ 26 ], [ 27 ]
[ 19 ], [ 20 ], [ 21 ], [ 22 ], [ 23 ], [ 24 ], [ 25 ], [ 26 ], [ 27 ]
Attention!
Pour simplifier la perception de l'information, cette instruction pour l'utilisation du médicament "Médicaments prévenant la thrombose et améliorant la rhéologie sanguine" traduit et présenté sous une forme spéciale sur la base des instructions officielles pour l'usage médical du médicament. Avant l'utilisation, lisez l'annotation qui a été directement envoyée au médicament.
Description fournie à titre informatif et ne constitue pas un guide d'auto-guérison. Le besoin de ce médicament, le but du régime de traitement, les méthodes et la dose du médicament sont déterminés uniquement par le médecin traitant. L'automédication est dangereuse pour votre santé.

