Expert médical de l'article
Nouvelles publications
Causes et pathogénie de la diphtérie
Dernière revue: 04.07.2025

Tout le contenu iLive fait l'objet d'un examen médical ou d'une vérification des faits pour assurer autant que possible l'exactitude factuelle.
Nous appliquons des directives strictes en matière d’approvisionnement et ne proposons que des liens vers des sites de médias réputés, des instituts de recherche universitaires et, dans la mesure du possible, des études évaluées par des pairs sur le plan médical. Notez que les nombres entre parenthèses ([1], [2], etc.) sont des liens cliquables vers ces études.
Si vous estimez qu'un contenu quelconque de notre contenu est inexact, obsolète ou discutable, veuillez le sélectionner et appuyer sur Ctrl + Entrée.
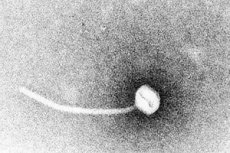
La diphtérie est un exemple typique de maladie infectieuse toxinogène. En 1883, Klebs démontra que Corynebacterium diphtheriae était l'agent causal de la diphtérie. Un an plus tard, Loeffler découvrit que l'organisme ne pouvait être cultivé qu'à partir de la cavité nasopharyngée et suggéra que les lésions des organes internes étaient dues à une toxine soluble. En 1888, Roux et Yersin montrèrent que les animaux injectés avec des filtrats stériles de C. diphtheriae développaient une pathologie organique indiscernable de celle de la diphtérie humaine; ceci démontra qu'une puissante exotoxine était le principal facteur de virulence.
La diphtérie est le plus souvent une infection des voies respiratoires supérieures provoquant fièvre, maux de gorge et malaise. Une épaisse membrane de fibrine gris-vert, appelée pseudomembrane, se forme souvent au(x) site(s) d'infection sous l'effet combiné de la croissance bactérienne, de la production de toxines, de la nécrose des tissus sous-jacents et de la réponse immunitaire de l'hôte. La reconnaissance du fait que les lésions organiques systémiques sont dues à l'action de la toxine diphtérique a conduit au développement d'un traitement antitoxinique efficace pour le traitement des infections aiguës et d'un vaccin antitoxine hautement efficace.
Bien que la vaccination par anatoxine ait fait de la diphtérie une maladie rare dans les régions où les normes de santé publique l'exigent, des épidémies de diphtérie continuent de survenir chez les personnes non immunisées et immunodéprimées. En revanche, des épidémies généralisées de diphtérie atteignant des proportions épidémiques se sont produites dans les régions où les programmes de vaccination actifs ont été suspendus.
Autres types de corynébactéries
Outre C. diphtheriae, C. ulcerans et C. pseudotuberculosis, C. pseudodiphtheriticum et C. xerosis peuvent occasionnellement provoquer des infections nasopharyngées et cutanées. Ces deux dernières souches sont reconnaissables à leur capacité à produire de la pyrazinamidase. En médecine vétérinaire, C. renale et C. kutscheri sont des agents pathogènes importants, responsables respectivement de pyélonéphrites chez les bovins et d'infections latentes chez la souris.
Causes
L'agent causal de la diphtérie, Corynebacterium diphtheriae, est un bâtonnet mince, légèrement courbé, avec des épaississements en forme de massue aux extrémités, immobile; il ne forme pas de spores, de capsules ou de flagelles et est Gram positif.
En plus de la toxine, les corynébactéries diphtériques produisent de la neuraminidase, de la hyaluronidase, de l'hémolysine, des facteurs nécrosants et diffus au cours de leurs processus vitaux, qui peuvent provoquer une nécrose et une liquéfaction de la substance principale du tissu conjonctif.
En fonction de leur capacité à former des toxines, les corynébactéries diphtériques sont divisées en toxigènes et non toxigènes.
La toxine diphtérique est une exotoxine bactérienne puissante qui détermine les manifestations cliniques générales et locales de la maladie. Sa toxigénicité est génétiquement déterminée. Les corynébactéries non toxigènes de la diphtérie ne sont pas responsables de la maladie.
Selon leurs caractéristiques culturelles et morphologiques, toutes les corynébactéries diphtériques se divisent en trois variants: gravis, mitis et intermedius. La gravité de la maladie n'est pas directement liée au variant de corynébactérie diphtérique. Chaque variant contient des souches toxigènes et non toxigènes. Les corynébactéries toxigènes de tous les variants produisent une toxine identique. [ 1 ]
Structure, classification et types d'antigènes
Corynebacterium diphtheriae est un bacille Gram positif, immobile, en forme de massue. Les souches cultivées dans les tissus ou les cultures in vitro plus anciennes présentent de fines taches sur les parois cellulaires, ce qui permet une décoloration lors de la coloration de Gram et entraîne une réaction de Gram variable. Les cultures plus anciennes contiennent souvent des granules métachromatiques (polymétaphosphate) qui se colorent en bleu-violet au bleu de méthylène. Les sucres des parois cellulaires comprennent l'arabinose, le galactose et le mannose. De plus, le 6,6'-ester toxique du tréhalose peut être isolé, contenant des acides corynémycolique et corynémycolénique en concentrations équimolaires. Trois types de cultures distincts sont reconnus: mitis, intermedius et gravis.
La plupart des souches ont besoin d'acides nicotinique et pantothénique pour leur croissance; certaines nécessitent également de la thiamine, de la biotine ou de l'acide pimélique. Pour une production optimale de toxine diphtérique, le milieu doit être supplémenté en acides aminés et mis de côté.
Dès 1887, Loeffler a décrit l'isolement de C. diphtheriae avirulents (non toxinogènes), indiscernables des souches virulentes (toxinogènes) isolées chez des patients sains. Il est désormais reconnu que les souches avirulentes de C. diphtheriae peuvent être converties en un phénotype virulent après infection et lysogénisation par l'un des nombreux corynébactériophages distincts porteurs du gène de structure de la toxine diphtérique, tox. La conversion lysogénique du phénotype avirulent en phénotype virulent peut se produire in situ et in vitro. Le gène de structure de la toxine diphtérique n'est essentiel ni pour le corynébactériophage ni pour C. diphtheriae. Malgré cette observation, aucune dérive génétique de la toxine diphtérique n'a été observée.
Pathogénèse
Les points d'entrée de l'infection sont les muqueuses de l'oropharynx, du nez, du larynx, plus rarement celles des yeux et des organes génitaux, ainsi que la peau lésée, les plaies ou les brûlures, l'érythème fessier et les plaies ombilicales non cicatrisées. À ce point d'entrée, la bactérie diphtérique corynébactérienne se multiplie et sécrète une exotoxine.
L'exsudat riche en fibrinogène est exsudé et transformé en fibrine sous l'influence de la thrombokinase libérée lors de la nécrose des cellules épithéliales. Un film fibrineux se forme, signe caractéristique de la diphtérie.
Le portage nasopharyngé asymptomatique est fréquent dans les régions d'endémie diphtérique. Chez les individus sensibles, les souches toxigènes provoquent la maladie en se répliquant et en sécrétant la toxine diphtérique dans le nasopharynx ou les lésions cutanées. La lésion diphtérique est souvent recouverte d'une pseudomembrane composée de fibrine, de bactéries et de cellules inflammatoires. La toxine diphtérique peut être clivée protéolytiquement en deux fragments: le fragment N-terminal A (domaine catalytique) et le fragment B (domaines transmembranaire et de liaison au récepteur). Le fragment A catalyse l'ADP-ribosylation NAD+-dépendante du facteur d'élongation 2, inhibant ainsi la synthèse protéique dans les cellules eucaryotes. Le fragment B se lie à un récepteur de surface cellulaire et facilite l'acheminement du fragment A vers le cytosol.
L'immunité protectrice implique la réponse anticorps à la toxine diphtérique après une maladie clinique ou à la toxine diphtérique (toxine inactivée par le formaldéhyde) après l'immunisation.
Colonisation
On sait peu de choses sur les facteurs qui interviennent dans la colonisation de C. diphtheriae. Cependant, il est clair que d'autres facteurs que la production de toxine diphtérique contribuent à la virulence. Des études épidémiologiques ont montré qu'un lysotype donné peut persister dans une population pendant de longues périodes. Il peut ensuite être remplacé par un autre lysotype. L'émergence et la dominance ultérieure d'un nouveau lysotype dans une population sont vraisemblablement liées à sa capacité à coloniser et à concurrencer efficacement son segment de la niche écologique nasopharyngée. Corynebacterium diphtheriae peut produire de la neuraminidase, qui clive l'acide sialique de surface cellulaire en ses composants pyruvate et acide N-acétylneuraminique. Le facteur cordon (6,6'-di-O-mycoloyl-α, α'-D-tréhalose) est un composant de surface de C. diphtheriae, mais son rôle dans la colonisation de l'hôte humain n'est pas clair.
Production de toxines diphtériques
Le gène de structure de la toxine diphtérique, tox, appartient à une famille de corynébactériophages étroitement apparentés, dont le β-phage est le mieux étudié. La régulation de l'expression de la toxine diphtérique est assurée par un répresseur activé par le fer, DtxR, codé par le génome de C. diphtheriae. L'expression de la toxine dépend de l'état physiologique de C. diphtheriae. Dans des conditions où le fer devient le substrat limitant la croissance, le fer se dissocie de DtxR, le gène du toxicodendron est activé et la toxine diphtérique est synthétisée et sécrétée dans le milieu de culture à des taux maximaux.
La toxine diphtérique est exceptionnellement puissante; pour les espèces sensibles (humains, singes, lapins, cobayes, etc.), une dose aussi faible que 100 à 150 ng/kg de poids corporel est mortelle. La toxine diphtérique est constituée d'une seule chaîne polypeptidique de 535 acides aminés. Les analyses biochimiques, génétiques et structurales aux rayons X montrent que la toxine est constituée de trois domaines structuraux et fonctionnels:
- ADP-ribosyltransférase N-terminale (domaine catalytique);
- une région qui facilite la délivrance du domaine catalytique à travers la membrane cellulaire (domaine transmembranaire);
- domaine de liaison au récepteur des cellules eucaryotes.
Après une digestion modérée à la trypsine et une réduction en conditions dénaturantes, la toxine diphtérique peut être clivée spécifiquement au niveau de sa boucle sensible à la protéase en deux fragments polypeptidiques (A et B). Le fragment A est le composant N-terminal de 21 kDa de la toxine et contient le site catalytique de l'ADP-ribosylation du facteur d'élongation 2 (EF-2).
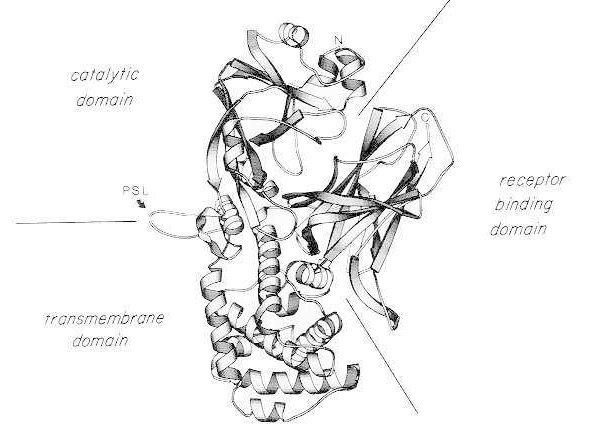
Diagramme en ruban de la structure cristalline aux rayons X de la toxine diphtérique native monomérique. (Modifié d'après Bennett MJ, Choe S, Eisenberg D: Domain swapping: Entangling aliances between proteins. Proc Natl Acad Sci, USA, 91: 3127, 1994). Les positions relatives des domaines catalytique, transmembranaire et de liaison au récepteur sont indiquées. La toxine intacte peut être clivée par des protéases de type trypsine au niveau d'Arg190, Arg192 et/ou Arg193, situées dans la boucle sensible aux protéases (PSL). Après réduction du pont disulfure entre Cys186 et Cys201, la toxine peut être divisée en fragments A et B. L'extrémité amino-terminale (N) et l'extrémité carboxy-terminale (C) de la toxine intacte sont indiquées. Le diagramme en ruban a été créé à l'aide du programme MOLESCRIPT.
Le fragment C-terminal, fragment B, porte les domaines transmembranaires et de liaison au récepteur de la toxine.
L’empoisonnement d’une seule cellule eucaryote par la toxine diphtérique implique au moins quatre étapes distinctes:
- liaison de la toxine à son récepteur à la surface cellulaire;
- regroupement de récepteurs chargés dans des puits recouverts et internalisation de la toxine via une endocytose médiée par le récepteur; suite à l'acidification de la vésicule endocytique par une pompe à protons associée à la membrane et pilotée par l'ATP,
- insertion du domaine transmembranaire dans la membrane et délivrance facilitée du domaine catalytique dans le cytosol, et
- ADP-ribosylation de l'EF-2, entraînant une suppression irréversible de la synthèse des protéines.
Il a été démontré qu’une seule molécule du domaine catalytique délivrée dans le cytosol suffit à être mortelle pour la cellule.
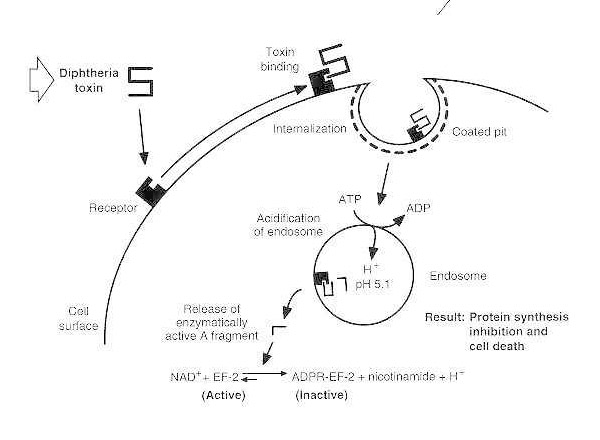
Schéma de l'intoxication diphtérique d'une cellule eucaryote sensible.
La toxine se lie à son récepteur de surface cellulaire et est internalisée via une endocytose médiée par le récepteur; lors de l'acidification de l'endosome, le domaine transmembranaire est inséré dans la membrane de la vésicule; le domaine catalytique est délivré au cytosol, entraînant une inhibition de la synthèse des protéines et la mort cellulaire.
Épidémiologie
Avant la vaccination de masse de la population américaine par l'anatoxine diphtérique, la diphtérie était généralement une maladie infantile. Un aspect remarquable de la vaccination de masse par l'anatoxine diphtérique est que, à mesure que le pourcentage de la population bénéficiant d'un niveau d'immunité antitoxinique protecteur (≥ 0,01 UI/mL) augmente, la fréquence d'isolement de souches toxigènes diminue. Aujourd'hui, aux États-Unis, où la diphtérie clinique a presque totalement disparu, l'isolement de souches toxigènes de C. diphtheriae est rare. L'infection subclinique n'étant plus une source d'exposition à l'antigène diphtérique et, à moins d'être renforcée, l'immunité antitoxinique diminue, un pourcentage important d'adultes (30 à 60 %) présentent des niveaux d'antitoxine inférieurs aux niveaux protecteurs et sont à risque. Aux États-Unis, en Europe et en Europe de l'Est, les récentes épidémies de diphtérie ont principalement touché des personnes consommant de l'alcool et/ou des drogues. Au sein de ce groupe, les porteurs de C. diphtheriae toxinogène présentent un niveau d'immunité antitoxique modérément élevé. La récente défaillance des mesures de santé publique en Russie a transformé la diphtérie en épidémie. Fin 1994, plus de 80 000 cas et plus de 2 000 décès avaient été recensés en Russie.
Les épidémies focales de diphtérie sont presque toujours associées à un porteur immun revenant d'une région où la diphtérie est endémique. De fait, de récentes épidémies de diphtérie clinique aux États-Unis et en Europe ont été associées à des voyageurs revenant de Russie et d'Europe de l'Est. Les souches toxigènes de C. diphtheriae se transmettent directement d'une personne à l'autre par des gouttelettes en suspension dans l'air. Il est connu que les souches toxigènes peuvent coloniser directement la cavité nasopharyngée. De plus, le gène toxigène peut se propager indirectement par la libération de corynébactériophages toxigènes et la transformation lysogène in situ de C. diphtheriae autochtones non toxigènes. [ 5 ]
Outre la détermination du biotype et du lysotype des isolats de C. diphtheriae, des techniques de biologie moléculaire peuvent désormais être utilisées pour étudier les épidémies de diphtérie. Les profils de digestion de l'ADN chromosomique de C. diphtheriae par endonucléase de restriction ont été utilisés pour étudier les épidémies cliniques, tout comme l'utilisation de séquences d'insertion de corynébactéries clonées comme sonde génétique.
Le test de Schick est utilisé depuis de nombreuses années pour évaluer l'immunité à la toxine diphtérique, bien qu'il ait été remplacé dans de nombreuses régions par le test sérologique de détection des anticorps spécifiques à la toxine diphtérique. Dans le test de Schick, une petite quantité de toxine diphtérique (environ 0,8 ng dans 0,2 ml) est injectée par voie intradermique dans l'avant-bras (zone de test) et 0,0124 μg de toxine diphtérique dans 0,2 ml est injecté par voie intradermique dans la zone témoin. Les mesures sont effectuées à 48 et 96 heures. Les réactions cutanées non spécifiques atteignent généralement leur maximum à 48 heures. À 96 heures, une réaction érythémateuse avec une possible nécrose au site de test indique une immunité antitoxique insuffisante pour neutraliser la toxine (≤ 0,03 UI/ml). Une inflammation dans les zones de test et de contrôle après 48 heures indique une réaction d'hypersensibilité à la préparation antigénique.
Formes
Corynebacterium diphtheriae infecte le nasopharynx ou la peau. Les souches toxinogènes produisent une exotoxine puissante pouvant provoquer la diphtérie. Les symptômes de la diphtérie comprennent une pharyngite, de la fièvre et un gonflement du cou ou de la zone entourant la lésion cutanée. Les lésions diphtériques sont recouvertes d'une pseudomembrane. La toxine se propage par voie sanguine vers des organes distants et peut provoquer une paralysie et une insuffisance cardiaque congestive. [ 6 ]
Il existe deux types de diphtérie clinique: nasopharyngée et cutanée. Les symptômes de la diphtérie pharyngée vont d'une pharyngite légère à une hypoxie due à l'obstruction des voies respiratoires par une pseudomembrane. L'atteinte des ganglions lymphatiques cervicaux peut provoquer un gonflement important du cou (diphtérie à cou de taureau) et le patient peut développer de la fièvre (≥ 39 °C). Les lésions cutanées de la diphtérie cutanée sont généralement recouvertes d'une pseudomembrane gris-brun. Des complications systémiques potentiellement mortelles, principalement une perte de la fonction motrice (par exemple, des difficultés à avaler) et une insuffisance cardiaque congestive, peuvent survenir suite à l'action de la toxine diphtérique sur les motoneurones périphériques et le myocarde.
Contrôle
La lutte contre la diphtérie repose sur une immunisation adéquate par l'anatoxine diphtérique: une toxine diphtérique inactivée par le formaldéhyde, qui reste antigéniquement intacte. L'anatoxine est préparée par incubation de la toxine diphtérique avec du formaldéhyde à 37 °C en milieu alcalin. La vaccination antidiphtérique doit débuter dès le deuxième mois de vie par une série de trois doses primaires à 4 à 8 semaines d'intervalle, suivies d'une quatrième dose environ un an après la dernière dose primaire. L'anatoxine diphtérique est largement utilisée comme composant du vaccin diphtérie-tétanos-coqueluche (DTC). Des études épidémiologiques ont montré une efficacité d'environ 97 % de la vaccination contre la diphtérie. Bien que la vaccination de masse contre la diphtérie soit pratiquée aux États-Unis et en Europe et que les taux de vaccination infantile soient satisfaisants, une grande partie de la population adulte peut présenter des titres d'anticorps inférieurs aux niveaux protecteurs. Les adultes doivent être revaccinés par l'anatoxine diphtérique tous les 10 ans. Français En effet, une vaccination de rappel avec l'anatoxine diphtérique-tétanique devrait être administrée aux voyageurs se rendant dans des zones à taux élevés de diphtérie endémique (Amérique centrale et du Sud, Afrique, Asie, Russie et Europe de l'Est). Ces dernières années, l'utilisation de préparations d'anatoxines hautement purifiées pour la vaccination a minimisé les réactions d'hypersensibilité graves occasionnelles. Une vaccination de rappel avec l'anatoxine diphtérique-tétanique devrait être administrée aux voyageurs se rendant dans des zones à taux élevés de diphtérie endémique (Amérique centrale et du Sud, Afrique, Asie, Russie et Europe de l'Est). Ces dernières années, l'utilisation de préparations d'anatoxines hautement purifiées pour la vaccination a minimisé les réactions d'hypersensibilité graves occasionnelles.
Bien que des antibiotiques (tels que la pénicilline et l'érythromycine) soient utilisés dans le traitement des patients atteints de diphtérie, l'immunisation passive rapide avec l'antitoxine diphtérique est la plus efficace pour réduire la mortalité. La longue demi-vie de l'antitoxine spécifique dans la circulation sanguine est un facteur important pour assurer une neutralisation efficace de la toxine diphtérique; cependant, pour être efficace, l'antitoxine doit réagir avec la toxine avant de pouvoir pénétrer dans la cellule.
Réingénierie de la toxine diphtérique pour le développement de cytotoxines spécifiques des récepteurs eucaryotes
L'ingénierie des protéines est un domaine nouveau et en plein essor de la biologie moléculaire. Elle combine les méthodes d'ADN recombinant et la synthèse d'ADN en phase solide pour concevoir et construire des gènes chimériques dont les produits possèdent des propriétés uniques. Des études sur les relations structure-fonction de la toxine diphtérique ont clairement démontré que cette toxine est une protéine à trois domaines: catalytique, transmembranaire et récepteur. Il a été possible de remplacer génétiquement le domaine de liaison au récepteur natif de la toxine diphtérique par diverses hormones polypeptidiques et cytokines (par exemple, l'α-mélanostimuline [α-MSH], l'interleukine (IL) 2, l'IL-4, l'IL-6, l'IL-7, le facteur de croissance épidermique). Les protéines chimériques ou toxines de fusion obtenues associent la spécificité de liaison au récepteur de la cytokine aux domaines transmembranaire et catalytique de la toxine. Dans chaque cas, les toxines de fusion se sont avérées empoisonner sélectivement uniquement les cellules porteuses du récepteur cible correspondant. La première de ces toxines de fusion génétiquement modifiées, DAB 389IL-2, est actuellement évaluée dans des essais cliniques humains pour le traitement des lymphomes réfractaires et des maladies auto-immunes dans lesquelles les cellules dotées de récepteurs IL-2 à haute affinité jouent un rôle important dans la pathogenèse.[ 7 ] L'administration de DAB 389 IL-2 s'est avérée sûre, bien tolérée et capable d'induire une rémission durable de la maladie sans effets secondaires graves. Il est probable que les toxines de fusion à base de toxine diphtérique deviendront de nouveaux agents biologiques importants pour le traitement de tumeurs ou de maladies spécifiques dans lesquelles des récepteurs de surface cellulaire spécifiques peuvent être ciblés.


 [
[