Expert médical de l'article
Nouvelles publications
Pathogenèse de l'hépatite B
Dernière revue: 07.07.2025

Tout le contenu iLive fait l'objet d'un examen médical ou d'une vérification des faits pour assurer autant que possible l'exactitude factuelle.
Nous appliquons des directives strictes en matière d’approvisionnement et ne proposons que des liens vers des sites de médias réputés, des instituts de recherche universitaires et, dans la mesure du possible, des études évaluées par des pairs sur le plan médical. Notez que les nombres entre parenthèses ([1], [2], etc.) sont des liens cliquables vers ces études.
Si vous estimez qu'un contenu quelconque de notre contenu est inexact, obsolète ou discutable, veuillez le sélectionner et appuyer sur Ctrl + Entrée.
Dans la pathogénèse de l’hépatite B, plusieurs maillons majeurs de la chaîne pathogénique peuvent être identifiés:
- introduction de l'agent pathogène - infection;
- fixation sur l'hépatocyte et pénétration dans la cellule;
- multiplication du virus et sa « poussée » vers la surface de l’hépatocyte, ainsi que dans le sang;
- activation de réactions immunologiques visant à éliminer l’agent pathogène;
- lésions des complexes immuns aux organes et aux systèmes;
- formation de l'immunité, libération du pathogène, guérison.
L'infection par le virus de l'hépatite B se produisant toujours par voie parentérale, on peut considérer que le moment de l'infection correspond pratiquement à la pénétration du virus dans le sang. Les tentatives de certains chercheurs visant à distinguer les phases entérale et régionale de l'hépatite B sont peu étayées. Il existe davantage de raisons de penser que le virus pénètre immédiatement dans le foie par la circulation sanguine.
Le tropisme du virus de l'hépatite B au tissu hépatique est déterminé par la présence d'un récepteur spécifique dans l'HBsAg, un polypeptide de poids moléculaire de 31 000 Da (P31), doté d'une activité de liaison à l'albumine. Une zone d'albumine similaire est également présente sur la membrane des hépatocytes hépatiques humains et chimpanzés, ce qui détermine essentiellement le tropisme du VHB au foie des humains et des chimpanzés.
Lorsque le virus pénètre dans l'hépatocyte, l'ADN viral est libéré. Ce dernier, pénétrant dans le noyau de l'hépatocyte et servant de matrice à la synthèse des acides nucléiques, déclenche une série de réactions biologiques successives aboutissant à l'assemblage de la nucléocapside du virus. Cette dernière migre à travers la membrane nucléaire jusqu'au cytoplasme, où se produit l'assemblage final des particules de Dane – le virus complet de l'hépatite B.
Il convient toutefois de noter que lorsqu'un hépatocyte est infecté, le processus peut se dérouler de deux manières: réplicative et intégrative. Dans le premier cas, on observe une hépatite aiguë ou chronique, et dans le second, un portage du virus.
Les raisons qui déterminent les deux types d'interaction entre l'ADN viral et les hépatocytes n'ont pas été précisément établies. Le type de réponse est très probablement déterminé génétiquement.
Le résultat de l'interaction réplicative est l'assemblage des structures antigéniques centrales (dans le noyau) et l'assemblage du virus complet (dans le cytoplasme), suivi de la présentation du virus complet ou de ses antigènes sur la membrane ou dans la structure de la membrane hépatocytaire.
Il est généralement admis que la réplication virale n'entraîne pas de lésions cellulaires au niveau hépatocytaire, le virus de l'hépatite B n'ayant pas d'effet cytopathique. Cette affirmation ne peut être considérée comme indiscutable, car elle repose sur des données expérimentales qui, bien qu'indiquant l'absence d'effet cytopathique du virus de l'hépatite B, ont été obtenues sur des cultures tissulaires et ne peuvent donc pas être totalement extrapolées à l'hépatite virale B chez l'homme. Quoi qu'il en soit, la question de l'absence de lésions hépatocytaires pendant la phase réplicative nécessite des études complémentaires.
Cependant, quelle que soit la nature de l'interaction du virus avec la cellule, le foie est nécessairement impliqué dans le processus immunopathologique. Dans ce cas, les lésions hépatocytaires sont liées au fait que, suite à l'expression d'antigènes viraux sur la membrane hépatocytaire et à leur libération dans la circulation sanguine, une chaîne de réactions immunitaires cellulaires et humorales séquentielles est déclenchée, visant à éliminer le virus de l'organisme. Ce processus se déroule en totale conformité avec les schémas généraux de la réponse immunitaire aux infections virales. Pour éliminer l'agent pathogène, des réactions cytotoxiques cellulaires sont mises en œuvre, médiées par différentes classes de cellules effectrices: lymphocytes K, lymphocytes T, cellules tueuses naturelles, macrophages. Au cours de ces réactions, les hépatocytes infectés sont détruits, ce qui s'accompagne de la libération d'antigènes viraux (HBcAg, HBeAg, HBsAg), qui déclenchent le système de genèse des anticorps, entraînant l'accumulation d'anticorps spécifiques dans le sang, principalement dirigés contre les antigènes core (anti-HBc) et e (anti-HBE). Par conséquent, la libération de la cellule hépatique du virus se produit au cours de son processus de mort en raison des réactions de cytolyse cellulaire.
Parallèlement, les anticorps spécifiques accumulés dans le sang se lient aux antigènes viraux, formant des complexes immuns phagocytés par les macrophages et excrétés par les reins. Dans ce cas, diverses lésions des complexes immuns peuvent survenir, telles que glomérulonéphrite, artérite, arthralgie, éruptions cutanées, etc. Grâce à ces anticorps spécifiques, l'organisme est débarrassé de l'agent pathogène et la guérison complète s'opère.
Conformément au concept de pathogenèse de l'hépatite B, la diversité des variantes cliniques de la maladie s'explique généralement par les particularités de l'interaction du virus et de la coopération des cellules immunocompétentes, autrement dit par la force de la réponse immunitaire à la présence d'antigènes viraux. Selon les concepts modernes, la force de la réponse immunitaire est génétiquement déterminée et liée aux antigènes d'histocompatibilité du locus HLA de première classe.
Il est généralement admis qu'en présence d'une réponse immunitaire adéquate aux antigènes viraux, l'hépatite aiguë se développe cliniquement selon une évolution cyclique et une guérison complète. Dans le contexte d'une diminution de la réponse immunitaire aux antigènes viraux, la cytolyse à médiation immunitaire est insignifiante; par conséquent, l'élimination des cellules hépatiques infectées est inexistante, ce qui entraîne des manifestations cliniques bénignes avec une persistance prolongée du virus et, éventuellement, le développement d'une hépatite chronique. À l'inverse, en cas de forte réponse immunitaire génétiquement déterminée et d'infection massive (hémotransfusion), de vastes zones de lésions des cellules hépatiques apparaissent, correspondant cliniquement à des formes graves et malignes de la maladie.
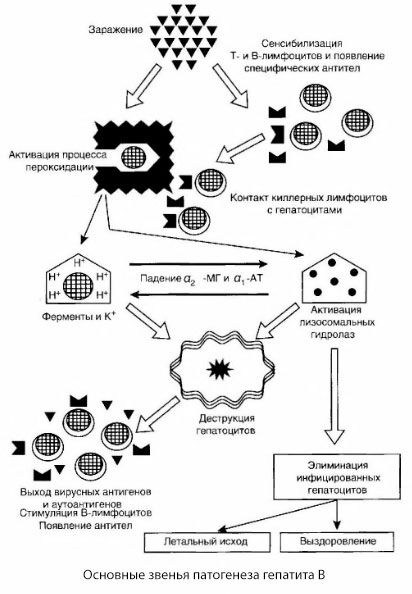
Le schéma présenté de la pathogénèse de l'hépatite B se distingue par sa cohérence; cependant, il contient un certain nombre de points controversés et peu étudiés.
Si l'on considère l'hépatite B comme une maladie immunopathologique, on peut s'attendre à une augmentation des réactions de cytotoxicité cellulaire avec la gravité de la maladie. Cependant, dans les formes sévères, les indices du lien cellulaire de l'immunité sont fortement réduits, avec notamment une chute multiple, par rapport à ceux des enfants sains, ainsi que l'indice de cytotoxicité des cellules K. Dans la forme maligne, pendant la période de développement d'une nécrose hépatique massive et surtout d'un coma hépatique, on observe une incapacité totale des lymphocytes à se transformer en blastes sous l'influence de la phytohématlutinine, de l'endotoxine staphylococcique et de l'HBsAg. De plus, les leucocytes ne migrent pas selon la réaction d'inhibition de la migration leucocytaire (LMIC), et une forte augmentation de la perméabilité des membranes lymphocytaires est révélée selon les résultats de leurs études utilisant une sonde fluorescente à la tétracycline.
Ainsi, si les indices de fluorescence des lymphocytes chez les personnes saines sont de 9,9 ± 2 %, et qu'ils atteignent 22,3 ± 2,7 % dans l'hépatite B typique d'évolution bénigne, le nombre de lymphocytes fluorescents atteint en moyenne 63,5 ± 5,8 % dans les formes malignes. L'augmentation de la perméabilité des membranes cellulaires étant clairement considérée dans la littérature comme un indicateur fiable de leur infériorité fonctionnelle, on peut conclure qu'avec l'hépatite B, en particulier dans sa forme maligne, les lymphocytes sont gravement endommagés. Ceci est également démontré par les indices de cytotoxicité des cellules K. Dans la forme sévère, à la 1ère-2ème semaine de la maladie, la cytotoxicité est de 15,5±8,8%, et dans la forme maligne à la 1ère semaine - 6,0±2,6, à la 2ème - 22,0±6,3% avec une norme de 44,8±2,6%.
Les données présentées indiquent clairement des perturbations prononcées dans le lien cellulaire de l'immunité chez les patients atteints de formes sévères d'hépatite B. Il est également évident que ces changements se produisent secondairement, à la suite de dommages aux cellules immunocompétentes par des métabolites toxiques et, éventuellement, des complexes immuns circulants.
Comme l'ont montré des études, chez les patients atteints de formes sévères d'hépatite B, notamment en cas de développement d'une nécrose hépatique massive, le titre d'HBsAg et d'HBeAg dans le sérum sanguin diminue et en même temps, des anticorps dirigés contre l'antigène de surface commencent à être détectés à des titres élevés, ce qui est totalement inhabituel pour les formes bénignes de la maladie, dans lesquelles les anti-VHB n'apparaissent qu'au cours des 3e à 5e mois de la maladie.
La disparition rapide des antigènes du virus de l'hépatite B avec l'apparition simultanée de titres élevés d'anticorps antiviraux suggère la formation intensive de complexes immuns et leur participation possible à la pathogenèse du développement d'une nécrose hépatique massive.
Ainsi, les éléments factuels ne permettent pas d'interpréter sans ambiguïté l'hépatite B uniquement du point de vue de l'agression immunopathologique. Le problème n'est pas seulement qu'aucun lien n'a été établi entre la profondeur et la prévalence des modifications morphologiques hépatiques, d'une part, et la gravité des facteurs d'immunité cellulaire, d'autre part. Théoriquement, cette situation pourrait s'expliquer par les stades tardifs de l'étude des indicateurs d'immunité cellulaire, lorsque les cellules immunocompétentes ont été soumises à de puissants effets toxiques en raison d'une insuffisance fonctionnelle hépatique croissante. Bien entendu, on peut supposer que la cytolyse immunitaire des hépatocytes survient aux premiers stades du processus infectieux, peut-être même avant l'apparition des symptômes cliniques d'une atteinte hépatique grave. Cependant, une telle hypothèse est peu probable, car des indicateurs similaires d'immunité cellulaire ont été détectés chez des patients présentant l'évolution la plus aiguë (éclair) de la maladie et, de plus, lors de l'examen morphologique du tissu hépatique, aucune infiltration lymphocytaire massive n'a été détectée, tandis qu'en même temps, des champs continus d'épithélium nécrotique ont été détectés sans phénomènes de résorption et d'agression lymphocytaire.
Il est très difficile d'expliquer le tableau morphologique de l'hépatite aiguë uniquement du point de vue de la cytolyse cellulaire immunitaire, c'est pourquoi, dans les premières études, l'effet cytotoxique du virus de l'hépatite B n'a pas été exclu.
Actuellement, cette hypothèse a été partiellement confirmée par la découverte du virus de l'hépatite B. Des études ont montré que la fréquence de détection des marqueurs de l'hépatite D dépend directement de la gravité de la maladie: dans les formes légères, ils sont détectés chez 14 % des patients, modérés chez 18 %, sévères chez 30 % et malignes chez 52 %. Étant donné que le virus de l'hépatite D a un effet cytopathique nécrosogène, il peut être considéré comme établi que la co-infection par les virus de l'hépatite B et D joue un rôle important dans le développement des formes fulminantes de l'hépatite B.
La pathogénèse de l'hépatite B peut être présentée comme suit. Après la pénétration du virus de l'hépatite B dans les hépatocytes, une attaque immunologique des hépatocytes infectés est induite par les lymphocytes T tueurs, qui sécrètent des lymphotoxines en direction des cellules hépatiques.
Les mécanismes intimes des lésions hépatocytaires dans l'hépatite B n'ont pas encore été établis. Le rôle principal est joué par les processus activés de peroxydation lipidique et d'hydrolases lysosomales. Le déclencheur pourrait être les lymphotoxines libérées par les cellules effectrices au contact des hépatocytes, mais il est possible que le virus lui-même soit à l'origine des processus de peroxydation. Par la suite, le processus pathologique se développe très probablement selon la séquence suivante.
- Interaction du facteur d'agression (lymphotoxines ou virus) avec des macromolécules biologiques (éventuellement avec des composants des membranes du réticulum endoplasmique capables de participer aux processus de détoxification, par analogie avec d'autres agents nocifs, comme cela a été démontré en relation avec le tétrachlorure de carbone).
- Formation de radicaux libres, activation des processus de peroxydation lipidique et augmentation de la perméabilité de toutes les membranes hépatocellulaires (syndrome de cytolyse).
- Mouvement de substances biologiquement actives le long du gradient de concentration - perte d'enzymes de diverses localisations intracellulaires, donneurs d'énergie, potassium, etc. Accumulation de sodium et de calcium dans les cellules, déplacement du pH vers l'acidose intracellulaire.
- Activation et libération d'hydrolases lysosomales (ARNase, ADNase, cathepsines, etc.) avec dégradation des cellules hépatiques et libération d'autoantigènes.
- Stimulation des systèmes immunitaires T et B avec formation d'une sensibilisation spécifique des lymphocytes T à la lipoprotéine hépatique, ainsi que formation d'autoanticorps humoraux antihépatiques.
Dans le schéma proposé de la pathogenèse de l'hépatite B, le facteur déclenchant est constitué par les antigènes viraux, dont la production intensive est observée aux premiers stades de la maladie et tout au long de la période aiguë, à l'exception des formes malignes, dans lesquelles la production d'antigènes viraux cesse pratiquement au moment du développement d'une nécrose hépatique massive, ce qui prédétermine une diminution rapide de la réplication virale.
Il est également évident que les antigènes viraux activent les systèmes immunitaires T et B. Au cours de ce processus, une redistribution caractéristique des sous-populations de lymphocytes T se produit, visant à organiser une réponse immunitaire adéquate, à éliminer les hépatocytes infectés, à neutraliser les antigènes viraux, à favoriser la sanogenèse et à guérir.
Lorsque les cellules immunocompétentes interagissent avec les antigènes viraux sur les membranes des hépatocytes ou lors de la reproduction du virus à l'intérieur d'un hépatocyte, les conditions se créent pour l'activation des processus de peroxydation lipidique, qui, comme on le sait, contrôlent la perméabilité de toutes les membranes cellulaires et subcellulaires.
De ce point de vue, on comprend mieux l'apparition du syndrome de cytolyse, une perméabilité accrue des membranes cellulaires, si naturelle et si caractéristique de l'hépatite virale.
Le résultat final du syndrome de cytolyse peut être un découplage complet de la phosphorylation oxydative, une fuite de matériel cellulaire et la mort du parenchyme hépatique.
Cependant, dans la grande majorité des cas, ces processus n'évoluent pas de manière aussi fatale. Seules les formes malignes de la maladie entraînent une évolution irréversible et progressive, caractérisée par une infection massive, un processus immunitaire prononcé, une activation excessive des processus de peroxydation et des hydrodases lysosomales, ainsi que des phénomènes d'agression auto-immune.
Les mêmes mécanismes sont observés dans l'évolution favorable de l'hépatite B, avec la seule particularité qu'ils se produisent tous à un niveau qualitativement différent. Contrairement aux cas de nécrose hépatique massive, dans l'évolution favorable de la maladie, le nombre d'hépatocytes infectés, et donc la zone de cytolyse immunopathologique, est plus faible; les processus de peroxydation lipidique ne sont pas aussi significativement intensifiés; l'activation des hydrolases acides n'entraîne qu'une autolyse limitée avec une libération insignifiante d'autoantigènes, et donc, sans auto-agression massive. Autrement dit, toutes les étapes de la pathogenèse dans l'évolution favorable se déroulent dans le cadre de l'organisation structurale préservée du parenchyme hépatique et sont freinées par des systèmes de défense (antioxydants, inhibiteurs, etc.) et n'ont donc pas d'effet destructeur.
Les causes des symptômes d'intoxication dans l'hépatite virale n'ont pas été entièrement étudiées. La distinction entre l'intoxication primaire, ou virale, et l'intoxication secondaire (échangeuse ou métabolique) peut être considérée comme positive, bien que cela ne révèle pas le mécanisme précis de l'apparition du syndrome toxique général. Premièrement, les virus de l'hépatite ne possèdent pas de propriétés toxiques et, deuxièmement, la concentration de nombreux métabolites n'est pas toujours corrélée à la gravité de la maladie et à l'intensité des symptômes de toxicose. Il est également connu que la concentration d'antigènes viraux n'est pas strictement corrélée à la gravité de l'intoxication. Au contraire, avec l'augmentation de la gravité de la maladie, et donc de l'intensité de la toxicose, la concentration d'HBsAg diminue et atteint son niveau le plus bas dans les formes malignes au moment de l'apparition du coma hépatique profond. Parallèlement, la fréquence de détection et les titres d'anticorps antiviraux spécifiques dépendent directement de la gravité de la maladie.
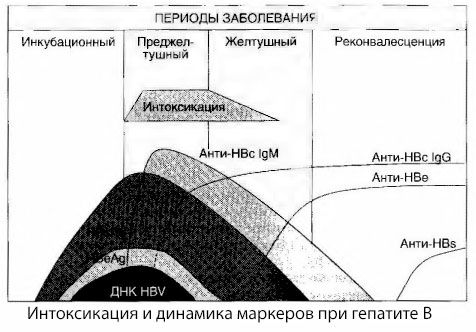
L'intoxication n'apparaît pas au moment de l'enregistrement des antigènes viraux, mais pendant la période de circulation dans le sang des anticorps antiviraux de classe IgM dirigés contre l'antigène de la vache et l'antigène du système E. De plus, dans les formes sévères et particulièrement malignes, une proportion importante de patients ont même des anti-HBs dans le sang, ce qui n'est généralement jamais observé dans les formes légères et modérées de la maladie.
Les données présentées permettent de conclure que le syndrome de toxicose dans l'hépatite virale, et plus particulièrement l'hépatite B, ne résulte pas de l'apparition d'antigènes viraux dans le sang, mais de l'interaction de ces antigènes avec des anticorps antiviraux de classe IgM. Cette interaction entraîne, comme on le sait, la formation de complexes immuns et, éventuellement, de substances toxiques actives.
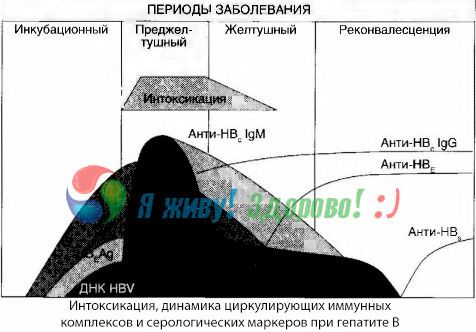
Les symptômes d'intoxication apparaissent au moment de l'apparition des complexes immuns en libre circulation, mais par la suite une telle corrélation n'est pas observée.
Une explication partielle à ce phénomène réside dans l'étude de la composition des complexes immuns. Chez les patients atteints de formes sévères, ce sont principalement des complexes de taille moyenne qui circulent dans le sang et, au plus fort du syndrome toxique, ce sont les anticorps de cette classe qui prédominent. En revanche, pendant la période de déclin des manifestations cliniques et de convalescence, les complexes deviennent plus volumineux et les anticorps de la classe IgG commencent à prédominer.
Les données présentées concernent les mécanismes de développement du syndrome toxique dans la période initiale de la maladie, mais dans la toxicose survenant au plus fort des manifestations cliniques, elles n'ont qu'une signification partielle, et notamment dans le développement du coma hépatique.
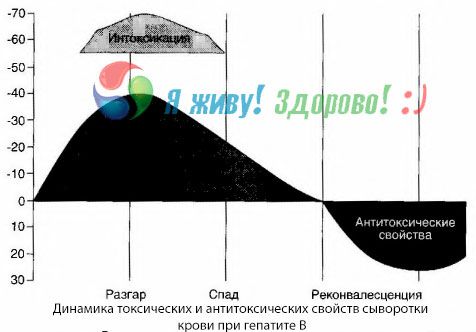
La méthode des hémocultures a montré qu'en cas d'hépatite B, des toxines s'accumulent constamment dans le sang, libérées par le tissu hépatique endommagé et en décomposition. La concentration de ces toxines est proportionnelle à la gravité de la maladie; elles sont de nature protéique.
Pendant la période de récupération, des anticorps contre cette toxine apparaissent dans le sang; mais en cas de coma hépatique, la concentration de la toxine dans le sang augmente fortement et les anticorps ne sont pas détectés dans le sang.
Pathomorphologie de l'hépatite B
En fonction de la nature des modifications morphologiques, on distingue trois formes d’hépatite B aiguë:
- forme cyclique,
- nécrose hépatique massive;
- hépatite péricholangiolytique cholestatique.
Dans la forme cyclique de l'hépatite B, les modifications dystrophiques, inflammatoires et prolifératives sont plus prononcées au centre des lobules, tandis que dans l'hépatite A, elles sont localisées à la périphérie du lobule et se propagent vers le centre. Ces différences s'expliquent par des voies de pénétration différentes du virus dans le parenchyme hépatique. Le virus de l'hépatite A pénètre dans le foie par la veine porte et se propage jusqu'au centre des lobules, tandis que le virus de l'hépatite B pénètre par l'artère hépatique et les branches capillaires qui irriguent uniformément tous les lobules, jusqu'à leur centre.
Le degré d'atteinte du parenchyme hépatique correspond dans la plupart des cas à la gravité des manifestations cliniques de la maladie. Dans les formes légères, on observe généralement une nécrose focale des hépatocytes, et dans les formes modérées et sévères, une nécrose zonale (avec tendance à fusionner et à former une nécrose en pont dans les formes sévères de la maladie).
Les modifications morphologiques les plus importantes du parenchyme sont observées au plus fort des manifestations cliniques, ce qui coïncide généralement avec la première décennie de la maladie. Au cours de la deuxième et surtout de la troisième décennie, les processus de régénération s'intensifient. À ce stade, les modifications nécrobiotiques disparaissent presque complètement et les processus d'infiltration cellulaire commencent à prédominer, suivis d'une lente restauration de la structure des plaques hépatocellulaires. Cependant, la restauration complète de la structure et de la fonction du parenchyme hépatique n'intervient que 3 à 6 mois après le début de la maladie, et pas chez tous les patients.
Le caractère généralisé de l'infection dans l'hépatite B est confirmé par la détection de l'HBsAg non seulement dans les hépatocytes, mais aussi dans les reins, les poumons, la rate, le pancréas, les cellules de la moelle osseuse, etc.
L'hépatite cholestatique (péricholangiolytique) est une forme particulière de la maladie, caractérisée par des modifications morphologiques importantes au niveau des voies biliaires intrahépatiques, avec un tableau de cholangiolite et de péricholangiolite. Dans la forme cholestatique, la cholestase se caractérise par une dilatation des capillaires biliaires avec stase biliaire, une prolifération de cholangioles et d'infiltrats cellulaires environnants. Les cellules hépatiques sont peu affectées dans cette forme d'hépatite. Cliniquement, la maladie se caractérise par une évolution prolongée avec un ictère persistant. Il a été démontré que la cause de cette évolution particulière de la maladie est l'effet prédominant du virus sur les parois des cholangioles, avec un effet négligeable sur les hépatocytes.

