Expert médical de l'article
Nouvelles publications
Synthèse, sécrétion et métabolisme des catécholamines
Dernière revue: 06.07.2025

Tout le contenu iLive fait l'objet d'un examen médical ou d'une vérification des faits pour assurer autant que possible l'exactitude factuelle.
Nous appliquons des directives strictes en matière d’approvisionnement et ne proposons que des liens vers des sites de médias réputés, des instituts de recherche universitaires et, dans la mesure du possible, des études évaluées par des pairs sur le plan médical. Notez que les nombres entre parenthèses ([1], [2], etc.) sont des liens cliquables vers ces études.
Si vous estimez qu'un contenu quelconque de notre contenu est inexact, obsolète ou discutable, veuillez le sélectionner et appuyer sur Ctrl + Entrée.
La médullosurrénale produit des composés dont la structure est différente de celle des stéroïdes. Ils contiennent un noyau 3,4-dihydroxyphényle (catéchol) et sont appelés catécholamines. Parmi ces composés figurent l'adrénaline, la noradrénaline et la dopamine bêta-hydroxytyramine.
La séquence de synthèse des catécholamines est assez simple: tyrosine → dihydroxyphénylalanine (DOPA) → dopamine → noradrénaline → adrénaline. La tyrosine pénètre dans l'organisme avec l'alimentation, mais peut également être synthétisée à partir de la phénylalanine dans le foie sous l'action de la phénylalanine hydroxylase. Les produits finaux de la conversion de la tyrosine dans les tissus sont différents. Dans la médullosurrénale, le processus se poursuit jusqu'à la formation d'adrénaline, dans les terminaisons des nerfs sympathiques, jusqu'à la noradrénaline. Dans certains neurones du système nerveux central, la synthèse des catécholamines aboutit à la formation de dopamine.
La conversion de la tyrosine en DOPA est catalysée par la tyrosine hydroxylase, dont les cofacteurs sont la tétrahydrobioptérine et l'oxygène. On pense que cette enzyme limite la vitesse de biosynthèse des catécholamines et est inhibée par les produits finaux de ce processus. La tyrosine hydroxylase est la principale cible des effets régulateurs sur la biosynthèse des catécholamines.
La conversion de la DOPA en dopamine est catalysée par l'enzyme DOPA décarboxylase (cofacteur: phosphate de pyridoxal), relativement non spécifique et décarboxylant d'autres acides aminés aromatiques. Cependant, certains éléments suggèrent la possibilité de modifier la synthèse des catécholamines en modifiant l'activité de cette enzyme. Certains neurones sont dépourvus d'enzymes permettant la conversion ultérieure de la dopamine, qui constitue le produit final. D'autres tissus contiennent de la dopamine bêta-hydroxylase (cofacteurs: cuivre, acide ascorbique et oxygène), qui convertit la dopamine en noradrénaline. Dans la médullosurrénale (mais pas dans les terminaisons des nerfs sympathiques), on trouve de la phényléthanolamine, une méthyltransférase qui forme de l'adrénaline à partir de la noradrénaline. Dans ce cas, la S-adénosylméthionine sert de donneur de groupes méthyles.
Il est important de rappeler que la synthèse de la phényléthanolamine-N-méthyltransférase est induite par les glucocorticoïdes pénétrant dans la médullosurrénale depuis le cortex via le système veineux porte. Ceci pourrait expliquer la combinaison de deux glandes endocrines différentes dans un même organe. L'importance des glucocorticoïdes pour la synthèse de l'adrénaline est soulignée par le fait que les cellules de la médullosurrénale qui produisent la noradrénaline sont situées autour des vaisseaux artériels, tandis que les cellules productrices d'adrénaline reçoivent principalement le sang des sinus veineux situés dans le cortex surrénalien.
La dégradation des catécholamines se produit principalement sous l'influence de deux systèmes enzymatiques: la catéchol-O-méthyltransférase (COMT) et la monoamine oxydase (MAO). Les principales voies de dégradation de l'adrénaline et de la noradrénaline sont schématiquement représentées sur la figure 54. Sous l'influence de la COMT et en présence du donneur de groupe méthyle S-adrénosylméthionine, les catécholamines sont converties en normétanéphrine et métanéphrine (dérivés 3-O-méthylés de la noradrénaline et de l'adrénaline), qui, sous l'influence de la MAO, sont converties en aldéhydes puis (en présence d'aldéhyde oxydase) en acide vanillylmandélique (VMA), principal produit de dégradation de la noradrénaline et de l'adrénaline. Dans le même cas, lorsque les catécholamines sont initialement exposées à la MAO plutôt qu'à la COMT, elles sont converties en aldéhyde 3,4-dioxomandélique, puis, sous l'influence de l'aldéhyde oxydase et de la COMT, en acide 3,4-dioxomandélique et en VMC. En présence d'alcool déshydrogénase, le 3-méthoxy-4-oxyphénylglycol, principal produit final de la dégradation de l'adrénaline et de la noradrénaline dans le SNC, peut être formé à partir des catécholamines.
La dégradation de la dopamine est similaire, sauf que ses métabolites n'ont pas de groupe hydroxyle sur l'atome de carbone bêta et, par conséquent, au lieu de l'acide vanillylmandélique, il se forme de l'acide homovanillique (HVA) ou de l'acide 3-méthoxy-4-hydroxyphénylacétique.
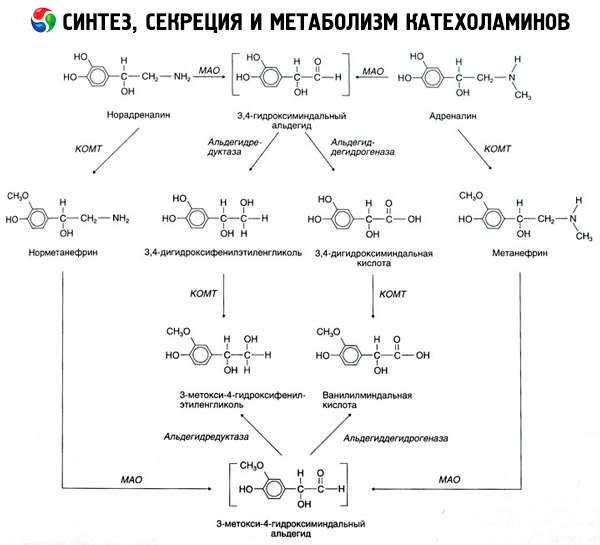
L'existence d'une voie quinoïde d'oxydation de la molécule de catécholamine, qui peut produire des produits intermédiaires à activité biologique prononcée, est également postulée.
La noradrénaline et l'adrénaline, formées sous l'action des enzymes cytosoliques des terminaisons nerveuses sympathiques et de la médullosurrénale, pénètrent dans les granules sécrétoires, les protégeant ainsi de l'action des enzymes de dégradation. La capture des catécholamines par les granules nécessite une dépense énergétique. Dans les granules chromaffines de la médullosurrénale, les catécholamines sont étroitement liées à l'ATP (dans un rapport de 4:1) et à des protéines spécifiques, les chromogranines, ce qui empêche la diffusion des hormones des granules vers le cytoplasme.
Le stimulus direct de la sécrétion de catécholamines est apparemment la pénétration du calcium dans la cellule, stimulant l'exocytose (fusion de la membrane des granules avec la surface cellulaire et leur rupture avec la libération complète du contenu soluble - catécholamines, dopamine bêta-hydroxylase, ATP et chromogranines - dans le liquide extracellulaire).
Effets physiologiques des catécholamines et leur mécanisme d'action
Les effets des catécholamines commencent par une interaction avec des récepteurs spécifiques des cellules cibles. Alors que les récepteurs des hormones thyroïdiennes et stéroïdiennes sont localisés à l'intérieur des cellules, ceux des catécholamines (ainsi que de l'acétylcholine et des hormones peptidiques) sont présents à la surface cellulaire.
Il est établi depuis longtemps que, pour certaines réactions, l'adrénaline ou la noradrénaline sont plus efficaces que l'isoprotérénol, une catécholamine synthétique, tandis que pour d'autres, l'effet de l'isoprotérénol est supérieur à celui de l'adrénaline ou de la noradrénaline. Sur cette base, un concept a été développé concernant la présence de deux types d'adrénorécepteurs dans les tissus: alpha et bêta, et dans certains cas, un seul de ces deux types peut être présent. L'isoprotérénol est l'agoniste le plus puissant des bêta-adrénorécepteurs, tandis que la phényléphrine, un composé synthétique, est l'agoniste le plus puissant des alpha-adrénorécepteurs. Les catécholamines naturelles – adrénaline et noradrénaline – sont capables d'interagir avec les deux types de récepteurs, mais l'adrénaline présente une plus grande affinité pour les bêta-récepteurs et la noradrénaline pour les alpha-récepteurs.
Les catécholamines activent les récepteurs bêta-adrénergiques cardiaques plus fortement que les récepteurs bêta-adrénergiques des muscles lisses, ce qui a permis de diviser le type bêta en sous-types: récepteurs bêta-1 (cœur, adipocytes) et récepteurs bêta-2 (bronches, vaisseaux sanguins, etc.). L'effet de l'isoprotérénol sur les récepteurs bêta-1 est dix fois supérieur à celui de l'adrénaline et de la noradrénaline, tandis que sur les récepteurs bêta-2, il est 100 à 1 000 fois plus puissant que les catécholamines naturelles.
L'utilisation d'antagonistes spécifiques (phentolamine et phénoxybenzamine pour les récepteurs alpha et propranolol pour les récepteurs bêta) a confirmé la pertinence de la classification des adrénorécepteurs. La dopamine est capable d'interagir avec les récepteurs alpha et bêta, mais divers tissus (cerveau, hypophyse, vaisseaux) possèdent également leurs propres récepteurs dopaminergiques, dont le bloqueur spécifique est l'halopéridol. Le nombre de récepteurs bêta varie de 1 000 à 2 000 par cellule. Les effets biologiques des catécholamines médiées par les récepteurs bêta sont généralement associés à l'activation de l'adénylate cyclase et à une augmentation du contenu intracellulaire en AMPc. Bien que le récepteur et l'enzyme soient fonctionnellement liés, ce sont des macromolécules différentes. La guanosine triphosphate (GTP) et d'autres nucléotides puriques participent à la modulation de l'activité de l'adénylate cyclase sous l'influence du complexe hormone-récepteur. En augmentant l’activité enzymatique, ils semblent réduire l’affinité des récepteurs bêta pour les agonistes.
Le phénomène d'augmentation de la sensibilité des structures dénervées est connu depuis longtemps. À l'inverse, une exposition prolongée aux agonistes réduit la sensibilité des tissus cibles. L'étude des récepteurs bêta a permis d'expliquer ces phénomènes. Il a été démontré qu'une exposition prolongée à l'isoprotérénol entraîne une perte de sensibilité de l'adénylate cyclase due à une diminution du nombre de récepteurs bêta.
Le processus de désensibilisation ne nécessite pas d'activation de la synthèse protéique et est probablement dû à la formation progressive de complexes hormono-récepteurs irréversibles. Au contraire, l'introduction de 6-oxydopamine, qui détruit les terminaisons sympathiques, s'accompagne d'une augmentation du nombre de récepteurs bêta réactifs dans les tissus. Il est possible qu'une augmentation de l'activité nerveuse sympathique entraîne également une désensibilisation liée à l'âge des vaisseaux sanguins et du tissu adipeux aux catécholamines.
Le nombre d'adrénorécepteurs dans différents organes peut être contrôlé par d'autres hormones. Ainsi, l'œstradiol augmente et la progestérone diminue le nombre d'alpha-adrénorécepteurs dans l'utérus, ce qui s'accompagne d'une augmentation et d'une diminution correspondantes de sa réponse contractile aux catécholamines. Si le « second messager » intracellulaire formé par l'action des agonistes des récepteurs bêta est bien l'AMPc, la situation concernant le transmetteur des effets alpha-adrénergiques est plus complexe. L'existence de divers mécanismes est supposée: diminution du taux d'AMPc, augmentation de sa teneur en AMPc, modulation de la dynamique calcique cellulaire, etc.
Pour reproduire divers effets dans l'organisme, des doses d'adrénaline 5 à 10 fois inférieures à celles de noradrénaline sont généralement nécessaires. Bien que cette dernière soit plus efficace sur les récepteurs adrénergiques alpha et bêta1, il est important de rappeler que les deux catécholamines endogènes sont capables d'interagir avec les récepteurs alpha et bêta. Par conséquent, la réponse biologique d'un organe donné à l'activation adrénergique dépend largement du type de récepteurs présents. Cependant, cela ne signifie pas qu'une activation sélective de la liaison nerveuse ou humorale du système sympathique-surrénalien soit impossible. Dans la plupart des cas, une augmentation de l'activité de ses différentes liaisons est observée. Ainsi, il est généralement admis que l'hypoglycémie active réflexivement la médullosurrénale, tandis qu'une baisse de la pression artérielle (hypotension orthostatique) s'accompagne principalement d'une libération de noradrénaline par les terminaisons des nerfs sympathiques.
Les adrénorécepteurs et les effets de leur activation dans divers tissus
Système, organe |
Type de récepteur adrénergique |
Réaction |
Système cardiovasculaire: |
||
Cœur |
Bêta |
Augmentation de la fréquence cardiaque, de la conductivité et de la contractilité |
Artérioles: |
||
Peau et muqueuses |
Alpha |
Réduction |
Muscles squelettiques |
Bêta |
Expansion Contraction |
Organes abdominaux |
Alpha (suite) |
Réduction |
Bêta |
Extension |
|
Veines |
Alpha |
Réduction |
Système respiratoire: |
||
Muscles des bronches |
Bêta |
Extension |
Système digestif: |
||
Estomac |
Bêta |
Diminution de la motricité |
Intestins |
Alpha |
Contraction des sphincters |
Rate |
Alpha |
Réduction |
Bêta |
Relaxation |
|
Pancréas exocrine |
Alpha |
Diminution de la sécrétion |
Système urogénital: |
Alpha |
Contraction du sphincter |
Vessie |
Bêta |
Relâchement du muscle éjecteur |
Organes génitaux masculins |
Alpha |
Éjaculation |
Yeux |
Alpha |
Dilatation de la pupille |
Cuir |
Alpha |
Transpiration accrue |
Glandes salivaires |
Alpha |
Excrétion de potassium et d'eau |
Bêta |
Sécrétion d'amylase |
|
Glandes endocrines: |
||
Îlots du pancréas |
||
Cellules bêta |
Alpha (suite) |
Diminution de la sécrétion d'insuline |
Bêta |
Augmentation de la sécrétion d'insuline |
|
Cellules alpha |
Bêta |
Augmentation de la sécrétion de glucagon |
8 cellules |
Bêta |
Augmentation de la sécrétion de somatostatine |
Hypothalamus et hypophyse: |
||
Somatotrophes |
Alpha |
Augmentation de la sécrétion de STH |
Bêta |
Diminution de la sécrétion de STH |
|
Lactotrophes |
Alpha |
Diminution de la sécrétion de prolactine |
Thyrotrophes |
Alpha |
Diminution de la sécrétion de TSH |
Corticotropes |
Alpha |
Augmentation de la sécrétion d'ACTH |
| bêta | Diminution de la sécrétion d'ACTH | |
Glande thyroïde: |
||
Cellules folliculaires |
Alpha |
Diminution de la sécrétion de thyroxine |
Bêta |
Augmentation de la sécrétion de thyroxine |
|
Cellules parafolliculaires (K) |
Bêta |
Augmentation de la sécrétion de calcitonine |
Glandes parathyroïdes |
Bêta |
Augmentation de la sécrétion de PTH |
Rognons |
Bêta |
Augmentation de la sécrétion de rénine |
Estomac |
Bêta |
Augmentation de la sécrétion de gastrine |
BX |
Bêta |
Augmentation de la consommation d'oxygène |
Foie |
? |
Augmentation de la glycogénolyse et de la gluconéogenèse avec libération de glucose; augmentation de la cétogenèse avec libération de corps cétoniques |
Tissu adipeux |
Bêta |
Augmentation de la lipolyse avec libération d'acides gras libres et de glycérol |
Muscles squelettiques |
Bêta |
Augmentation de la glycolyse avec libération de pyruvate et de lactate; diminution de la protéolyse avec diminution de la libération d'alanine et de glutamine |
Il est important de noter que les résultats de l'administration intraveineuse de catécholamines ne reflètent pas toujours fidèlement les effets des composés endogènes. Cela concerne principalement la noradrénaline, car dans l'organisme, elle est principalement libérée non pas dans le sang, mais directement dans les fentes synaptiques. Par conséquent, la noradrénaline endogène active, par exemple, non seulement les récepteurs alpha vasculaires (augmentation de la pression artérielle), mais aussi les récepteurs bêta du cœur (augmentation de la fréquence cardiaque), tandis que l'administration externe de noradrénaline entraîne principalement l'activation des récepteurs alpha vasculaires et un ralentissement réflexe (via le nerf vague) du rythme cardiaque.
De faibles doses d'adrénaline activent principalement les récepteurs bêta des vaisseaux musculaires et du cœur, entraînant une diminution des résistances vasculaires périphériques et une augmentation du débit cardiaque. Dans certains cas, l'effet initial peut prévaloir et une hypotension se développe après l'administration d'adrénaline. À doses plus élevées, l'adrénaline active également les récepteurs alpha, ce qui s'accompagne d'une augmentation des résistances vasculaires périphériques et, dans le contexte d'une augmentation du débit cardiaque, entraîne une augmentation de la pression artérielle. Cependant, son effet sur les récepteurs bêta vasculaires est également préservé. Par conséquent, l'augmentation de la pression systolique dépasse celle de la pression diastolique (augmentation de la pression différentielle). Avec l'introduction de doses encore plus élevées, les effets alpha-mimétiques de l'adrénaline commencent à prévaloir: les pressions systolique et diastolique augmentent parallèlement, comme sous l'influence de la noradrénaline.
L'effet des catécholamines sur le métabolisme se compose d'effets directs et indirects. Les premiers sont principalement réalisés par l'intermédiaire des récepteurs bêta. Des processus plus complexes sont associés au foie. Bien que l'augmentation de la glycogénolyse hépatique soit traditionnellement considérée comme résultant de l'activation des récepteurs bêta, l'implication des récepteurs alpha est également démontrée. Les effets indirects des catécholamines sont associés à la modulation de la sécrétion de nombreuses autres hormones, comme l'insuline. Dans l'effet de l'adrénaline sur sa sécrétion, la composante alpha-adrénergique prédomine clairement, car il a été démontré que tout stress s'accompagne d'une inhibition de la sécrétion d'insuline.
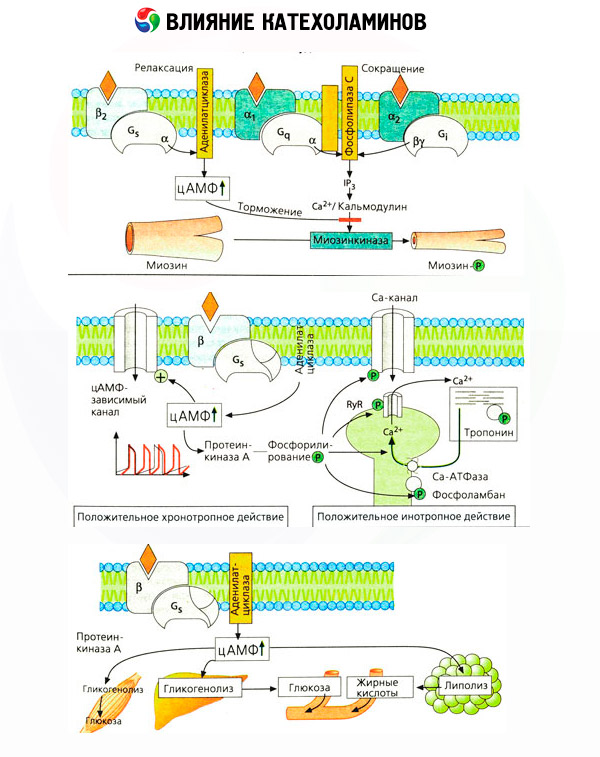
La combinaison des effets directs et indirects des catécholamines provoque une hyperglycémie, associée non seulement à une augmentation de la production hépatique de glucose, mais aussi à une inhibition de son utilisation par les tissus périphériques. L'accélération de la lipolyse provoque une hyperlipacidémie avec un apport accru d'acides gras au foie et une intensification de la production de corps cétoniques. L'augmentation de la glycolyse musculaire entraîne une augmentation de la libération de lactate et de pyruvate dans le sang, qui, avec le glycérol libéré par le tissu adipeux, servent de précurseurs à la gluconéogenèse hépatique.
Régulation de la sécrétion de catécholamines. La similitude des produits et des modes de réaction du système nerveux sympathique et de la médullosurrénale a permis de combiner ces structures en un seul système sympathique-surrénalien, avec répartition de ses liaisons nerveuses et hormonales. Différents signaux afférents sont concentrés dans l'hypothalamus, les centres de la moelle épinière et du bulbe rachidien, d'où proviennent les messages efférents, transmis aux corps cellulaires des neurones préganglionnaires situés dans les cornes latérales de la moelle épinière, au niveau des segments cervicaux VIII et lombaires II-III.
Les axones préganglionnaires de ces cellules quittent la moelle épinière et forment des connexions synaptiques avec les neurones situés dans les ganglions de la chaîne sympathique ou avec les cellules de la médullosurrénale. Ces fibres préganglionnaires sont cholinergiques. La première différence fondamentale entre les neurones postganglionnaires sympathiques et les cellules chromaffines de la médullosurrénale est que ces dernières transmettent le signal cholinergique qu'elles reçoivent non pas par conduction nerveuse (nerfs adrénergiques postganglionnaires), mais par la voie humorale, libérant des composés adrénergiques dans le sang. La seconde différence est que les nerfs postganglionnaires produisent de la noradrénaline, tandis que les cellules de la médullosurrénale produisent principalement de l'adrénaline. Ces deux substances ont des effets différents sur les tissus.

