Expert médical de l'article
Nouvelles publications
Resténose
Dernière revue: 04.07.2025

Tout le contenu iLive fait l'objet d'un examen médical ou d'une vérification des faits pour assurer autant que possible l'exactitude factuelle.
Nous appliquons des directives strictes en matière d’approvisionnement et ne proposons que des liens vers des sites de médias réputés, des instituts de recherche universitaires et, dans la mesure du possible, des études évaluées par des pairs sur le plan médical. Notez que les nombres entre parenthèses ([1], [2], etc.) sont des liens cliquables vers ces études.
Si vous estimez qu'un contenu quelconque de notre contenu est inexact, obsolète ou discutable, veuillez le sélectionner et appuyer sur Ctrl + Entrée.
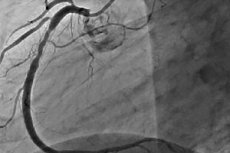
La resténose est l'apparition d'un rétrécissement récurrent de 50 % ou plus au site d'intervention coronaire percutanée. La resténose s'accompagne généralement d'angor récurrent, nécessitant souvent des interventions répétées. Avec l'évolution de l'ICP, l'incidence de la resténose a diminué et sa nature a également évolué.
Resténose après angioplastie coronaire transluminale par ballonnet (ATBC)
Après une ACTB, le taux de resténose au cours des 6 premiers mois est de 30 à 40 %. Le principal mécanisme de son développement est un remodelage vasculaire négatif local, qui correspond essentiellement à un collapsus élastique de la lumière artérielle, dilatée par le ballonnet pendant l'intervention. La formation locale de thrombus et la croissance néointimale jouent également un rôle relatif. Il existe des facteurs de risque cliniques (diabète de type 2, syndrome coronarien aigu (SCA), antécédents de resténose), angiographiques (lésion de l'artère coronaire gauche, petit diamètre vasculaire, occlusion totale chronique (OTC), lésion longue, pontages veineux dégénérés) et procéduraux (sténose résiduelle importante, faible augmentation du diamètre vasculaire suite au gonflement du ballonnet) de resténose après ACTB. En cas de resténose, une nouvelle intervention est généralement réalisée. Le succès d'une ACTB répétée au site de resténose est comparable à celui de la première intervention. Cependant, à chaque ACTB ultérieure pour resténose, le risque de récidive de resténose augmente significativement. Après la troisième tentative, ce taux atteint 50 à 53 %. De plus, à chaque nouvelle intervention, la resténose est plus prononcée que lors de la première. Les facteurs de risque de resténose après une deuxième intervention sont l'apparition précoce de la première resténose (60 à 90 jours après l'intervention), les lésions de l'artère coronaire interventriculaire gauche (IAD), les lésions multivasculaires, le diabète de type 2, l'hypertension artérielle, l'angor instable et les gonflements multiples du ballonnet lors de la première intervention. Compte tenu de la fréquence élevée de la resténose et de son mécanisme de développement, les stents coronaires ont été introduits en pratique clinique, ce qui aurait théoriquement dû éliminer le remodelage vasculaire négatif après une intervention.
Français Les premières études à démontrer l'efficacité du stenting ont été les études STRESS et BENESTENT publiées en 1993. BENESTENT a inclus 516 patients présentant une sténose nouvellement diagnostiquée dans les artères coronaires de plus de 3 mm de diamètre, qui ont été randomisés en deux groupes: TBCA conventionnel (n = 257) et TBCA avec pose de stent (n = 259). Après 3 ans, le taux de resténose pendant l'angiographie était de 32 % dans le groupe TBCA conventionnel et de 22 % dans le groupe stenting. La réduction relative du taux de resténose était de 31 % (p < 0,01). Le groupe stenting avait également un besoin moindre de revascularisation myocardique répétée (10 contre 20,6 % dans le groupe TBCA conventionnel; p < 0,01), ce qui était associé à un taux plus faible de récidive d'angine dans le groupe stenting.
Français Selon l'étude STRESS (n = 407), le taux de resténose était également plus faible dans le groupe stenting (n ~ 205) que dans le groupe PTCA conventionnel (n = 202) - 31,6 contre 42,1 % (p < 0,01). L'avantage de l'utilisation de stents par rapport à l'angioplastie conventionnelle en cas de resténose au site PTCA a été démontré dans l'étude REST, dans laquelle 383 patients atteints de resténose ont été randomisés pour recevoir un stenting ou une angioplastie coronaire transluminale percutanée répétée. La resténose répétée détectée par angiographie était inférieure de 18 % dans le groupe stenting (18 contre 5,32 %; p < 0,03). La revascularisation myocardique répétée, indicateur d'une resténose cliniquement significative, a également été nécessaire significativement moins fréquemment chez les patients ayant bénéficié d'une pose de stent (10 % contre 27 %; p < 0,001). Ainsi, de meilleurs résultats ont été obtenus avec la pose de stent, non seulement sur les artères natives, mais aussi en cas d'intervention pour resténose apparue après TBCA.
Resténose après implantation d'un stent nu (BSI)
Bien que les stents coronaires non couverts aient réduit l'incidence de resténose de 30 à 40 % par rapport aux TBCA, 17 à 32 % des patients développent une resténose intra-stent même après la pose du stent, nécessitant une revascularisation répétée. Le mécanisme de développement de la sténose intra-stent (ISS) diffère de celui de la TBCA. Après la pose du stent, la principale contribution à la resténose est la formation de néointima, plutôt que le remodelage négatif, comme dans la TBCA, qui est pratiquement absent au site d'implantation du stent. La néointima se forme par migration et prolifération de cellules musculaires lisses produisant une matrice extracellulaire qui, avec les cellules, constitue la néointima. De plus, la persistance du thrombus au site de pose du stent est également importante chez les patients diabétiques.
La classification principale de la sténose intra-stent (ISS) est celle proposée par Mehran, qui comprend quatre types selon l'étendue et la gravité de la lésion: ISS de type I: locale (< 10 mm de longueur), type II: diffuse (> 10 mm de longueur), type III: proliférative (> 10 mm et s'étendant au-delà du stent) et type IV: ISS conduisant à une occlusion. Le premier type est divisé en sous-types selon la localisation dans le stent: 1a: sur le coude ou entre les stents, 1b: marginale, 1c: à l'intérieur du stent, 1d: multifocale.
Les facteurs de risque de développement d'un SRV sont les interventions sur pontages veineux, les occlusions chroniques, les lésions ostiales, le petit diamètre vasculaire, la présence d'une sténose résiduelle, la pose d'un stent pour SRV, le petit diamètre vasculaire post-interventionnel, les lésions de l'ILD, la longueur importante du stent, la présence d'un diabète et l'implantation de plusieurs stents dans une même lésion. Il existe des indications de l'influence de facteurs génétiques, notamment le polymorphisme du gène de la glycoprotéine IIIa et les mutations du gène de la méthylènetétrahydrofolate réductase (gène codant pour l'interleukine-1). En cas de resténose marginale du stent, le principal facteur de risque est une lésion athéroscléreuse prononcée dans le segment stenté.
La resténose survient principalement au cours des 6 à 8 premiers mois suivant une intervention coronarienne percutanée. La plupart des patients développent des symptômes cliniques à peu près simultanément. Le SRV se manifeste généralement par une angor récurrent. L'angor instable est moins fréquent (11 à 41 % des cas). Un infarctus du myocarde (IDM) se développe chez 1 à 6 % des patients. Ainsi, la cause la plus fréquente d'angor dans les 1 à 6 mois suivant la pose d'un stent est l'apparition d'un SRV, qui nécessite généralement une revascularisation répétée. Il existe plusieurs méthodes de traitement du SRV. Une TBCA conventionnelle peut être réalisée, ce qui entraîne une expansion supplémentaire du stent (contribution de 56 % à l'augmentation finale du diamètre vasculaire) et pousse la néointima à travers les cellules du stent (contribution de 44 % à l'augmentation finale du diamètre). Cependant, une resténose résiduelle est observée dans la plupart des cas au site d'intervention (en moyenne 18 %). De plus, après TBCA, une revascularisation répétée est nécessaire dans 11 % des cas, plus souvent chez les patients présentant une atteinte multivasculaire, une faible FEVG, en cas d'intervention sur pontage veineux ou de survenue précoce du premier SRV. Le risque de développer un SRV répété après TBCA dépend également du type de lésion et varie de 10 % en cas de resténose locale à 80 % en cas d'occlusion intra-stent. L'implantation du SIO au site du SRV ne réduit pas le risque de récidive par rapport à la TBCA seule.
La deuxième méthode de traitement du SRV est la curiethérapie. Elle consiste à introduire une source radioactive dans la lumière de l'artère coronaire, empêchant ainsi la prolifération des cellules musculaires lisses et réduisant ainsi le risque de resténose. Cependant, le coût élevé de l'équipement, la complexité technique de la procédure et l'incidence accrue de thrombose tardive de stent (TL) ont presque totalement exclu la curiethérapie de son utilisation clinique.
L'introduction des stents à élution médicamenteuse a marqué une révolution dans le traitement du SRV. Comparés au SIO dans les artères natives, ils réduisent le risque de SRV de 70 à 80 %. Les premières données sur l'efficacité des stents à élution médicamenteuse chez les patients atteints d'un SRV déjà développé ont été obtenues dans le registre TAXUS III. Lors de l'utilisation du SPG1 chez ces patients, la fréquence de récidive du SRV n'était que de 16 % après 6 mois, un taux inférieur à celui observé dans les études précédemment mentionnées avec le TBCA. Dans le registre TRUE, qui incluait des patients après implantation de SES pour resténose du SIO, après 9 mois, une revascularisation répétée était nécessaire chez moins de 5 % des patients, principalement atteints de diabète sucré et de syndrome coronarien aigu (SCA). L'étude TROPICAL a comparé la fréquence de resténose répétée chez les patients après implantation de stents à élution médicamenteuse au site de resténose avec les données des études GAMMA I et GAMMA II, dans lesquelles la curiethérapie était utilisée comme méthode de traitement. Français Après 6 mois, l'incidence de resténose récurrente était significativement plus faible dans le groupe SPS (9,7 contre 40,3 %; p < 0,0001). Il est important de noter que l'incidence de thrombose de stent et d'infarctus du myocarde était également plus faible dans le groupe SPS (TS 0,6 contre 3,9 %; p = 0,08; IM - 1,8 contre 9,4 %; p = 0,004). L'avantage du SPS par rapport à la curiethérapie a été confirmé dans l'étude randomisée SISR, dans laquelle 384 patients avec un VRS développé dans le NSC ont été randomisés dans des groupes de curiethérapie ou d'implantation de SPS. Après 9 mois, le besoin de revascularisation répétée était plus élevé après curiethérapie (19,2 %) que dans le groupe d'implantation de SPS (8,5 %), ce qui reflétait une récidive plus fréquente de resténose. Après 3 ans, l'avantage du SPS en termes de réduction du recours à une revascularisation répétée en raison d'une resténose récurrente du stent persistait (19 % contre 28,4 %). Aucune différence significative n'a été observée dans l'incidence de thrombose entre les groupes.
Les principaux facteurs de développement de SRV récidivante chez les patients atteints de LES en cas d'implantation de SPS sont un petit diamètre vasculaire (< 2,5 mm), une resténose diffuse et la présence d'une insuffisance rénale chronique nécessitant une hémodialyse. Dans l'étude randomisée TAXUS V ISR, le SPS a également démontré une grande efficacité dans le traitement du SRV, réduisant le taux de resténose récidivante de 54 % par rapport à la curiethérapie.
Français Des essais randomisés comparant l'efficacité du TBCA pour l'implantation de SRV et de DES ont également été menés. Dans l'essai randomisé RIBS-II, après 9 mois, la resténose répétée était 72 % moins fréquente après l'implantation de DES qu'après TBCA, ce qui réduisait le besoin de revascularisation répétée de 30 à 11 %. L'essai ISAR DESIRE a comparé l'efficacité du TBCA pour le SRV à l'implantation de SPP ou de SPS. Après 6 mois, il s'est avéré que les deux DES étaient plus efficaces pour prévenir la resténose répétée que le TBCA (son incidence était de 44,6 % avec le TBCA, de 14,3 % dans le groupe SPS et de 21,7 % dans le groupe SPS), ce qui réduisait le besoin de revascularisation répétée. Dans une comparaison directe du SPP et du SPS, il a été constaté que le SPS réduisait le besoin de revascularisation répétée de manière significativement plus efficace que le SPP (8 contre 19 %). Ainsi, l'implantation de DES réduit l'incidence de récidive du LES VRS par rapport à la TBCA et à la curiethérapie, ce qui réduit le nombre d'ICP répétées et fait donc de leur implantation la procédure de choix chez ces patients.
Resténose après implantation d'un stent à élution de médicament (SEM)
Malgré une diminution de 70 à 80 % de l'incidence de sténose intra-stent lors de l'utilisation d'un DES par rapport au LES, le développement de cette conséquence iatrogène du stent n'a pas pu être totalement exclu. Son incidence globale reste en moyenne inférieure à 10 %. Outre la diminution quantitative de l'incidence de resténose, le type de resténose observé a également été significativement modifié. Ainsi, après l'implantation d'un DES, la resténose est généralement focale. Cliniquement, comme dans le cas du LES, elle se manifeste le plus souvent par une rechute d'angor stable (77 %), plus rarement (8 %), elle est asymptomatique. Dans 5 % des cas, elle se manifeste par une angor instable et dans 10 % des cas, son premier symptôme est un infarctus du myocarde sans onde Q. Les principaux facteurs de développement de la resténose du DES sont le diabète de type 2, le petit diamètre des vaisseaux et l'étendue de la lésion. Il n'existe pas de recommandations claires pour la prise en charge de ces patients. Les autres options sont la réimplantation d'un DES (du même type ou d'un autre), l'ATCC ou la curiethérapie. Le taux moyen de re-resténose avec un second DES est de 24 %, et il est identique, que le DES soit implanté du même type ou d'un autre.


 [
[