Expert médical de l'article
Nouvelles publications
Modèles expérimentaux d'arthrose
Dernière revue: 07.07.2025

Tout le contenu iLive fait l'objet d'un examen médical ou d'une vérification des faits pour assurer autant que possible l'exactitude factuelle.
Nous appliquons des directives strictes en matière d’approvisionnement et ne proposons que des liens vers des sites de médias réputés, des instituts de recherche universitaires et, dans la mesure du possible, des études évaluées par des pairs sur le plan médical. Notez que les nombres entre parenthèses ([1], [2], etc.) sont des liens cliquables vers ces études.
Si vous estimez qu'un contenu quelconque de notre contenu est inexact, obsolète ou discutable, veuillez le sélectionner et appuyer sur Ctrl + Entrée.
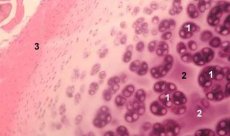
Le cartilage est un tissu hautement spécialisé contenant un seul type de cellules (les chondrocytes) et caractérisé par l'absence de vaisseaux sanguins et lymphatiques. Il est principalement nourri par absorption à partir du liquide synovial. Le métabolisme des chondrocytes est régulé par un certain nombre de facteurs solubles produits localement par les chondrocytes et les tissus environnants. Leur fonction dépend également de la composition du milieu extracellulaire (tension en oxygène, concentration ionique, pH, etc.), de la composition de la matrice extracellulaire (MEC), de l'interaction des cellules avec la matrice, et des signaux physiques. L'objectif principal de la modélisation expérimentale est de créer des cultures en milieu extracellulaire sans modifier le phénotype des cellules matures. Le deuxième objectif est de créer des cultures pour étudier la réponse prématurée, retardée, à court terme ou prolongée des chondrocytes aux signaux chimiques et/ou physiques. Les études in vitro permettent également d'étudier le comportement des chondrocytes dans l'arthrose. Le troisième objectif est de développer des systèmes de coculture permettant d'étudier les interactions entre différents tissus de l'articulation. La quatrième tâche consiste à préparer les implants cartilagineux en vue d'une transplantation ultérieure. Enfin, la cinquième tâche consiste à étudier les facteurs de croissance, les cytokines ou les agents thérapeutiques capables de stimuler la réparation et/ou d'inhiber la résorption cartilagineuse.
Au cours des dernières décennies, divers modèles de cultures cellulaires du cartilage articulaire ont été créés, notamment des cultures monocouches, des cultures en suspension, des cultures de chondrons, des explants, des cocultures et des cultures de cellules immortelles. Chaque culture présente ses propres avantages et inconvénients, et chacune est adaptée à l'étude d'un aspect spécifique du métabolisme des chondrocytes. Ainsi, les explants de cartilage constituent un excellent modèle pour étudier le renouvellement des éléments de la matrice, qui nécessite de véritables récepteurs de surface cellulaire et des interactions cellule-matrice et matrice-cellule normales. Parallèlement, il est recommandé d'étudier les dépôts matriciels ou les mécanismes régulant le métabolisme des chondrocytes sur une culture de cellules isolées. Une culture monocouche à faible densité est nécessaire pour étudier le processus de différenciation cellulaire. Les cultures en suspension dans une matrice naturelle ou synthétique constituent un modèle pour analyser la réponse adaptative des chondrocytes au stress mécanique.
Cultures de chondrocytes
Plusieurs points importants doivent être pris en compte lors de la sélection du tissu cartilagineux pour les études in vitro. La composition de la matrice et l'activité métabolique des chondrocytes varient selon les articulations, et cette dernière dépend également de la profondeur de localisation des chondrocytes dans le tissu. Ces données ont été obtenues lors de plusieurs expériences au cours desquelles des sous-populations isolées de chondrocytes provenant de zones cartilagineuses de différentes profondeurs ont été étudiées. Un certain nombre de différences morphologiques et biochimiques ont été observées entre les chondrocytes en culture situés dans les couches superficielles et profondes du cartilage articulaire. Les cellules superficielles synthétisent une matrice fibrillaire clairsemée et pauvre en protéoglycanes, tandis que les cellules plus profondes produisent une matrice riche en fibrilles et en protéoglycanes. De plus, les cellules superficielles produisent relativement plus de petits protéoglycanes non agrégés et d'acide hyaluronique, et relativement moins d'aggrécane et de sulfate de kératane que les chondrocytes plus profonds. Une autre caractéristique distinctive importante du métabolisme des chondrocytes isolés de zones cartilagineuses de différentes profondeurs est la réponse à un stimulus exogène. Selon M. Aydelotte et al., les chondrocytes bovins de la zone superficielle du cartilage étaient plus sensibles à l'IL-1 que les cellules de la zone profonde.
Le comportement cellulaire dépend également de la localisation tissulaire. Les chondrocytes des cartilages des côtes et de l'oreille d'un même animal réagissent différemment aux facteurs de croissance tels que le facteur de croissance des fibroblastes (FGF) et le TGF-bêta. Le FGF a augmenté l'incorporation de thymidine, de proline et de leucine dans les côtes en culture, mais pas dans les chondrocytes de l'oreille. Le TGF-bêta a augmenté l'incorporation de thymidine dans les chondrocytes des cartilages des côtes et de l'oreille, mais n'a eu aucun effet sur l'incorporation de thymidine et de proline dans les chondrocytes de l'oreille. Les cellules cartilagineuses des zones de forte contrainte diffèrent de celles des zones de faible contrainte sur le cartilage. Ainsi, les chondrocytes du cartilage articulaire du genou de mouton mature provenant de la région centrale de la surface articulaire du tibia non recouverte par le ménisque, qui supporte la plus grande charge in vivo, synthétisent moins d'aggrécane, mais plus de décorine que les cellules des zones recouvertes par le ménisque. Les auteurs soulignent également l'importance d'utiliser du cartilage provenant de zones articulaires identiques pour étudier la fonction synthétique des articulations.
Le métabolisme des chondrocytes et leur réponse aux facteurs de régulation dépendent également de manière significative de l'âge du donneur, de son développement squelettique et de l'état des articulations d'où proviennent les cellules. Chez les chondrocytes humains, on observe une diminution significative de la réponse proliférative avec l'âge. La diminution la plus importante est observée chez les donneurs âgés de 40 à 50 ans et de plus de 60 ans. De plus, l'intensité de la réponse proliférative aux facteurs de croissance (par exemple, FGF et TGF-bêta) diminue avec l'âge. Outre les modifications quantitatives de la prolifération des chondrocytes, on observe également des modifications qualitatives. Les cellules de donneurs jeunes (10 à 20 ans) répondent mieux au facteur de croissance dérivé des plaquettes (PDGF) qu'au TGF-bêta, tandis que l'inverse est observé chez les cellules de donneurs adultes. Plusieurs mécanismes sont utilisés pour expliquer les modifications liées à l'âge de la fonction synthétique des chondrocytes et de leur réponse aux facteurs de croissance. Il s’agit notamment d’une diminution du nombre et de l’affinité des récepteurs des cellules de surface, de modifications de la synthèse et de la bioactivité des facteurs de croissance et des cytokines, et d’une modification des signaux post-récepteurs.
L'état pathologique des articulations modifie également la morphologie et l'activité métabolique des chondrocytes. Ainsi, J. Kouri et al. (1996) ont identifié trois sous-populations de chondrocytes dans le cartilage de l'arthrose. Les chondrocytes de la partie superficielle et supérieure du cartilage moyen forment des amas et synthétisent une plus grande quantité de protéoglycanes et de collagène. Le TGF-bêta et le facteur de croissance analogue à l'insuline (IGF) sont capables de stimuler la synthèse de protéoglycanes par les chondrocytes et de neutraliser partiellement les effets de l'IL-1 et du TNF-α. Les explants de cartilage affecté par l'arthrose et les chondrocytes isolés du cartilage d'un patient atteint d'arthrose sont plus sensibles à la stimulation du TGF-bêta que les chondrocytes de cartilage sain. Ces différences sont très probablement associées à des modifications phénotypiques des chondrocytes des couches supérieures du cartilage articulaire.
L'isolement des chondrocytes individuels est obtenu par traitement séquentiel de la matrice extracellulaire (MEC) par des enzymes protéolytiques. Après leur libération de la MEC, les cellules isolées sont idéales pour l'étude de la synthèse de novo des composants de la matrice. Certains auteurs utilisent uniquement la collagénase clostridienne, tandis que d'autres pré-incubent le cartilage avec de la trypsine, de la pronase, de la DNase et/ou de la hyaluronidase. Le nombre de cellules isolées dépend des enzymes utilisées. Ainsi, avec la collagénase seule, on peut obtenir 1,4 à 10 chondrocytes à partir de 1 g de tissu, tandis qu'avec la pronase, la hyaluronidase et la collagénase, on obtient 4,3 à 10 chondrocytes. Avec la collagénase, l'aggrécane, les protéines, l'IL-6 et l'IL-8 restent dans la culture cellulaire en quantités significativement plus importantes qu'avec un traitement séquentiel par différentes enzymes. Plusieurs explications peuvent expliquer ces différences entre les deux cultures cellulaires:
- Les récepteurs cellulaires sont endommagés ou inhibés par les enzymes. Le TGF-bêta inhibe la synthèse d'ADN et de protéoglycanes dans les chondrocytes fraîchement isolés (jour 1), tandis que la synthèse d'ADN et de protéoglycanes dans les chondrocytes cultivés en monocouche (7 jours) est stimulée par le TGF-bêta. Cependant, un délai suffisant est nécessaire pour la réexpression de ces composants membranaires avant le début de l'expérience.
- Les protéases exogènes peuvent perturber l'interaction cellule-matrice médiée par les intégrines. La famille des intégrines favorise la fixation des chondrocytes aux molécules de la matrice extracellulaire (ECM) (Shakibaei M. et al., 1997). Cette perturbation peut affecter l'expression des gènes de la matrice.
- Les restes de composants de la matrice peuvent réguler la fonction de synthèse des chondrocytes. Les intégrines sont capables de reconnaître les produits de dégradation de la matrice extracellulaire, jouant ainsi un rôle important dans la réparation tissulaire après l'action des enzymes protéolytiques. T. Larsson et al. (1989) ont rapporté que l'ajout de protéoglycanes intacts ou fragmentés à la culture cellulaire stimule la synthèse de protéines et de protéoglycanes. Cependant, un taux élevé d'acide hyaluronique entraîne une diminution significative de l'inclusion de sulfates dans la synthèse des protéoglycanes par les chondrocytes de l'embryon de poulet, les chondrocytes matures du porc et les cellules de chondrosarcome de rat. De plus, l'acide hyaluronique est un inhibiteur de la libération de protéoglycanes par les cellules, même en présence d'IL-1b, de TNF-a et de FGF, ce qui indique une neutralisation de la première activité biologique des facteurs de croissance et des cytokines. Le mécanisme exact sous-jacent à l'action de l'acide hyaluronique reste flou; Les chondrocytes sont connus pour contenir un récepteur à l'acide hyaluronique associé aux filaments d'actine du cytosol. La liaison de l'acide hyaluronique à son récepteur stimule la phosphorylation des protéines. Ainsi, ces données démontrent la modulation de la fonction métabolique des chondrocytes par des molécules fragmentées ou natives de protéines matricielles, via l'activation des récepteurs membranaires cellulaires.
- La stimulation rapide de la synthèse des protéines matricielles par les chondrocytes par des enzymes peut être une conséquence de changements dans la forme des chondrocytes et/ou de la réorganisation du cytosquelette.
- Certaines cytokines (par exemple, IL-8) et certains facteurs de croissance (par exemple, IGF-1, TGF-β) sont séquestrés dans la matrice extracellulaire (MEC). L'exemple le plus connu est la liaison du TGF-β par la décorine, qui diminue sa capacité à induire la croissance cellulaire dans les cellules ovariennes de hamster chinois. L'augmentation de la teneur en décorine du cartilage avec l'âge suggère une diminution de la biodisponibilité du TGF-β avec l'âge. Des facteurs de croissance et des cytokines pourraient être libérés des débris matriciels pendant la culture et moduler ainsi la fonction des chondrocytes.
Culture monocouche de chondrocytes
Le phénotype différencié des chondrocytes se caractérise principalement par la synthèse de collagène de type II et de protéoglycanes tissulaires spécifiques, ainsi que par une faible activité mitotique. Il est prouvé qu'avec une culture cellulaire prolongée en monocouche, ainsi qu'après plusieurs passages cellulaires répétés, les chondrocytes perdent leur forme sphérique et acquièrent une forme allongée, semblable à celle des fibroblastes. Cette métaplasie fibroblastique modifie également la fonction synthétique des cellules, caractérisée par une diminution progressive de la synthèse des collagènes de types II, IX et XI et une augmentation de celle des collagènes de types I, III et Y. De petits protéoglycanes non agrégés sont synthétisés grâce à l'aggrécane fonctionnel. La synthèse des cathepsines B et L est extrêmement faible dans les cellules différenciées, mais augmente lors du processus de perte de différenciation. La collagénase-1 est exprimée dans les chondrocytes différenciés; avec une culture prolongée, son expression diminue, tandis que la production d'inhibiteurs tissulaires des métalloprotéases (TIMP) augmente.
Les chondrocytes différenciés réexpriment le collagène du phénotype différencié lors de leur transfert de la monocouche vers la culture en suspension. Le processus de différenciation est probablement lié à la forme cellulaire. Cette propriété est régulièrement utilisée par les chercheurs étudiant les greffes défectueuses avec des chondrocytes autologues. Un petit nombre de cellules obtenues à partir de matériel de biopsie peuvent être multipliées en monocouche, puis réintroduites dans une matrice tridimensionnelle avant transplantation. La réexpression d'un phénotype spécifique par les chondrocytes dédifférenciés transférés en culture d'agarose peut être stimulée par le TGF-β, le complexe osséine-hydroxyapatite et l'acide ascorbique.
En réponse aux facteurs de croissance et aux cytokines, les chondrocytes sont modifiés au cours du processus de différenciation. La réponse cellulaire aux cytokines et aux facteurs de croissance diffère entre les chondrocytes indifférenciés et différenciés. L'IL-1 stimule la prolifération des fibroblastes, tandis que la croissance des chondrocytes indifférenciés est inhibée par l'IL-1. La synthèse d'ADN est stimulée par l'IGF-1 dans les chondrocytes allongés, mais non aplatis. Chez les chondrocytes différenciés, les effets stimulants de l'IL-1 bêta et du TNF-α sur la production de procollagénase sont plus prononcés que chez les chondrocytes indifférenciés.
Culture de chondrocytes
La culture de chondrocytes en suspension dans un milieu liquide ou dans une matrice tridimensionnelle naturelle ou synthétique stabilise le phénotype chondrocytaire. Les cellules conservent leur forme sphérique et synthétisent des protéines spécifiques aux tissus. La culture de chondrocytes en suspension est généralement recommandée pour étudier la formation d'une nouvelle matrice péricellulaire. Les cultures de chondrocytes dans des polymères absorbants synthétiques ou naturels sont utilisées pour l'implantation de cellules dans les lésions cartilagineuses afin de stimuler la régénération du tissu cartilagineux articulaire. Le milieu synthétique ou naturel pour l'implantation des cellules doit répondre à plusieurs exigences:
- les implants doivent avoir une structure poreuse pour l'adhésion et la croissance des cellules,
- ni le polymère lui-même ni ses produits de dégradation ne devraient provoquer d'inflammation ou de réactions toxiques lorsqu'ils sont implantés in vivo,
- le porteur de greffe doit avoir la capacité de se lier au cartilage adjacent ou à l'os sous-chondral,
- la matrice naturelle ou synthétique doit avoir la capacité d'absorber, sa dégradation doit être équilibrée par la régénération tissulaire,
- pour faciliter la réparation du cartilage, la structure chimique et l'architecture des pores de la matrice doivent faciliter le maintien du phénotype cellulaire et la synthèse de protéines spécifiques aux tissus par les chondrocytes qui y sont placés,
- Lors de l'implantation in vivo, il est nécessaire d'étudier les propriétés mécaniques de la matrice synthétique ou naturelle.
 [ 12 ], [ 13 ], [ 14 ], [ 15 ], [ 16 ]
[ 12 ], [ 13 ], [ 14 ], [ 15 ], [ 16 ]
Suspension de chondrocytes en phase liquide
L'adhésion des cellules aux récipients en plastique dans lesquels les chondrocytes sont cultivés peut être empêchée en enduisant leurs parois d'une solution de méthylcellulose, d'agarose, d'hydrogel (poly-2-hydroxyéthyl méthacrylate) ou d'un mélange collagène-agarose. Dans ces conditions, les chondrocytes forment des amas et synthétisent principalement de l'aggrécane et des collagènes spécifiques aux tissus (types II, IX, XI). On observe généralement deux types de cellules. Les cellules situées au centre conservent une forme sphérique et sont entourées d'une matrice extracellulaire bien développée, ce qui est confirmé par des études histochimiques et ultrastructurales. À la périphérie, les chondrocytes ont des contours discoïdes et sont entourés d'une matrice extracellulaire clairsemée; les caractéristiques fonctionnelles de ces cellules sont mal connues.
Il est possible de cultiver des chondrocytes sur des microsupports maintenus en suspension; des billes de dextrane (Cytodex), des billes de dextrane recouvertes de collagène (Cytodex III) et des microsphères non poreuses de collagène de type I (Cellagen) sont utilisées comme microsupports. Dans ces conditions de culture, les chondrocytes se fixent à la surface du microsupport, conservent leur forme sphérique et forment un matériau matriciel. De plus, l'utilisation de Cellagen favorise la prolifération des chondrocytes et la réexpression du phénotype normal. Par conséquent, la culture de chondrocytes sur des microsphères de Cellagen peut être utilisée pour restaurer le phénotype cellulaire avant transplantation.
Une autre méthode de culture de suspensions de chondrocytes en milieu liquide consiste à les cultiver sous forme de boules denses constituées de cellules (0,5-1 * 10 b ), obtenues par centrifugation. Ces chondrocytes sont capables de produire une matrice contenant une grande quantité de protéoglycanes, du collagène de type II, mais pas de collagène de type I, ce qui est confirmé par des méthodes histologiques, immunohistochimiques et quantitatives.
Suspension de chondrocytes dans la matrice extracellulaire naturelle
Les chondrocytes peuvent être cultivés en suspension dans une matrice tridimensionnelle (agar mou, agarose, gel ou éponge de collagène, acide hyaluronique, colle de fibrine, billes d'alginate).
Les chondrocytes cultivés en agarose conservent leur phénotype normal et synthétisent du collagène de type II et des agrégats d'aggrécane spécifiques aux tissus. En culture en agarose, les protéoglycanes synthétisés par la cellule sont libérés dans le milieu pendant 50 jours. À titre de comparaison, dans une culture monocouche, la phase cellulaire est surchargée en glycosaminoglycanes dès les 5 à 6 premiers jours de culture; en culture en milieu, après une synthèse et une libération accrues de glycosaminoglycanes au cours des 8 à 10 premiers jours, leur quantité diminue progressivement. Néanmoins, le comportement des chondrocytes en culture en agarose diffère de celui observé in vivo. En agarose, un grand nombre d'agrégats d'aggrécane synthétisés contiennent des molécules plus petites et moins nombreuses qu'in vivo. Le TGF-β stimule la synthèse des protéoglycanes dans l'explant, mais la réduit dans l'agarose.
L'alginate est un polysaccharide linéaire obtenu à partir d'algues brunes. En présence de cations divalents, tels que les ions Ca₂ +, ce polymère se transforme en gel. Chaque chondrocyte emprisonné dans l'alginate est entouré d'une matrice de polysaccharides chargés négativement, dont les pores sont comparables à ceux du cartilage hyalin. La matrice formée par les chondrocytes dans les billes d'alginate est composée de deux compartiments: une fine couche de matrice associée aux cellules correspondant à la matrice péricellulaire et territoriale du cartilage articulaire, et une matrice plus distante, équivalente à la matrice interterritoriale du tissu natif. Au 30e jour de culture, les volumes relatifs et absolus occupés par les cellules et chacun des deux compartiments d'une bille d'alginate sont presque identiques à ceux du cartilage natif. Pendant près de 30 jours, les chondrocytes conservent leur forme sphérique et produisent de l'aggrécane, dont les propriétés hydrodynamiques sont similaires à celles des molécules d'aggrécane présentes dans la matrice cartilagineuse articulaire, ainsi que des molécules de collagène de types II, IX et XI. Parallèlement, comme dans d'autres cultures en suspension, des cellules aplaties sont présentes à la surface des billes d'alginate, produisant une petite quantité de molécules de collagène de type I, directement libérées dans le milieu et non incorporées à la matrice extracellulaire. Une prolifération modérée des chondrocytes est observée dans les billes d'alginate. Après 8 mois de culture en gel d'alginate, les chondrocytes matures conservent leur activité métabolique et continuent de synthétiser du collagène de type II et de l'aggrécane spécifiques aux tissus.
H. Tanaka et al. (1984) ont étudié les propriétés de diffusion de diverses molécules naturelles dans l'alginate et ont constaté que les molécules de plus de 70 kDa ne diffusaient pas à travers l'alginate. Ainsi, la culture cellulaire dans l'alginate est adaptée à l'étude de la régulation de la biosynthèse matricielle et de l'organisation de la matrice extracellulaire (MEC). La disponibilité de cellules cultivées dans l'alginate permet d'étudier l'action des facteurs de régulation peptidique et des agents pharmacologiques aux niveaux transcriptionnel, post-transcriptionnel et traductionnel.
Français Les chondrocytes sont également cultivés dans une matrice de fibres de collagène de types I et II. S. Nehrer et al. (1997) ont comparé le fonctionnement de chondrocytes canins dans des matrices poreuses de polymère collagène-protéoglycane contenant des collagènes de différents types. Ils ont trouvé des différences importantes dans la morphologie de la fonction biosynthétique des chondrocytes cultivés dans des matrices de collagène contenant du collagène de types I et II. Les cellules d'une matrice de collagène de type II ont conservé leur forme sphérique, tandis que dans le collagène de type I, elles avaient une morphologie de type fibroblaste. De plus, dans une matrice de collagène de type II, les chondrocytes ont produit une plus grande quantité de glycosaminoglycanes. J. van Susante et al. (1995) ont comparé les propriétés de chondrocytes cultivés dans un gel d'alginate et de collagène (type I). Les auteurs ont constaté une augmentation significative du nombre de cellules dans le gel de collagène, mais dès le sixième jour de culture, les cellules ont perdu leur phénotype caractéristique, se transformant en cellules de type fibroblaste. Dans le gel d'alginate, une diminution du nombre de cellules a été observée, mais les chondrocytes ont conservé leur phénotype normal. Dans le gel de collagène, le nombre de protéoglycanes par cellule était significativement plus élevé que dans l'alginate, mais une diminution de la synthèse des éléments de la matrice a été observée dans le gel dès le sixième jour de culture, tandis que dans l'alginate, la synthèse a continué d'augmenter.
La matrice de fibrine tridimensionnelle solide est une substance naturelle qui soutient les chondrocytes en suspension dans un phénotype différencié. Elle peut également être utilisée comme support pour la transplantation de chondrocytes. Les avantages de la fibrine sont l'absence de cytotoxicité, la capacité de remplissage et la capacité adhésive. Des études histologiques et biochimiques, l'autoradiographie et la microscopie électronique ont montré que les chondrocytes en gel de fibrine conservent leur morphologie, prolifèrent et produisent de la matrice même après deux semaines de culture. Cependant, G. Homminga et al. (1993) ont rapporté que la désintégration de la fibrine commence après trois jours de culture et que la dédifférenciation des chondrocytes progresse.
Suspension de chondrocytes dans de la matrice extracellulaire artificielle (synthétique)
Les implants cartilagineux destinés à la chirurgie reconstructive ou orthopédique peuvent être obtenus en cultivant des chondrocytes isolés in vitro dans une matrice synthétique biocompatible.
Les chondrocytes cultivés en acide polyglycolique prolifèrent et conservent une morphologie et un phénotype normaux pendant 8 semaines. Le complexe chondrocytes-acide polyglycolique est constitué de cellules, de glycosaminoglycanes et de collagènes, et possède une capsule de collagène externe. Cependant, ces implants contiennent deux types de molécules de collagène: I et II. Les implants issus de chondrocytes dédifférenciés par une série de passages contiennent une quantité plus importante de glycosaminoglycanes et de collagènes que ceux issus de chondrocytes principalement indifférenciés.
L. Freed et al. (1993b) ont comparé le comportement de cultures de chondrocytes humains et bovins dans de l'acide polyglycolique fibreux (FPGA) et de l'acide polylactique poreux (PPLA). Après 6 à 8 semaines de culture de chondrocytes bovins dans du FPGA ou du PPLA, les auteurs ont observé une prolifération cellulaire et une régénération de la matrice cartilagineuse. Dans le FPGA, les chondrocytes avaient une forme sphérique et étaient situés dans des lacunes entourées d'une matrice cartilagineuse. Après 8 semaines de culture in vitro, le tissu régénéré contenait jusqu'à 50 % de matière sèche (4 % de masse cellulaire, 15 % de glycosaminoglycanes et 31 % de collagènes). Dans le PPLA, les cellules avaient une forme fusiforme et une petite quantité de glycosaminoglycanes et de collagène. Dans le FPGA, la croissance cellulaire était 2 fois plus intense que dans le PPLA. In vivo, les chondrocytes cultivés en VPGK et PPLC ont produit un tissu histologiquement similaire au cartilage en 1 à 6 mois. Les implants contenaient des glycosaminoglycanes et des collagènes de type I et II.
Des chondrocytes fœtaux bovins ont été cultivés dans du polyéthylène poreux haute densité hydrophobe et hydrophile. Après 7 jours d'incubation dans les deux substrats, les cellules conservaient une forme sphérique et contenaient principalement du collagène de type II. Après 21 jours de culture, la matrice hydrophile contenait davantage de collagène de type II que la matrice hydrophobe.
Le tissu cartilagineux peut également être obtenu par culture en monocouche sur des filtres Millicell-CM. Un pré-revêtement des filtres avec du collagène est nécessaire à la fixation des chondroïtines. L'examen histologique de la culture démontre l'accumulation de chondrocytes dans la matrice extracellulaire (MEC), contenant des protéoglycanes et du collagène de type II. Aucun collagène de type I n'a été détecté dans cette culture. Les chondrocytes du tissu cartilagineux obtenu sont sphériques, mais légèrement aplatis à la surface. L'épaisseur du tissu néoformé augmente avec le temps et dépend de la densité initiale de la monocouche cellulaire. Dans des conditions de culture optimales, l'épaisseur du tissu cartilagineux atteint 110 μm; l'organisation de ses cellules et de son collagène en couches superficielles et profondes est similaire à celle du cartilage articulaire. La MEC contient environ trois fois plus de collagène et de protéoglycanes. Après deux semaines de culture, une accumulation de matrice a été observée, permettant l'extraction du tissu du filtre et sa transplantation.
Sims et al. (1996) ont étudié la culture de chondrocytes dans un gel d'oxyde de polyéthylène, une matrice polymère encapsulée permettant le transfert d'un grand nombre de cellules par injection. Six semaines après l'injection dans le tissu sous-cutané de souris athymiques, un nouveau cartilage s'est formé, caractérisé morphologiquement par une opalescence blanche similaire à celle du cartilage hyalin. Les données histologiques et biochimiques ont indiqué la présence de chondrocytes en prolifération active produisant de la matrice extracellulaire.
Explication
L'explantation de tissu cartilagineux permet d'étudier ses processus d'anabolisme et de catabolisme, le maintien de l'homéostasie, la résorption et la réparation. Les chondrocytes des explants cartilagineux conservent un phénotype normal et une composition de matrice extracellulaire (MEC) similaire à ceux du cartilage articulaire in vivo. Après 5 jours de culture en présence de sérum, un niveau constant de synthèse et de dégradation naturelle est atteint. La résorption tissulaire peut être accélérée en culture principale et en culture avec ajout de sérum grâce à divers agents, tels que l'IL-IB, le TNF-α, les lipopolysaccharides bactériens, les dérivés de l'acide rétinoïque ou les radicaux oxygénés actifs. Pour étudier la réparation du cartilage, ses dommages sont induits par des médiateurs inflammatoires solubles (H₂O₂, IL 1, TNF-α) ou par la rupture physique de la matrice.
La méthode de culture organotypique est un modèle pour les études in vitro des effets de facteurs externes isolés sur les chondrocytes et la matrice environnante. In vivo, les chondrocytes sont dispersés dans la matrice extracellulaire et n'entrent pas en contact les uns avec les autres. La culture d'explants de cartilage articulaire préserve cette organisation structurale, ainsi que les interactions spécifiques entre les chondrocytes et le milieu extracellulaire environnant. Ce modèle est également utilisé pour étudier les effets du stress mécanique, des agents pharmacologiques, des facteurs de croissance, des cytokines et des hormones sur le métabolisme du cartilage.
Un autre avantage de l'explantation de tissu cartilagineux est l'absence de dommages aux chondrocytes sous l'action d'enzymes protéolytiques ou de facteurs mécaniques, ce qui est inévitable lors de l'isolement cellulaire. Les récepteurs et autres protéines et glycoprotéines membranaires sont protégés des facteurs dommageables.
 [ 17 ], [ 18 ], [ 19 ], [ 20 ], [ 21 ]
[ 17 ], [ 18 ], [ 19 ], [ 20 ], [ 21 ]
Culture de chondrons
Le chondron est une unité structurale, fonctionnelle et métabolique du cartilage articulaire, constituée d'un chondrocyte, de sa matrice péricellulaire et d'une capsule filamenteuse compacte, et responsable de l'homéostasie matricielle. Les chondrons sont extraits mécaniquement du cartilage et collectés par plusieurs homogénéisations successives à basse vitesse. Les chondrons isolés de zones de différentes profondeurs cartilagineuses peuvent être classés en quatre catégories: chondrons simples, chondrons appariés, chondrons multiples (trois ou plus) disposés linéairement (colonnes de chondrons) et amas de chondrons.
Les chondrons simples se trouvent généralement dans les couches moyennes du cartilage intact; les chondrons appariés se situent à la frontière des couches moyennes et profondes; les chondrons multiples disposés linéairement sont typiques des couches profondes du cartilage intact. Enfin, les amas de chondrons sont constitués de groupes organisés aléatoirement de chondrons simples et appariés, qui conservent un état agrégé après homogénéisation. Les amas de chondrons sont de grands fragments de cartilage, contenant généralement plusieurs chondrons et des fibrilles de collagène disposées radialement, une organisation typique des couches profondes de la matrice. Les chondrons sont immobilisés dans de l'agarose transparente, ce qui permet d'étudier leur structure, leur composition moléculaire et leur activité métabolique. Le système chondron-agarose est considéré comme un micromodèle du cartilage, qui diffère du système traditionnel chondrocyte-agarose par la préservation du microenvironnement naturel et l'absence de nécessité de synthèse et d'assemblage. La culture de chondrons est un modèle pour l'étude des interactions entre les cellules et la matrice du cartilage articulaire, en conditions normales et pathologiques.
 [ 22 ], [ 23 ], [ 24 ], [ 25 ], [ 26 ], [ 27 ]
[ 22 ], [ 23 ], [ 24 ], [ 25 ], [ 26 ], [ 27 ]
Culture de chondrocytes immortels
Des virus contenant de l'ADN recombinant ou des oncogènes, capables de rendre une cellule « immortelle », sont utilisés pour créer des lignées cellulaires permanentes. Les chondrocytes immortels ont la capacité de proliférer à l'infini tout en conservant un phénotype stable. F. Mallein-Gerin et al. (1995) ont montré que l'oncogène SV40T induit la prolifération de chondrocytes de souris, qui continuent d'exprimer de manière stable les collagènes de types II, IX et XI, ainsi que l'aggrécane articulaire et la protéine de liaison. Cependant, une telle lignée cellulaire acquiert la capacité de synthétiser le collagène de type I lors de sa culture en monocouche ou en gel d'agarose.
W. Horton et al. (1988) ont décrit une lignée de cellules immortelles présentant un faible niveau d'expression de l'ARNm du collagène de type II. Ces cellules ont été obtenues par transformation avec un rétrovirus murin contenant les oncogènes I-myc et y-ra. Ce type de cellules constitue un modèle unique pour l'étude des interactions de la matrice articulaire en l'absence de collagène de type II, ainsi que de la régulation de sa synthèse.
La culture de chondroprites avec des gènes mutés ou supprimés est un modèle pratique pour étudier leur fonction physiologique. Ce modèle est particulièrement adapté à l'étude du rôle de molécules spécifiques dans l'organisation de la matrice cartilagineuse ou à l'étude des effets de divers facteurs régulateurs sur le métabolisme cartilagineux. Les chondrocytes avec un gène supprimé pour le collagène de type IX synthétisent des fibrilles de collagène plus larges que la normale, indiquant que le collagène de type IX régule le diamètre des fibrilles. Comme indiqué au chapitre 1, une mutation du gène COLAI codant pour le collagène de type II a récemment été découverte dans des familles atteintes d'arthrose généralisée primaire. Pour étudier l'effet du collagène de type II mutant sur la matrice articulaire, R. Dharmrvaram et al. (1997) ont transfecté (infecté par un acide nucléique étranger) le gène COL 2 AI défectueux (l'arginine en position 519 est remplacée par la cystéine) dans des chondrocytes fœtaux humains in vitro.
Système de coculture. Dans l'articulation, le cartilage interagit avec d'autres types de cellules contenues dans la membrane synoviale, le liquide synovial, les ligaments et l'os sous-chondral. Le métabolisme des chondrocytes peut être affecté par divers facteurs solubles synthétisés par ces cellules. Ainsi, dans l'arthrite, le cartilage articulaire est détruit par les enzymes protéolytiques et les radicaux libres produits par les cellules synoviales. C'est pourquoi des modèles appelés cocultures ont été développés pour étudier les interactions complexes entre le cartilage et les tissus environnants.
S. Lacombe-Gleise et al. (1995) ont cultivé des chondrocytes et des ostéoblastes de lapin dans un système de coculture (COSTAR) où les cellules étaient séparées par une membrane microporeuse (0,4 μm) permettant l'échange entre les deux types cellulaires sans contact direct. Cette étude a démontré la capacité des ostéoblastes à stimuler la croissance des chondrocytes via des médiateurs solubles.
AM Malfait et ses co-auteurs (1994) ont étudié la relation entre les monocytes et les chondrocytes du sang périphérique. Ce modèle est adapté à l'étude des processus médiés par les cytokines dans les arthropathies inflammatoires (polyarthrite rhumatoïde, spondylarthrite séronégative, etc.). Les auteurs du modèle ont séparé les cellules à l'aide d'une membrane de liaison aux protéines dont les pores ont un diamètre de 0,4 µm. L'étude a montré que les monocytes stimulés par le lipopolysaccharide produisaient de l'IL-1 et du TNF-α, qui inhibaient la synthèse d'aggrécane par les chondrocytes et contribuaient à la dégradation des agrégats d'aggrécane déjà synthétisés.
K. Tada et al. (1994) ont créé un modèle de coculture dans lequel des cellules endothéliales dans un gel de collagène (type I) ont été placées dans une chambre interne séparée de la chambre externe avec des chondrocytes placés à l'intérieur par un filtre avec une taille de pores de 0,4 μm. Dans un état d'isolement complet de la chambre externe, les cellules endothéliales humaines ont formé des tubes dans un gel de collagène en présence d'EGF ou de TGF-α. Lorsque les deux types de cellules ont été cultivés simultanément, la formation de tubes dépendante du TGF-α par les cellules endothéliales a été inhibée. L'inhibition de ce processus par les chondrocytes a été partiellement éliminée par des anticorps anti-TGF-β. On peut supposer que le TGF-β produit par les chondrocytes inhibe la vascularisation du cartilage lui-même.
S. Groot et al. (1994) ont cultivé simultanément des chondrocytes provenant des zones osseuses hypertrophiées et prolifératives d'un fœtus de souris âgé de 16 jours avec des fragments de tissu cérébral. Après 4 jours de culture, une transdifférenciation des chondrocytes en ostéoblastes et un début de formation ostéoïde ont été observés. Après 11 jours de culture, une partie du cartilage a été remplacée par du tissu osseux et la matrice osseuse a été partiellement calcifiée. Certains neuropeptides et neurotransmetteurs produits par le tissu cérébral affectent le métabolisme des ostéoblastes ou possèdent des récepteurs pour ceux-ci. Parmi eux figurent la noradrénaline, le peptide intestinal vasoactif, le peptide lié au gène de la calcitonine, la substance P et la somatostatine. Des fragments de tissu cérébral cultivés avec des chondrocytes peuvent produire certains des facteurs listés, capables d'induire le processus de transdifférenciation des chondrocytes en ostéoblastes.
 [ 28 ], [ 29 ], [ 30 ], [ 31 ], [ 32 ], [ 33 ]
[ 28 ], [ 29 ], [ 30 ], [ 31 ], [ 32 ], [ 33 ]
L'influence des facteurs externes sur la culture des chondrocytes
L'influence de la tension en oxygène sur le métabolisme des chondrocytes
Dans la plupart des cas, les cultures de chondrocytes se développent dans des conditions de tension atmosphérique en oxygène. Cependant, il est bien connu qu'in vivo, les chondrocytes existent en conditions hypoxiques et que la tension en oxygène varie selon les pathologies. Au cours du processus de maturation, des modifications significatives de l'apport sanguin aux épiphyses sont observées. La vascularisation variant selon les zones du cartilage de croissance, la tension en oxygène y varie également. C. Brighton et R. Heppenstall (1971) ont démontré que dans la plaque tibiale de lapin, la tension en oxygène de la zone hypertrophiée est plus faible que dans le cartilage environnant. Les mesures de certains paramètres métaboliques ont montré que les chondrocytes sont capables de réagir rapidement aux variations locales de concentration en oxygène. Tout d'abord, à faible tension en oxygène, sa consommation par les chondrocytes diminue. Lorsque la tension en oxygène diminue de 21 à 0,04 %, l'utilisation du glucose augmente, l'activité des enzymes glycolytiques et la synthèse d'acide lactique augmentent. Même à faible tension en oxygène, la quantité absolue d'ATP, d'ADP et d'AMP reste stable. Ces données indiquent que le métabolisme des chondrocytes vise une conservation maximale de l'énergie. Cependant, l'activité de synthèse, et donc les processus de réparation, changent en conditions hypoxiques.
Une tension élevée en oxygène affecte également le métabolisme des chondrocytes, entraînant une diminution de la synthèse des protéoglycanes et de l'ADN, ainsi qu'une dégradation de la matrice cartilagineuse. Ces effets s'accompagnent généralement de la production de radicaux libres oxygénés.
L'influence de la concentration ionique et de la pression osmotique de l'environnement sur la fonction des chondrocytes
Dans le cartilage natif, la concentration en ions diffère significativement de celle des autres tissus: la teneur en sodium du milieu extracellulaire est de 250 à 350 mmol et son osmolarité de 350 à 450 mosmol. Lorsque les chondrocytes sont isolés de la matrice extracellulaire et incubés dans un milieu standard (DMEM (milieu essentiel minimal de Dulbecco), dont l'osmolarité est de 250 à 280,7 mosmol), l'environnement cellulaire change radicalement. De plus, la concentration en calcium et en potassium dans les milieux standard est significativement plus faible que dans le tissu natif, et la concentration en anions est significativement plus élevée.
L'ajout de saccharose au milieu augmente son osmolarité et induit une augmentation intracellulaire transitoire de la concentration d' anions H + et calcium dans le cytosol. De telles modifications intracellulaires peuvent affecter les processus de différenciation des chondrocytes et leur activité métabolique. J. Urban et al. (1993) ont constaté que l'incorporation de35 8-sulfate et de 3 H-proline par des chondrocytes isolés incubés dans du DMEM standard pendant 2 à 4 heures ne représentait que 10 % de celle du tissu natif. L'intensité de la synthèse a atteint un maximum à une osmolarité du milieu extracellulaire de 350 à 400 mosmol, tant dans les chondrocytes fraîchement isolés que dans les explants de tissu cartilagineux. De plus, le volume des chondrocytes a augmenté de 30 à 40 % après avoir placé les cellules isolées dans du DMEM standard de l'osmolarité spécifiée. Cependant, lors de la culture de chondrocytes dans des conditions d'osmolarité non physiologique pendant 12 à 16 heures, les cellules s'adaptent aux nouvelles conditions, réduisant l'intensité de la biosynthèse proportionnellement au changement d'osmolarité de l'environnement extracellulaire.
P. Borgetti et al. (1995) ont étudié l'effet de l'osmolarité du milieu extracellulaire sur la croissance, la morphologie et la biosynthèse des chondrocytes de porc. Les auteurs ont démontré des caractéristiques biochimiques et morphologiques similaires des chondrocytes cultivés dans des milieux d'osmolarité de 0,28 et 0,38 mosmol. À une osmolarité moyenne de 0,48 mosmol, une diminution de la prolifération cellulaire et de la synthèse protéique a été observée pendant les 4 à 6 premières heures de culture, mais ces paramètres se sont ensuite rétablis pour finalement atteindre les valeurs témoins. Lorsque les chondrocytes ont été cultivés dans un milieu d'osmolarité de 0,58 mosmol, les cellules ont perdu la capacité de maintenir l'intensité physiologique des processus prolifératifs, et après 6 jours, le nombre de chondrocytes a été significativement réduit. À une osmolarité moyenne de 0,58 mosmol, une profonde inhibition de la synthèse protéique a été observée. De plus, lorsqu'ils sont cultivés dans un milieu avec une osmolarité de 0,28-0,38 mOsm, les chondrocytes conservent leur phénotype physiologique; à une osmolarité plus élevée (0,48-0,58 mOsm), des modifications significatives de la morphologie cellulaire se produisent, se manifestant par la perte du phénotype caractéristique, la transformation des chondrocytes en cellules de type fibroblaste et la perte de la capacité des cellules à assembler les protéoglycanes matriciels. Les résultats de cette étude indiquent la capacité des chondrocytes à répondre à des fluctuations limitées de l'osmolarité du milieu extracellulaire.
Les variations de concentration d'autres ions peuvent également affecter les processus de biosynthèse dans les chondrocytes. Ainsi, le degré d'incorporation de 35 S (sulfate) augmente de moitié avec une augmentation de la concentration en ions potassium de 5 mmol (la concentration dans le milieu standard DM EM) à 10 mmol (la concentration dans la MEC in vivo). Des concentrations de calcium inférieures à 0,5 mmol ont favorisé la production de collagène par les chondrocytes bovins matures, tandis qu'une concentration de 1 à 2 mmol (correspondant à la concentration dans le milieu standard DM EM) a entraîné une diminution significative de la synthèse de collagène. Une augmentation modérée de la biosynthèse a été observée à des taux de calcium élevés (2 à 10 mmol). Différents cations participent à la fixation des chondrocytes aux protéines de la MEC. Ainsi, les ions magnésium et manganèse assurent la fixation à la fibronectine et au collagène de type II, tandis que les ions calcium ne participent pas à la fixation des chondrocytes aux protéines. Ainsi, les résultats des études décrites indiquent l'influence des changements dans les ions extracellulaires de potassium, de sodium, de calcium et d'osmolarité du milieu sur la fonction biosynthétique des chondrocytes incubés dans des milieux standards.
Effet du stress mécanique sur le métabolisme des chondrocytes
L'immobilisation articulaire provoque une atrophie réversible du cartilage, ce qui indique la nécessité de stimuli mécaniques pour le bon fonctionnement des processus métaboliques de la matrice extracellulaire (MEC). Dans la plupart des cas, les modèles de culture cellulaire utilisés sont à pression atmosphérique normale. M. Wright et al. (1996) ont montré que l'environnement mécanique affecte le métabolisme des chondrocytes, la réponse cellulaire dépendant de l'intensité et de la fréquence des charges compressives. Des expériences de charge sur des explants de cartilage articulaire intact in vitro ont démontré une diminution de la synthèse de protéines et de protéoglycanes sous l'action d'une charge statique, tandis qu'une charge dynamique stimule ces processus. Les mécanismes exacts de l'effet de la charge mécanique sur le cartilage sont complexes et sont probablement associés à la déformation cellulaire, à la pression hydrostatique, à la pression osmotique, au potentiel électrique et aux récepteurs cellulaires de surface pour les molécules de la matrice. Pour étudier l'effet de chacun de ces paramètres, il est nécessaire de créer un système permettant de faire varier un paramètre indépendamment. Par exemple, la culture d'explants ne convient pas à l'étude de la déformation cellulaire, mais elle peut être utilisée pour étudier l'effet général de la pression sur l'activité métabolique des chondrocytes. La compression du cartilage entraîne une déformation cellulaire et s'accompagne également de l'apparition d'un gradient de pression hydrostatique, d'un potentiel électrique, d'un écoulement de fluide et de modifications de paramètres physicochimiques tels que la teneur en eau de la matrice, la densité de charge électrique et le niveau de pression osmotique. La déformation cellulaire peut être étudiée à l'aide de chondrocytes isolés immergés dans un gel d'agarose ou de collagène.
Plusieurs systèmes ont été développés pour étudier l'effet de la stimulation mécanique sur la culture de chondrocytes. Certains chercheurs utilisent des systèmes dans lesquels une pression est appliquée à la culture cellulaire par l'intermédiaire de la phase gazeuse. Ainsi, JP Veldhuijzen et al. (1979), en utilisant une pression de 13 kPa au-dessus de la pression atmosphérique avec une basse fréquence (0,3 Hz) pendant 15 min, ont observé une augmentation de la synthèse d'AMPc et de protéoglycanes et une diminution de la synthèse d'ADN. R. Smith et al. (1996) ont montré qu'une exposition intermittente d'une culture de chondrocytes bovins primaires à une pression hydrostatique (10 MPa) avec une fréquence de 1 Hz pendant 4 h provoquait une augmentation de la synthèse d'aggrécane et de collagène de type II, alors qu'une pression constante n'affectait pas ces processus. En utilisant un système similaire, Wright et al. (1996) ont rapporté qu'une pression cyclique sur la culture cellulaire est associée à une hyperpolarisation de la membrane cellulaire des chondrocytes et à l'activation des canaux potassiques dépendants du Ca 2+. Ainsi, les effets de la pression cyclique sont médiés par des canaux ioniques activés par l'étirement dans la membrane des chondrocytes. La réponse des chondrocytes à la pression hydrostatique dépend des conditions de culture cellulaire et de la fréquence de la charge appliquée. Ainsi, la pression hydrostatique cyclique (5 MPa) diminue l'incorporation de sulfate dans la monocouche de chondrocytes à une fréquence de 0,05, 0,25 et 0,5 Hz, tandis qu'à une fréquence supérieure à 0,5 Hz, elle augmente dans l'explant cartilagineux.
M. Bushmann et al. (1992) ont rapporté que les chondrocytes en gel d'agarose modifient leur biosynthèse en réponse à une charge mécanique statique et dynamique, de la même manière que l'organe intact en culture. Les auteurs ont constaté que la charge mécanique génère un stimulus hyperosmotique entraînant une diminution du pH des chondrocytes.
L'effet de l'étirement mécanique peut être étudié sur une culture cellulaire immergée dans un gel. La force d'étirement peut être créée à l'aide d'un vide contrôlé par ordinateur. Lorsque le système est sous un certain degré de vide, le fond de la boîte de Petri contenant la culture cellulaire s'allonge d'une valeur connue; la déformation est maximale sur les bords du fond de la boîte et minimale au centre. L'étirement est également transmis aux chondrocytes cultivés dans la boîte de Petri. Grâce à cette méthode, K. Holm-vall et al. (1995) ont montré que dans les cellules de chondrosarcome cultivées dans un gel de collagène (type II), l'expression de l'ARNm d'une 2-intégrine est augmentée . L'intégrine 2-β est capable de se lier au collagène de type II. Elle est considérée comme un mécanorécepteur, car elle interagit avec les protéines de liaison à l'actine, reliant ainsi la matrice extracellulaire (MEC) et le cytosquelette.
L'effet du pH sur le métabolisme des chondrocytes
Le pH du liquide interstitiel de la matrice extracellulaire du cartilage est plus acide que dans les autres tissus. A. Maroudas (1980) a déterminé le pH de la matrice cartilagineuse articulaire à 6,9. B. Diamant et al. (1966) ont trouvé un pH de 5,5 dans des conditions pathologiques. On sait que les chondrocytes vivent à faible PO2, ce qui indique le rôle important de la glycolyse (95 % du métabolisme du glucose) dans le métabolisme de ces cellules; la glycolyse s'accompagne de la production d'une grande quantité d'acide lactique.
Outre l'acidification de l'environnement par les produits de la glycolyse, les composants de la matrice eux-mêmes sont d'une grande importance. La grande quantité de charges négatives fixes sur les protéoglycanes modifie la composition ionique extracellulaire: on observe une forte concentration de cations libres (par exemple, H +, Na +, K + ) et une faible concentration d'anions (par exemple, O2, HCO3 ). De plus, sous l'influence d'une charge mécanique, l'eau est expulsée de la matrice extracellulaire, ce qui entraîne une augmentation de la concentration de charges négatives fixes et l'attraction de davantage de cations dans la matrice. Ceci s'accompagne d'une diminution du pH de l'environnement extracellulaire, ce qui affecte le pH intracellulaire, modifiant ainsi le métabolisme des chondrocytes. R. Wilkin et A. Hall (1995) ont étudié l'effet du pH de l'environnement extracellulaire et intracellulaire sur la biosynthèse de la matrice par des chondrocytes bovins isolés. Ils ont observé une double modification de la synthèse de la matrice avec une diminution du pH. Français Une légère diminution du pH (7,4
 [ 34 ], [ 35 ], [ 36 ], [ 37 ], [ 38 ], [ 39 ], [ 40 ]
[ 34 ], [ 35 ], [ 36 ], [ 37 ], [ 38 ], [ 39 ], [ 40 ]
L'influence de la composition du milieu de culture sur le métabolisme des chondrocytes
Le milieu de culture des chondrocytes doit correspondre aux conditions expérimentales. Ces dernières années, le sérum de veau a été utilisé pour optimiser les conditions de culture. Cependant, l'utilisation du sérum nécessite la prise en compte de plusieurs points importants:
- croissance vers l'extérieur de cellules à partir de la périphérie des tissus dans les cultures d'organes,
- variabilité dans la composition des sérums de différentes séries,
- la présence de composants inconnus dans ceux-ci,
- risque accru d’interférences et d’artefacts lors de l’étude de l’influence de divers facteurs biologiques sur l’activité métabolique des cellules.
Un exemple de ce dernier est une étude de l'effet de l'EGF sur les chondrocytes cartilagineux chez le rat. L'EGF a stimulé l'incorporation de 3H -thymidine et une augmentation de la teneur en ADN dans la culture. Cet effet était plus prononcé à de faibles concentrations sériques (< 1 %), mais à des concentrations élevées (> 7,5 %), il disparaissait.
Il est bien connu que les niveaux de synthèse et de dégradation dans le DMEM supplémenté en sérum de veau sont significativement plus élevés qu'in vivo. Les différences entre le métabolisme in vivo et in vitro peuvent être dues à des différences entre le liquide synovial et le milieu dans lequel les cellules sont cultivées. Lee et al. (1997) ont cultivé de jeunes chondrocytes bovins en agarose en utilisant un milieu nutritif contenant du DMEM supplémenté avec 20 % de sérum de veau et une grande quantité de liquide synovial allogénique normal. La présence de liquide synovial dans le milieu a induit une augmentation de la quantité de protéoglycanes, jusqu'à 80 % de la quantité totale de liquide synovial. Ces résultats indiquent que le liquide synovial en culture induit un niveau de métabolisme similaire à celui in vivo, avec un niveau élevé de synthèse de glycosaminoglycanes et un faible niveau de division cellulaire.
Français G. Verbruggen et al. (1995) ont montré que la synthèse de 35 S-arrpeKaHa par des chondrocytes humains cultivés en agarose dans du DMEM sans sérum représentait 20 à 30 % du niveau de synthèse observé dans du DMEM supplémenté avec 10 % de sérum de veau. Les auteurs ont déterminé dans quelle mesure l'IGF-1, l'IGF-2, le TGF-R ou l'insuline rétablissaient la production d'aggrécane en milieu sans sérum. Les auteurs ont conclu que 100 ng/ml d'insuline, d'IGF-1 ou d'IGF-2 rétablissaient partiellement la synthèse d'aggrécane à 39-53 % du niveau témoin. Aucune synergie ni cumul n'a été observée avec une combinaison des facteurs énumérés. Dans le même temps, 10 ng/ml de TGF-R en présence de 100 ng/ml d'insuline stimulaient la synthèse d'aggrécane à 90 % ou plus du niveau de référence. Enfin, la transferrine sérique humaine, seule ou en association avec l'insuline, n'a pas affecté la synthèse d'aggrécane. Lorsque le sérum de veau a été remplacé par de l'albumine sérique bovine, la teneur en agrégats d'aggrécane a diminué de manière significative. L'enrichissement du milieu de culture en insuline, IGF ou TGF-R a partiellement restauré la capacité des cellules à produire des agrégats d'aggrécane. De plus, l'IGF-1 et l'insuline sont capables de maintenir l'homéostasie dans les cultures cellulaires. Après 40 jours de culture dans un milieu enrichi avec 10-20 ng/ml d'IGF-1, la synthèse de protéoglycanes était maintenue au même niveau, voire à un niveau supérieur, par rapport au milieu contenant 20 % de sérum de veau. Les processus cataboliques se sont déroulés plus lentement dans le milieu enrichi en IGF-1 que dans le milieu enrichi avec une solution d'albumine à 0,1 %, mais un peu plus rapidement dans le milieu enrichi avec 20 % de sérum. Dans les cultures à longue durée de vie, 20 ng/ml d'IGF-1 maintiennent un état stable des cellules.
D. Lee et al. (1993) ont comparé l'effet de la composition du milieu de culture (DMEM, DMEM + 20 % de sérum de veau, DMEM + 20 ng/ml d'IGF-1) sur la synthèse d'ADN dans une culture d'explant de tissu cartilagineux, une culture en monocouche et une suspension d'agarose. Lors de la culture en agarose en présence de sérum, les auteurs ont observé une tendance des chondrocytes à se regrouper en grands amas. Les cellules cultivées sans sérum ou avec IGF-1 ont conservé une forme ronde en agarose, se sont rassemblées en petits groupes, mais n'ont pas formé de gros agrégats. En monocouche, la synthèse d'ADN était significativement plus élevée dans le milieu contenant du sérum que dans le milieu enrichi en IGF-1; la synthèse d'ADN dans ce dernier était significativement plus élevée que dans le milieu non enrichi. Aucune différence dans la synthèse d'ADN n'a été constatée lorsque les chondrocytes ont été cultivés en suspension d'agarose dans un milieu non enrichi et dans un milieu avec IGF-1. Dans le même temps, la culture de suspensions de chondrocytes dans de l'agarose dans un milieu enrichi en sérum s'est accompagnée d'une incorporation accrue du radionucléotide 3 H-thymidine par rapport à d'autres milieux.
La vitamine C est nécessaire à l'activation des enzymes impliquées dans la formation d'une structure hélicoïdale stable des fibrilles de collagène. Les chondrocytes déficients en acide ascorbique synthétisent des précurseurs de collagène non hélicoïdaux sous-hydroxylés, sécrétés lentement. L'administration d'acide ascorbique (50 μg/ml) provoque l'hydroxylation des collagènes de types II et IX et leur sécrétion en quantités normales. L'ajout de vitamine C n'a pas affecté la synthèse des protéoglycanes. Par conséquent, la sécrétion de collagène est régulée indépendamment de celle des protéoglycanes.

