Virus de l'immunodéficience humaine (VIH)
Last reviewed: 01.06.2018

Le syndrome d'immunodéficience acquise (SIA) a été identifié comme une maladie spécifique en 1981 aux États-Unis, lorsqu'un certain nombre de jeunes ont développé des maladies graves causées par des micro-organismes non pathogènes ou faiblement pathogènes pour les personnes en bonne santé. Une étude du statut immunitaire des patients a révélé une forte diminution du nombre de lymphocytes en général et de lymphocytes T auxiliaires en particulier. Cette affection a été appelée SIDA (syndrome d'immunodéficience acquise). Le mode de contamination (contact sexuel, par le sang et ses préparations) a confirmé la nature infectieuse de la maladie.
L'agent causal du SIDA a été découvert en 1983 indépendamment par le Français L. Montagnier, qui l'a appelé LAV Lymphoadenopathy Associated Virus, car il l'a trouvé chez un patient atteint de lymphadénopathie; et l'Américain R. Gallo, qui a appelé le virus HTLV-III (Human T-lymphotropic Virus III): il avait précédemment découvert les virus lymphotropes I et II.
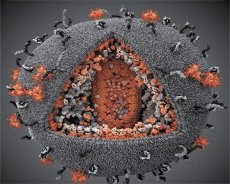
Une comparaison des propriétés des virus LAV et HTLV-III a permis de déterminer leur identité. Pour éviter toute confusion, le virus a été nommé VIH (virus de l'immunodéficience humaine, ou VIH) en 1986. Le VIH est de forme sphérique, avec un diamètre de 110 nm. L'enveloppe virale a la forme d'un polyèdre, composé de 12 pentagones et de 20 hexagones. Au centre et aux angles de chaque hexagone se trouve une molécule de protéine glycosylée gpl20 (le nombre 120 indique le poids moléculaire de la protéine en kilodaltons). Au total, 72 molécules gpl20 sont situées à la surface du virion sous la forme de pics particuliers, chacun étant associé à la protéine intramembranaire gp41. Ces protéines, avec la double couche lipidique, forment la supercapside (membrane) du virion.
Les protéines gpl20 et gp41 sont formées par coupure de la protéine précurseur Env par une protéase cellulaire. La protéine gp41 forme la « tige » de la protéine Spike en se liant, par son domaine cytoplasmique, à la protéine matricielle p17MA située directement sous l'enveloppe. Les molécules p17 interagissent pendant la maturation du virion pour former un icosaèdre sous l'enveloppe.
Dans la partie centrale du virion, la protéine p24 forme une capside conique. La partie rétrécie de la capside est reliée à la membrane du virion par la protéine rb. À l'intérieur de la capside se trouvent deux molécules identiques d'ARN génomique viral. Elles sont reliées par leur extrémité 5' à la protéine de nucléocapside p7NC. Cette protéine est intéressante car elle possède deux résidus d'acides aminés (motifs) riches en cystéine et en histidine et contenant un atome de zinc. On les appelle « doigts de zinc » car ils capturent les molécules d'ARN génomique pour les inclure dans les virions en formation. La capside contient également trois enzymes. La révertase (RT), ou complexe pol, comprend la transcriptase inverse, la RNase H et l'ADN polymérase ADN-dépendante. La révertase est présente sous la forme d'un hétérodimère p66/p51. La protéase (PR) – p10 – initie et met en œuvre le processus de maturation du virion. L'intégrase (IN) - p31, ou endonucléase, assure l'inclusion de l'ADN proviral dans le génome de la cellule hôte. La capside contient également une molécule d'ARN amorce (ARNtI"3).
Le génome d'ARN de la cellule est converti en génome d'ADN (provirus à ADN) grâce à la transcriptase inverse, composé de 9 283 paires de nucléotides. Il est délimité à gauche et à droite par des répétitions terminales longues (LTR): S'-LTR à gauche et 3'-LTR à droite. Les LTR contiennent chacun 638 paires de nucléotides.
Le génome du VIH est constitué de neuf gènes, dont certains se chevauchent aux extrémités (possèdent plusieurs cadres de lecture) et présentent une structure exonintron. Ils contrôlent la synthèse de neuf protéines structurales et de six protéines régulatrices.
L’importance des LTR pour le génome viral est qu’ils contiennent les éléments régulateurs suivants qui contrôlent son fonctionnement:
- signal de transcription (région promotrice);
- signal d'addition poly-A;
- signal de plafonnement;
- signal d'intégration;
- signal de régulation positive (TAR pour la protéine TAT);
- élément régulateur négatif (NRE pour la protéine NEF);
- un site de fixation de l'ARN amorce (tRNA™3) pour la synthèse de l'ADN du brin négatif à l'extrémité 3'; un signal à l'extrémité 5' du LTR qui sert d'amorce pour la synthèse de l'ADN du brin positif.
De plus, le LTR contient des éléments impliqués dans la régulation de l'épissage de l'ARNm et l'empaquetage des molécules d'ARNv dans la capside (élément Psi). Enfin, lors de la transcription du génome, deux signaux sont formés dans les longs ARNm pour la protéine REV, qui commutent la synthèse protéique: CAR (protéines régulatrices) et CRS (protéines structurales). Si la protéine REV se lie à CAR, des protéines structurales sont synthétisées; en son absence, seules des protéines régulatrices sont synthétisées.
Les gènes régulateurs suivants et leurs protéines jouent un rôle particulièrement important dans la régulation du fonctionnement du génome du virus:
- Protéine TAT, qui effectue un contrôle positif de la réplication virale et agit via la région régulatrice TAR;
- Protéines NEV et VPU, qui exercent un contrôle négatif de la réplication via la région NRE;
- Protéine REV, qui assure le contrôle positif-négatif. Elle contrôle le fonctionnement des gènes gag, pol et env et assure la régulation négative de l'épissage.
Ainsi, la réplication du VIH est sous triple contrôle: positif, négatif et positif-négatif.
La protéine VIF détermine l'infectiosité du virus nouvellement synthétisé. Elle est associée à la protéine de capside p24 et est présente dans le virion à raison de 60 molécules. La protéine NEF est représentée dans le virion par un petit nombre de molécules (5 à 10), possiblement associées à l'enveloppe.
La protéine VPR inhibe le cycle cellulaire en phase G2, participe au transport des complexes de préintégration dans le noyau cellulaire, active certains gènes viraux et cellulaires et augmente l'efficacité de la réplication virale dans les monocytes et les macrophages. La localisation des protéines VPR, TAT, REV et VPU dans le virion n'a pas été établie.
En plus de ses propres protéines, la membrane du virion peut contenir certaines protéines de la cellule hôte. Les protéines VPU et VPR participent à la régulation de la reproduction virale.
Variantes antigéniques du virus de l'immunodéficience humaine (VIH)
Le virus de l'immunodéficience humaine (VIH) est très variable. Même chez un même patient, des souches virales présentant des propriétés antigéniques très différentes peuvent être isolées. Cette variabilité est facilitée par la destruction intensive des cellules CD4+ et une puissante réponse anticorps à l'infection par le VIH. Une nouvelle forme de VIH, le VIH-2, biologiquement proche du VIH-1 mais immunologiquement différente, a été isolée chez des patients d'Afrique de l'Ouest. L'homologie de la structure primaire des génomes de ces virus est de 42 %. L'ADN du provirus VIH-2 contient 9 671 pb et son LTR 854 pb. Le VIH-2 a ensuite été isolé dans d'autres régions du monde. Il n'existe pas d'immunité croisée entre le VIH-1 et le VIH-2. Deux grandes formes de VIH-1 sont connues: O (Aberrant) et M (Majeur), cette dernière étant divisée en 10 sous-types (AJ). Huit sous-types (AH) circulent en Russie.
 [ 1 ], [ 2 ], [ 3 ], [ 4 ], [ 5 ], [ 6 ], [ 7 ], [ 8 ], [ 9 ], [ 10 ]
[ 1 ], [ 2 ], [ 3 ], [ 4 ], [ 5 ], [ 6 ], [ 7 ], [ 8 ], [ 9 ], [ 10 ]
Le mécanisme d'interaction du VIH avec la cellule
Après avoir pénétré dans l'organisme, le virus attaque d'abord les cellules contenant le récepteur CD4 qui lui est spécifique. Ce récepteur est présent en grande quantité dans les lymphocytes T auxiliaires, en plus faible quantité dans les macrophages et les monocytes, et les lymphocytes T auxiliaires sont particulièrement sensibles au virus.
Le virus de l'immunodéficience humaine (VIH) reconnaît les récepteurs CD4 grâce à sa protéine gpl20. Le processus d'interaction du VIH avec la cellule se déroule selon le schéma suivant: adsorption médiée par le récepteur -> puits recouvert -> vésicule recouverte -> lysosome. Dans ce dernier, la membrane du virion fusionne avec celle du lysosome, et la nucléocapside, libérée de la supercapside, pénètre dans le cytoplasme; en chemin vers le noyau, elle est détruite, libérant l'ARN génomique et les composants essentiels associés. Ensuite, la transcriptase inverse synthétise le brin négatif d'ADN sur l'ARN du virion, puis la RNase H détruit l'ARN du virion, et l'ADN polymérase virale synthétise le brin positif d'ADN. Les 5'-LTR et 3'-LTR se forment aux extrémités du provirus à ADN. Ce dernier peut rester inactif dans le noyau pendant un certain temps, mais il finit par s'intégrer au chromosome de la cellule cible grâce à son intégrase. Dans ce contexte, le provirus reste inactif jusqu'à ce que le lymphocyte T concerné soit activé par des antigènes microbiens ou d'autres cellules immunocompétentes. L'activation de la transcription de l'ADN cellulaire est régulée par un facteur nucléaire spécifique (NF-kB). Il s'agit d'une protéine de liaison à l'ADN produite en grande quantité lors de l'activation et de la prolifération des lymphocytes T et des monocytes. Cette protéine se lie à certaines séquences d'ADN cellulaire et à des séquences LTR similaires du provirus à ADN et induit la transcription de l'ADN cellulaire et du provirus à ADN. En induisant la transcription du provirus à ADN, elle assure la transition du virus d'un état inactif à un état actif et, par conséquent, d'une infection persistante à une infection productive. Le provirus peut rester inactif très longtemps. L'activation du virus est un moment critique de son interaction avec la cellule.
Dès que le virus pénètre dans la cellule, l' infection par le VIH commence – l'état de porteur du virus, qui peut durer dix ans ou plus; et dès l'activation du virus, la maladie – le SIDA – commence. Grâce à ses gènes régulateurs et à leurs produits, le virus commence à se reproduire activement. La protéine TAT peut multiplier par mille le taux de reproduction du virus. La transcription virale est complexe. Elle comprend la formation d'ARNm complet et sous-génomique, l'épissage de l'ARNm, puis la synthèse de protéines structurales et régulatrices.
La synthèse des protéines structurales se déroule comme suit. Tout d'abord, la polyprotéine précurseur Pr55Gag (une protéine de poids moléculaire de 55 kDa) est synthétisée. Elle contient quatre domaines principaux: matrice (MA), capside (CA), nucléocapside (NC) et le domaine rb, à partir desquels, suite à la coupure de Pr55Gag par la protéase virale (elle est auto-coupée d'une autre protéine précurseur, Gag-Pol), les protéines structurales p17, p24, p7 et rb sont formées, respectivement. La formation de la polyprotéine Pr55Gag est la condition principale de la formation des particules virales. C'est cette protéine qui détermine le programme de morphogenèse du virion. Il comprend séquentiellement les étapes de transport de la polyprotéine Gag vers la membrane plasmique, d'interaction avec elle et d'interactions protéine-protéine pendant la formation de la particule virale et son bourgeonnement. Pr55Gag est synthétisée sur des polyribosomes libres; Les molécules protéiques sont transportées vers la membrane, où elles sont ancrées par leurs régions hydrophobes. Le domaine CA joue un rôle majeur dans la conformation native de la protéine Gag. Le domaine NC assure l'inclusion (grâce à ses « doigts de zinc ») de deux molécules d'ARN génomique dans la particule virale en formation. La polyprotéine se dimérise initialement grâce à l'interaction des domaines matriciels. Ensuite, les dimères se combinent en complexes hexamériques (de 6 unités) grâce à l'interaction des domaines CA et NC. Enfin, les hexamères, se rejoignant sur leurs surfaces latérales, forment des virions sphériques immatures, à l'intérieur desquels est contenu l'ARN viral génomique, capturé par le domaine NC.
Une autre protéine précurseur, Prl60Gag-Pol (protéine de 160 kDa), est synthétisée suite à un décalage du cadre de lecture par le ribosome lors de la traduction de l'extrémité 3' du gène gag, dans la région située immédiatement en amont de la région codant pour la protéine rb. Cette polyprotéine Gag-Pol contient une séquence protéique Gag incomplète (1 à 423 acides aminés) et des séquences Pol incluant les domaines PR, RT et IN. Les molécules de polyprotéine Gag-Pol sont également synthétisées sur des polyribosomes libres et transportées vers la membrane plasmique. La polyprotéine Prl60Gagpol contient tous les sites d'interaction intermoléculaire et de liaison membranaire inhérents à la polyprotéine Gag. Par conséquent, les molécules de polyprotéine Gag-Pol fusionnent avec la membrane et, avec les molécules Gag, sont incluses dans les virions en formation, ce qui entraîne l'apparition d'une protéase active et le début du processus de maturation du virion. La protéase du VIH-1 n'est hautement active que sous forme de dimère; par conséquent, son auto-excision de Prl60Gag-Pol nécessite la dimérisation de ces molécules. La maturation du virion consiste en la coupure de Prl60Gag-Pol et Gag55 par la protéase active libérée aux sites qu'elle reconnaît; les protéines p17, p24, p7, p6, la révertase et l'intégrase se forment et s'associent à la structure virale.
La protéine Env est synthétisée sur les ribosomes associés aux membranes du réticulum endoplasmique, puis glycosylée, coupée par une protéase cellulaire en gp120 et gp41, et transportée à la surface cellulaire. Dans ce cas, gp41 pénètre la membrane et se lie aux domaines matriciels de la protéine Gag associée à la surface interne de la membrane. Cette liaison est préservée dans le virion mature.
Ainsi, l'assemblage des particules virales consiste en l'agrégation de protéines précurseurs et de molécules d'ARN associées sur la membrane plasmique de la cellule hôte, la formation de virions immatures et leur libération par bourgeonnement à la surface cellulaire. Lors du bourgeonnement, le virion s'entoure d'une membrane cellulaire dans laquelle sont intégrées les molécules gp41 et gp120. Pendant le bourgeonnement, ou éventuellement après la libération des virions, leur maturation se produit, réalisée à l'aide d'une protéase virale et consistant en la découpe protéolytique des protéines précurseurs Pr55Gag et Prl60Gag-Pol en protéines du virus mature et leur association en certains complexes structuraux. Le rôle principal dans les processus de morphogenèse virale est joué par la polyprotéine précurseur Pr55Gag, qui organise et assemble le virion immature; le processus de maturation est complété par une protéase virale spécifique.
Causes de l'immunodéficience
L'une des principales causes d'immunodéficience liée à l'infection par le VIH est la mort massive des lymphocytes T auxiliaires. Elle résulte des événements suivants: premièrement, les lymphocytes T auxiliaires infectés par le virus meurent par apoptose. On pense que chez les patients atteints du sida, la réplication virale, l'apoptose et la diminution du nombre de lymphocytes T auxiliaires sont interdépendantes. deuxièmement, les lymphocytes T tueurs reconnaissent et détruisent les lymphocytes T infectés par le virus ou porteurs de molécules gpl20 adsorbées, ainsi que les lymphocytes T auxiliaires infectés et non infectés par le virus, qui forment des symplastes (syncytium) composés de plusieurs dizaines de cellules (certaines meurent suite à la reproduction du virus). Suite à la destruction d'un grand nombre de lymphocytes T auxiliaires, l'expression des récepteurs membranaires de l'interleukine-2 dans les lymphocytes B diminue. La synthèse de diverses interleukines (facteurs de croissance et de différenciation des lymphocytes B – IL-4, IL-5, IL-6, etc.) est perturbée, ce qui entraîne une altération du fonctionnement du système T-killer. L'activité des systèmes du complément et des macrophages est supprimée. Les macrophages et les monocytes infectés par le virus ne meurent pas pendant longtemps, mais sont incapables d'éliminer le virus de l'organisme. Enfin, en raison de la similitude structurelle et antigénique de la gpl20 avec les récepteurs de certaines cellules épithéliales (notamment les récepteurs trophoblastiques médiateurs de la transmission du VIH par transplantation), des anticorps antirécepteurs à large spectre d'action sont synthétisés. Ces anticorps sont capables de bloquer divers récepteurs cellulaires et de compliquer l'évolution de la maladie par des maladies auto-immunes. L'infection par le VIH entraîne la destruction de tous les principaux maillons du système immunitaire. Ces patients deviennent vulnérables face à une grande variété de micro-organismes, ce qui favorise le développement d'infections opportunistes et de tumeurs. Chez les patients infectés par le VIH, le risque de développer au moins trois types de cancer est accru: le sarcome de Kaposi; le carcinome (y compris le cancer de la peau); et le lymphome à cellules B, dû à la transformation maligne des lymphocytes B. Cependant, le VIH est non seulement lymphocytotrope, mais aussi neurotrope. Il pénètre dans les cellules du système nerveux central (astrocytes) par endocytose médiée par des récepteurs et par phagocytose des lymphoblastes infectés par le virus par les astrocytes. Lorsque le virus interagit avec les astrocytes, des symplastes se forment, facilitant la propagation du pathogène par les canaux intercellulaires. Le virus peut persister longtemps dans les macrophages et les monocytes, qui servent alors de réservoir et de distributeur dans l'organisme, lui permettant de pénétrer tous les tissus. Les macrophages infectés jouent un rôle majeur dans l'introduction du VIH dans le système nerveux central et ses lésions. Chez 10 % des patients, des syndromes cliniques primaires sont associés à des lésions du système nerveux central et se manifestent par une démence. Ainsi, les personnes infectées par le VIH sont caractérisées par trois groupes de maladies: les infections opportunistes,maladies tumorales et lésions du système nerveux central.
Épidémiologie de l'infection par le VIH
La source de l'infection par le VIH est uniquement l'être humain: malade ou porteur du virus. Le virus de l'immunodéficience humaine (VIH) est présent dans le sang, le sperme et le liquide cervical; chez les mères qui allaitent, dans le lait maternel. L'infection se produit par voie sexuelle, par le sang et ses préparations, ainsi que de la mère à l'enfant avant, pendant et après l'accouchement. Aucun cas d'infection par le virus par l'alimentation, les boissons et les piqûres d'insectes n'est connu.
La toxicomanie contribue à la propagation du sida. L'incidence du VIH augmente chaque année. Selon l'OMS, entre 1980 et 2000, 58 millions de personnes ont été infectées par le VIH. Rien qu'en 2000, 5,3 millions de personnes ont été infectées dans le monde et 3 millions sont décédées du sida. Au 1er janvier 2004, 264 000 personnes infectées par le VIH étaient recensées en Russie. La moitié des personnes infectées par le VIH décèdent dans les 11 à 12 ans suivant l'infection. Début 2004, sur 100 000 citoyens russes, environ 180 vivaient avec un diagnostic d'infection par le VIH. On prévoit qu'avec ce niveau de morbidité, le nombre total de personnes infectées par le VIH en Russie atteindra 2,5 à 3 millions d'ici 2012. La complexité de la lutte contre l'infection par le VIH tient à plusieurs raisons: premièrement, il n'existe pas de méthodes efficaces de traitement et de prévention spécifique; Deuxièmement, la période d'incubation de l'infection par le VIH peut dépasser 10 ans. Sa durée dépend du moment de l'activation du lymphocyte T et de l'ADN provirus contenu dans son chromosome. On ignore encore si toute personne infectée par le virus est vouée au sida ou si un portage à long terme du virus sans maladie est possible (ce qui semble peu probable). Enfin, il existe plusieurs virus de l'immunodéficience humaine (VIH-1, VIH-2) dont les différences antigéniques empêchent la formation d'une immunité croisée. La découverte du virus de l'immunodéficience simienne (VIS) a permis de mieux comprendre l'origine du VIH. Le VIS est similaire au VIH par l'organisation de son génome, mais diffère significativement par sa séquence nucléotidique. Le VIH-2 occupe une position intermédiaire entre le VIH-1 et le VIS par ses propriétés sérologiques, et est plus proche du VIS par sa séquence nucléotidique. À cet égard, V. M. Zhdanov a suggéré que les virus VIH-1, VIH-2 et VIS provenaient d'un ancêtre commun. Il est possible, selon R. Gallo, qu'un des SIV soit entré d'une manière ou d'une autre dans le corps humain, où il a subi une série de mutations, entraînant l'émergence du VIH-1, du VIH-2 et de ses autres formes.
Symptômes de l'infection par le VIH
Le virus de l'immunodéficience humaine présente des caractéristiques qui déterminent en grande partie la pathogenèse de la maladie. Le virus présente un taux de reproduction très élevé, déterminé par ses éléments régulateurs (jusqu'à 5 000 virions sont synthétisés en 5 minutes au stade actif). Grâce à la présence de la protéine de fusion (gp41), le virus induit la formation de vastes structures syncytiales par la fusion des lymphocytes T auxiliaires infectés et non infectés, ce qui entraîne leur mort massive. Les molécules de protéine gpl20 formées en grande quantité circulent librement dans le sang et se lient aux récepteurs des lymphocytes T auxiliaires non infectés, ce qui leur permet d'être également reconnues et détruites par les lymphocytes T tueurs. Le virus peut se propager par les canaux intercellulaires d'une cellule à l'autre, auquel cas il devient difficilement accessible aux anticorps.
Critères cliniques de l'infection par le VIH
Chez l'adulte, l'infection par le VIH est diagnostiquée lorsqu'au moins deux symptômes graves sont associés à au moins un symptôme mineur, et en l'absence d'autres causes connues d'immunodéficience (cancer, déficit immunitaire congénital, inanition sévère, etc.). Les symptômes graves comprennent:
- perte de poids de 10 % ou plus;
- un état fébrile prolongé, intermittent ou constant;
- diarrhée chronique.
Symptômes mineurs: toux persistante, dermatite généralisée, zona récurrent, candidose buccale et pharyngée, herpès simplex chronique, adénopathie généralisée. Le diagnostic de SIDA est posé en présence uniquement d'un sarcome de Kaposi, d'une méningite cryptococcique ou d'une pneumonie à Pneumocystis. Le tableau clinique de la maladie est influencé par l'infection opportuniste associée.
Méthodes de culture du virus de l'immunodéficience humaine (VIH)
Le VIH-1 et le VIH-2 peuvent être cultivés dans les cellules d'un seul clone de lymphocytes TCV4 – H9, obtenu à partir de lymphocytes TCV4 leucémiques. Des cultures monocouches d'astrocytes, dans lesquelles le VIH-1 se reproduit bien, peuvent également être utilisées à ces fins. Les chimpanzés sont sensibles au VIH-1 parmi les animaux.
La résistance du virus dans l'environnement extérieur est faible. Il meurt sous l'effet du soleil et des rayons UV, et est détruit à 80 °C en 30 minutes. Lorsqu'il est traité avec des désinfectants courants, il l'est en 20 à 30 minutes. Pour désinfecter le matériel contenant le virus, il est nécessaire d'utiliser des désinfectants mycobactéricides, car ils sont efficaces contre les micro-organismes les plus résistants.
Diagnostic en laboratoire de l'infection par le VIH
La principale méthode de diagnostic du portage viral et de l'infection par le VIH est le dosage immunoenzymatique. Cependant, la gpl20 présentant une similarité structurelle et antigénique avec les récepteurs de certaines cellules humaines, notamment ceux qui transportent les immunoglobulines à travers les cellules épithéliales des muqueuses, des anticorps apparentés aux anticorps dirigés contre la gpl20 peuvent apparaître dans l'organisme. Dans ce cas, des résultats ELISA faussement positifs peuvent être obtenus. Par conséquent, tous les sérums positifs des sujets sont soumis à une analyse complémentaire par immunoblot, ou Western blot. Cette méthode repose sur l'identification des anticorps étudiés après leur séparation électrophorétique, puis sur des tests utilisant des anticorps anti-espèce marqués. La méthode virologique est rarement utilisée en raison de la complexité de la culture du virus. Le clone de lymphocytes H9 est utilisé pour obtenir des antigènes viraux, composants essentiels des systèmes de diagnostic. La méthode CPR permet de détecter le virus à un stade précoce de la virémie.
Traitement de l'infection par le VIH
Il est nécessaire de trouver ou de synthétiser des médicaments capables de supprimer efficacement l'activité de la transcriptase inverse (révertase) ou de la protéase virale. Ils empêcheraient la formation de provirus à ADN et (ou) inhiberaient la reproduction intracellulaire du virus. La stratégie moderne de traitement des patients infectés par le VIH repose sur l'utilisation combinée de médicaments inhibant la protéase virale (l'un des médicaments) et la réversase (deux médicaments différents) – une thérapie combinée (triple). En Russie, pour le traitement des patients infectés par le VIH, l'utilisation combinée de deux médicaments nationaux est recommandée: le phosphazide et le crixivan, qui inhibent spécifiquement la reproduction du VIH aux stades précoce et tardif de la reproduction, notamment en cas de réduction de l'activité de l'azidothymidine.
Le problème de la prophylaxie spécifique réside dans la nécessité de créer un vaccin garantissant la formation d'une immunité cellulaire efficace, basée sur des lymphocytes cytotoxiques spécifiques du virus, sans production significative d'anticorps. Cette immunité est assurée par les lymphocytes auxiliaires Thl. Il est possible que les anticorps, y compris ceux neutralisant le virus, soient non seulement inefficaces pour supprimer l'infection par le VIH, mais qu'à un niveau élevé, ils suppriment l'immunité cellulaire. Par conséquent, un vaccin anti-VIH doit avant tout répondre à deux exigences principales: a) être absolument sûr; b) stimuler l'activité des lymphocytes T cytotoxiques. L'efficacité de différentes variantes de vaccins obtenues à partir de virus inactivés et d'antigènes individuels aux propriétés protectrices élevées est à l'étude. Ces antigènes peuvent être isolés des virions eux-mêmes ou synthétisés chimiquement. Un vaccin créé par génie génétique a été proposé. Il s'agit d'un virus de la vaccine recombinant portant les gènes du VIH responsables de la synthèse d'antigènes aux fortes propriétés immunogènes. La question de l'efficacité de ces vaccins nécessite un temps considérable en raison de la longue période d'incubation de l'infection par le VIH et de la grande variabilité de l'agent pathogène. La création d'un vaccin hautement efficace contre le VIH constitue un problème fondamental et urgent.
