Expert médical de l'article
Nouvelles publications
Rôle des modifications de l'os sous-chondral dans la pathogenèse de l'arthrose
Dernière revue: 04.07.2025

Tout le contenu iLive fait l'objet d'un examen médical ou d'une vérification des faits pour assurer autant que possible l'exactitude factuelle.
Nous appliquons des directives strictes en matière d’approvisionnement et ne proposons que des liens vers des sites de médias réputés, des instituts de recherche universitaires et, dans la mesure du possible, des études évaluées par des pairs sur le plan médical. Notez que les nombres entre parenthèses ([1], [2], etc.) sont des liens cliquables vers ces études.
Si vous estimez qu'un contenu quelconque de notre contenu est inexact, obsolète ou discutable, veuillez le sélectionner et appuyer sur Ctrl + Entrée.
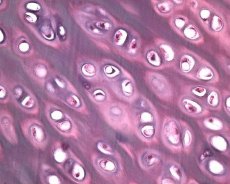
Outre la dégénérescence du cartilage articulaire, le tissu osseux sous-jacent est également impliqué dans le processus pathologique de l'arthrose. On suppose que l'épaississement de la plaque sous-chondrale contribue à la progression de l'arthrose. À mesure que l'arthrose progresse, le cartilage articulaire, soumis à des contraintes mécaniques et chimiques, s'érode lentement en raison d'un déséquilibre dans les processus de catabolisme et de réparation du cartilage. En particulier, les contraintes mécaniques liées au poids corporel des articulations contribuent à la formation d'un grand nombre de microfractures dans la plaque sous-chondrale et le cartilage. À mesure que le cartilage articulaire s'érode, la sclérose de l'os sous-chondral progresse, ce qui augmente la rigidité du tissu osseux, ce qui contribue à une nouvelle altération de la structure du cartilage articulaire. Cependant, la question de la nature primaire ou secondaire des modifications de l'os sous-chondral dans l'arthrose reste sans réponse.
Jusqu'à récemment, les modifications radiographiques de la substance spongieuse de l'os sous-chondral, telles que la sclérose ou la formation de kystes, étaient considérées comme secondaires chez les patients atteints d'arthrose. Cependant, les résultats d'études cliniques et expérimentales suggèrent un possible rôle initiateur de l'os sous-chondral dans la pathogenèse de l'arthrose. L'un des mécanismes possibles est une forte augmentation du gradient de rigidité de l'os sous-chondral, due au fait que l'intégrité du tissu cartilagineux sous-jacent dépend des propriétés mécaniques de son « lit osseux ». Des études chez les primates ont montré que les modifications de l'os sous-chondral peuvent précéder celles du cartilage articulaire. Les arguments pour et contre cette hypothèse, issus d'études sur des modèles animaux d'arthrose et d'études cliniques, n'ont fait qu'intensifier le débat. L'épaississement des travées de l'os sous-chondral ne s'accompagne pas toujours d'une augmentation de la minéralisation osseuse, ni plutôt d'une augmentation du volume ostéoïde. Ce signe de minéralisation anormale indique que la perturbation de la régulation du remodelage osseux fait partie intégrante de l'arthrose et étaye également l'hypothèse d'un défaut des cellules osseuses dans l'arthrose. L'équipe de J. Dequeker (1989) considère cette dernière comme une « maladie osseuse métabolique généralisée ».
Le tissu osseux se renouvelle constamment. Ce processus dynamique, appelé remodelage osseux, est une séquence complexe de résorption et de minéralisation. Les ostéoclastes résorbent le tissu osseux et les ostéoblastes sécrètent des protéines qui constituent le principal composant organique de la minéralisation. La formation et la résorption osseuses ne se produisent pas de manière aléatoire dans le squelette; il s'agit d'un processus programmé qui se déroule dans différentes zones du squelette, appelées unités de remodelage osseux. Au début du cycle, les ostéoclastes apparaissent sur la surface inactive; en deux semaines, ils forment un tunnel dans l'os cortical ou une lacune à la surface de l'os trabéculaire. La fréquence d'activation de nouvelles unités de remodelage osseux détermine le degré de renouvellement osseux. Chez un jeune sujet en bonne santé, les processus de formation et de résorption osseuses sont équilibrés et une masse osseuse normale est maintenue. La régulation hormonale de la résorption osseuse, au moins la PTH et la PGE2 , implique non seulement les ostéoclastes, mais aussi les ostéoblastes, car sous l'influence de ces hormones, des facteurs stimulant la résorption osseuse par les ostéoclastes sont libérés. Actuellement, on connaît plus de 12 régulateurs locaux et systémiques de la croissance du tissu osseux qui affectent son remodelage, en particulier la PTH, le 1,25(OH) 2D3 ,la calcitonine, l'hormone de croissance, les glucocorticoïdes, les hormones thyroïdiennes, l'insuline, l'IGF (1 et 2), les œstrogènes, la PGE2 , les androgènes.
Les cellules osseuses libèrent un certain nombre de protéines et de cytokines qui assurent la régulation endocrine et la transduction du signal. Les protéines produites par les ostéoblastes comprennent des protéines de la matrice osseuse telles que le collagène, l'ostéopontine, l'ostéocalcine et les sialoprotéines osseuses. De plus, ces cellules libèrent des protéases, sous forme active et latente, qui participent au remodelage du tissu osseux: les MMP, composants du système activateur du plasminogène (AP)/plasmine. Les cytokines libérées par les ostéoblastes peuvent agir à la fois par des mécanismes autocrines et paracrines sur les cellules locales (autres ostéoblastes, ostéoclastes).
On ignore encore si ces signaux sont régulés par le stress mécanique ou par d'autres signaux chimiques induits par le stress mécanique. Cependant, on sait qu'un stress mécanique répété provoque une prolifération locale de cellules et/ou de protéines osseuses. In vivo, la charge mécanique peut activer les ostéoblastes, augmenter le taux de nucléotides cycliques, la production de prostaglandines et provoquer des modifications morphologiques associées au remodelage osseux. In vitro, le stress mécanique provoque la prolifération des cultures d'ostéoblastes, l'expression de l'ARNm des protéines osseuses impliquées dans la formation et la minéralisation des ostéoïdes, la libération de facteurs de croissance locaux tels que l'IGF-1 et l'IGF-2, et de molécules d'adhésion. La transmission du signal de stress mécanique peut s'effectuer par l'intermédiaire de canaux ioniques mécanosensibles.
Il existe des preuves indirectes d'un dysfonctionnement des ostéoblastes dans l'arthrose. G. Gevers et J. Dequeker (1987) ont démontré une augmentation des taux d'ostéocalcine sérique chez des femmes atteintes d'arthrose de la main, ainsi que dans des explants d'os cortical, indiquant qu'une pathologie osseuse pourrait faire partie de l'arthrose. L'autopsie a révélé non seulement un épaississement de l'os sous-chondral, mais aussi une minéralisation anormalement faible de la tête fémorale. Chez des cobayes atteints d'arthrose induite chirurgicalement, la tomodensitométrie a révélé un épaississement significatif de la fraction osseuse dans la zone sous-chondrale. Un déséquilibre entre les protéines collagènes et non collagènes (ostéocalcine, etc.) peut entraîner une augmentation du volume osseux, mais n'affecte pas sa densité minérale. Selon M. Shimizu et al. (1993), la progression des modifications dégénératives du cartilage articulaire est associée à un remodelage plus intensif de l'os sous-chondral et à une augmentation de sa rigidité, ce qui indique également un défaut des cellules osseuses dans l'arthrose. Selon l'hypothèse proposée par B. Lee et M. Aspden (1997), la prolifération de cellules osseuses défectueuses peut entraîner une augmentation de la rigidité du tissu osseux, mais n'entraîne pas d'augmentation de sa densité minérale.
CI Westacott et al. (1997) ont émis l'hypothèse que les ostéoblastes anormaux affectent directement le métabolisme du cartilage. En cultivant des ostéoblastes de patients atteints d'arthrose avec des chondrocytes de personnes non atteintes de maladies articulaires, les auteurs ont observé une modification significative de la libération de glycosaminoglycanes par le tissu cartilagineux normal in vitro, mais le niveau de libération de cytokines est resté inchangé. G. Hilal et al. (1998) ont montré que la culture d'ostéoblastes d'os sous-chondral de patients atteints d'arthrose in vitro présente un métabolisme altéré: l'activité du système AP/plasmine et le niveau d'IGF-1 dans ces cellules sont augmentés. L'observation de CI Westacott et al. (1997) peut s'expliquer par une augmentation de l'activité des protéases dans les cellules osseuses sous-chondrales.
Français On ne sait toujours pas si les changements dans l'os sous-chondral initient l'arthrose ou contribuent à sa progression. DK Dedrick et al. (1993) ont démontré que chez les chiens atteints d'arthrose induite chirurgicalement, l'épaississement de l'os sous-chondral n'est pas une condition nécessaire au développement de changements de type ostéoarthrose dans le cartilage articulaire, mais contribue à la progression des processus dégénératifs dans le cartilage. Les résultats de l'étude d'A. Sa'ied et al. (1997) contredisent les données de l'étude précédente. En utilisant l'échographie de 50 MHz pour évaluer les changements morphologiques initiaux et leur progression dans le cartilage articulaire et l'os dans l'arthrose expérimentale induite par des injections d'acide monoiodoacétique dans l'articulation du grasset de rats, les auteurs ont démontré un processus simultané de changements dans l'os et le cartilage pendant les trois premiers jours après l'injection.
Les ostéoblastes sécrètent des facteurs de croissance et des cytokines impliqués dans le remodelage osseux local, susceptibles de favoriser le remodelage du cartilage dans les articulations portantes après leur pénétration à travers les microfissures de la couche calcifiée du cartilage articulaire. De plus, des produits de sécrétion des cellules osseuses sont présents dans le liquide synovial. Les produits les plus susceptibles d'initier le processus de remodelage local du cartilage sont le TGF-β et les protéines morphométriques osseuses (BMP). Ces deux membres de la famille des TGF sont sécrétés par les chondrocytes et les ostéoblastes, et tous deux sont capables de modifier le remodelage osseux et cartilagineux. J. Martel Pelletier et al. (1997) ont observé une augmentation du taux de TGF-β dans des explants osseux sous-chondraux de patients atteints d'arthrose par rapport à des individus sains, ce qui suggère un rôle probable de ce facteur de croissance dans la pathogenèse de l'arthrose. Les IGF sont également produits par les ostéoblastes. Dans une culture de cellules de type ostéoblaste obtenues à partir de patients atteints d'ostéoarthrose, une augmentation du taux d'IGF a été constatée, ce qui altère le métabolisme du cartilage.
Le TGF-β, l'IGF, la BMP et les cytokines produites par les ostéoblastes de l'os sous-chondral pourraient influencer la production de collagénase et d'autres enzymes protéolytiques du cartilage, ce qui pourrait à son tour favoriser le remodelage/la dégradation de la matrice cartilagineuse. On ignore encore si les ostéoblastes atteints d'arthrose produisent moins de facteur de stimulation des colonies de macrophages (M-CSF, un stimulateur de la résorption osseuse) que les cellules normales. Les résultats des études d'AG Uitterlinden et al. (1997) ont montré que les récepteurs de la vitamine D, exprimés par les ostéoblastes et régulant l'expression de plusieurs facteurs synthétisés par ces cellules, pourraient jouer un rôle dans la formation des ostéophytes, ce qui explique en partie le rôle des ostéoblastes dans la pathogenèse de cette maladie.
Français Prenant en compte les résultats des études ci-dessus, G. Hilal et al. (1998), J. Martel-Pelletier et al. (1997) ont proposé l'hypothèse de travail suivante concernant la relation entre le remodelage osseux sous-chondral et le cartilage articulaire approprié dans l'arthrose. À un stade précoce ou avancé de la pathogenèse de l'arthrose, le processus de remodelage du tissu osseux dans l'os sous-chondral s'intensifie. Dans le même temps, des charges répétées entraînent des microfractures locales et/ou l'apparition d'un déséquilibre dans le système IGF/protéine de liaison à l'IGF (IGFBP) en raison d'une réponse anormale des ostéoblastes de l'os sous-chondral, ce qui contribue à sa sclérose. Cette dernière peut à son tour contribuer à l'apparition de microfractures du cartilage approprié et à la lésion de sa matrice.
Dans des conditions normales, ces lésions sont réparées par la synthèse et la libération locales d'IGF-1 et de protéine de liaison à l'IGF, qui stimulent la formation de matrice extracellulaire (MEC) du cartilage articulaire. Parallèlement, le système GF favorise la croissance des cellules osseuses sous-chondrales et la formation de la matrice osseuse. L'activité anabolique du système IGF est accrue dans l'os sous-chondral des patients atteints d'arthrose, tandis que l'activation locale du système PA/plasmine (un régulateur local du système IGF) dans le cartilage articulaire provoque ses modifications locales. Chez les ostéoblastes atteints d'arthrose, l'IGF-1 perturbe la régulation de l'AP par la plasmine par rétroaction positive, ce qui peut freiner le remodelage osseux, ce qui conduit à terme à une sclérose sous-chondrale. Ainsi, dans les tissus osseux et cartilagineux, l'induction locale d'IGF-1 et de protéases entraîne, d'une part, des lésions cartilagineuses et, d'autre part, un épaississement de l'os sous-chondral, ce dernier contribuant à son tour à aggraver les lésions cartilagineuses. Le déséquilibre entre les lésions cartilagineuses associées à la sclérose sous-chondrale et ses capacités réparatrices entraîne des modifications progressives de la matrice extracellulaire du cartilage et le développement de l'arthrose. Selon les auteurs, cette hypothèse explique également la lente progression de la maladie.

