Expert médical de l'article
Nouvelles publications
Glandes parathyroïdes
Dernière revue: 04.07.2025

Tout le contenu iLive fait l'objet d'un examen médical ou d'une vérification des faits pour assurer autant que possible l'exactitude factuelle.
Nous appliquons des directives strictes en matière d’approvisionnement et ne proposons que des liens vers des sites de médias réputés, des instituts de recherche universitaires et, dans la mesure du possible, des études évaluées par des pairs sur le plan médical. Notez que les nombres entre parenthèses ([1], [2], etc.) sont des liens cliquables vers ces études.
Si vous estimez qu'un contenu quelconque de notre contenu est inexact, obsolète ou discutable, veuillez le sélectionner et appuyer sur Ctrl + Entrée.
En 1879, le scientifique suédois S. Sandström a décrit les glandes parathyroïdes chez l'homme et leur a donné un nom. Les glandes parathyroïdes sont des organes vitaux. Leur fonction est de produire et de sécréter l'hormone parathyroïdienne (PTH), l'un des principaux régulateurs du métabolisme du calcium et du phosphore.
Les glandes parathyroïdes supérieures (glandula parathyroidea superior) et inférieures (glandula parathyroidea inferior) sont des organes ronds ou ovoïdes situés à la face postérieure de chaque lobe de la thyroïde: une glande en haut, l'autre en bas. Chaque glande mesure 4 à 8 mm de long, 3 à 4 mm de large et 2 à 3 mm d'épaisseur. Leur nombre varie de 2 à 7-8; en moyenne, elles sont au nombre de quatre. Leur masse totale est en moyenne de 1,18 g.
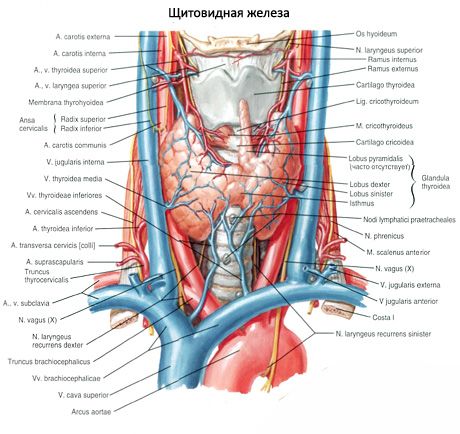
Les glandes parathyroïdes se distinguent de la thyroïde par leur couleur plus claire (rose pâle chez l'enfant, brun jaunâtre chez l'adulte). Elles sont souvent situées au point de pénétration des artères thyroïdiennes inférieures ou de leurs branches dans le tissu thyroïdien. Elles sont séparées des tissus environnants par leur propre capsule fibreuse, d'où partent des couches de tissu conjonctif. Celles-ci contiennent un grand nombre de vaisseaux sanguins et divisent les glandes parathyroïdes en groupes de cellules épithéliales.
Le parenchyme des glandes est constitué de parathyrocytes principaux et acidophiles, qui forment des cordons et des amas entourés de fins faisceaux de fibres de tissu conjonctif. Ces deux types de cellules sont considérés comme correspondant à des stades différents du développement des parathyrocytes. Les parathyrocytes principaux ont une forme polyédrique, un cytoplasme basophile et un grand nombre de ribosomes. Parmi ces cellules, on distingue les cellules sombres (à sécrétion active) et les cellules claires (à sécrétion moins active). Les parathyrocytes acidophiles sont de grande taille, aux contours nets, et contiennent de nombreuses petites mitochondries contenant des particules de glycogène.
L'hormone parathyroïdienne, la parathyroxine (parathyroïde), est une protéine de composition qui intervient dans la régulation du métabolisme phosphore-calcium. Elle réduit l'excrétion urinaire du calcium et augmente son absorption intestinale en présence de vitamine D. La thyrocalcitonine est un antagoniste de la parathyroïde.
Embryogenèse des glandes parathyroïdes
Les glandes parathyroïdes se développent à partir de l'épithélium des poches branchiales paires III et IV. Au cours de la 7e semaine de développement, les rudiments épithéliaux des corps se détachent des parois des poches branchiales et, au cours de la croissance, se déplacent vers la queue. Par la suite, les glandes parathyroïdes en formation occupent une position permanente sur les faces postérieures des lobes droit et gauche de la thyroïde.
 [ 7 ], [ 8 ], [ 9 ], [ 10 ], [ 11 ], [ 12 ]
[ 7 ], [ 8 ], [ 9 ], [ 10 ], [ 11 ], [ 12 ]
Vaisseaux et nerfs des glandes parathyroïdes
L'apport sanguin aux glandes parathyroïdes est assuré par les branches des artères thyroïdiennes supérieures et inférieures, ainsi que par les branches œsophagiennes et trachéales. Le sang veineux s'écoule par les veines du même nom. L'innervation des glandes parathyroïdes est similaire à celle de la glande thyroïde.
Caractéristiques des glandes parathyroïdes liées à l'âge
La masse totale des glandes parathyroïdes chez un nouveau-né varie entre 6 et 9 mg. Durant la première année de vie, leur masse totale est multipliée par 3 à 4, puis par 2 à 5 ans, puis par 3 à 10 ans. Après 20 ans, la masse totale des quatre glandes parathyroïdes atteint 120-140 mg et reste constante jusqu'à un âge avancé. À tout âge, la masse des glandes parathyroïdes est légèrement supérieure chez la femme à celle de l'homme.
Habituellement, une personne possède deux paires de glandes parathyroïdes (supérieures et inférieures), situées sur la face postérieure de la thyroïde, à l'extérieur de sa capsule, près des pôles supérieur et inférieur. Cependant, leur nombre et leur localisation peuvent varier; on en trouve parfois jusqu'à 12. Elles peuvent être situées dans les tissus de la thyroïde et du thymus, dans le médiastin antérieur et postérieur, dans le péricarde, derrière l'œsophage, au niveau de la bifurcation de l'artère carotide. Les glandes parathyroïdes supérieures ont une forme ovoïde aplatie, les inférieures sont sphériques. Leurs dimensions varient de 6 x 3 à 4 x 1,5 - 3 mm environ, leur poids total est de 0,05 à 0,5 g et leur couleur est rougeâtre ou brun jaunâtre. L'apport sanguin aux glandes parathyroïdes est assuré principalement par les branches de l'artère thyroïdienne inférieure; le flux veineux se fait par les veines de la glande thyroïde, de l'œsophage et de la trachée. Les glandes parathyroïdes sont innervées par les fibres sympathiques des nerfs laryngés récurrents et supérieurs, tandis que l'innervation parasympathique est assurée par les nerfs vagues. Les glandes parathyroïdes sont recouvertes d'une fine capsule de tissu conjonctif; les septa qui en partent pénètrent dans les glandes. Elles contiennent des vaisseaux sanguins et des fibres nerveuses. Le parenchyme des glandes parathyroïdes est constitué de parathyrocytes, ou cellules principales, parmi lesquels, selon leur degré de coloration, on distingue les cellules claires ou brillantes, actives hormonalement, ainsi que les cellules sombres, au repos. Les cellules principales forment des amas, des cordons et des amas, et chez les personnes âgées, des follicules contenant des colloïdes dans leur cavité. Chez l'adulte, des cellules éosinophiles ou oxyphiles, localisées principalement à la périphérie des glandes parathyroïdes, apparaissent, colorées à l'éosine. Il s'agit de cellules principales en cours de dégénérescence. Dans les glandes parathyroïdes, on peut également observer des formes transitionnelles entre les cellules principales et les cellules oxyphiles.
Les premiers progrès dans la clarification des questions de synthèse, le décodage de la structure et l'étude du métabolisme de l'hormone parathyroïdienne ont été obtenus après 1972. L'hormone parathyroïdienne est un polypeptide monocaténaire composé de 84 résidus d'acides aminés, dépourvu de cystéine, d'un poids moléculaire d'environ 9 500 daltons, formé dans les glandes parathyroïdes à partir d'un bioprécurseur, l'hormone proparathyroïdienne (proPTH), qui possède 6 acides aminés supplémentaires à l'extrémité NH₂ . La ProPTH est synthétisée dans les cellules principales des glandes parathyroïdes (dans leur réticulum endoplasmique granulaire) et, lors du clivage protéolytique dans l'appareil de Golgi, elle est convertie en hormone parathyroïdienne. Son activité biologique est nettement inférieure à celle de la PTH. Apparemment, la proPTH est absente du sang des personnes en bonne santé, mais dans des conditions pathologiques (avec adénome des glandes parathyroïdes), elle peut être sécrétée dans le sang avec la PTH. Récemment, un précurseur de la proPTH, la préproPTH, a été découvert. Il contient 25 résidus d'acides aminés supplémentaires à l'extrémité NH₂. Ainsi, la préproPTH contient 115 résidus d'acides aminés, soit 90 pour la proPTH et 84 pour la PTH.
La structure de l'hormone parathyroïdienne bovine et porcine est désormais parfaitement établie. L'hormone parathyroïdienne humaine a été isolée à partir d'adénomes parathyroïdiens, mais sa structure n'a été que partiellement déchiffrée. Il existe des différences structurelles entre l'hormone parathyroïdienne animale et humaine, mais elles présentent une immunoréactivité croisée. Le polypeptide, constitué des 34 premiers résidus d'acides aminés, conserve pratiquement l'activité biologique de l'hormone naturelle. Cela permet de supposer que les près de % restants de la molécule, à l'extrémité carboxyle, ne sont pas directement liés aux principaux effets de l'hormone parathyroïdienne. Les fragments 1 à 29 de l'hormone parathyroïdienne présentent également une certaine activité biologique et immunologique. Les fragments 53 à 84, biologiquement inactifs, présentent également un effet immunologique, c'est-à-dire que ces propriétés de l'hormone parathyroïdienne sont présentes dans au moins deux sections de sa molécule.
L'hormone parathyroïdienne circulant dans le sang est hétérogène et diffère de l'hormone native sécrétée par les glandes parathyroïdes. On distingue au moins trois types d'hormone parathyroïdienne dans le sang: l'hormone parathyroïdienne intacte, d'un poids moléculaire de 9 500 daltons; les substances biologiquement inactives issues de la partie carboxyle de la molécule d'hormone parathyroïdienne, d'un poids moléculaire de 7 000 à 7 500 daltons; et les substances biologiquement actives, d'un poids moléculaire d'environ 4 000 daltons.
Des fragments encore plus petits ont été trouvés dans le sang veineux, indiquant qu'ils se formaient en périphérie. Les principaux organes où se formaient les fragments de parathormone étaient le foie et les reins. La fragmentation de parathormone dans ces organes était accrue en cas de pathologie hépatique et d'insuffisance rénale chronique (IRC). Dans ces conditions, les fragments de parathormone restaient dans la circulation sanguine significativement plus longtemps que chez les individus sains. Le foie absorbait principalement la parathormone intacte, mais n'éliminait ni les fragments carboxy-terminaux ni les fragments amino-terminaux de parathormone du sang. Les reins jouaient un rôle majeur dans le métabolisme de la parathormone. Ils représentaient près de 60 % de la clairance métabolique de l'hormone immunoréactive carboxy-terminale et 45 % du fragment amino-terminal de parathormone. La principale zone de métabolisme du fragment amino-terminal actif de parathormone était les os.
Une sécrétion pulsatile d'hormone parathyroïdienne a été détectée, plus intense la nuit. Trois à quatre heures après le début du sommeil, sa concentration sanguine est 2,5 à 3 fois supérieure à la moyenne diurne.
La fonction principale de l'hormone parathyroïdienne est de maintenir l'homéostasie calcique. Parallèlement, le calcium sérique (total et surtout ionisé) est le principal régulateur de la sécrétion d'hormone parathyroïdienne (une diminution du taux de calcium stimule la sécrétion d'hormone parathyroïdienne, tandis qu'une augmentation la supprime), c'est-à-dire que la régulation s'effectue selon le principe de rétroaction. En cas d'hypocalcémie, la conversion de la proPTH en hormone parathyroïdienne augmente. Le magnésium sanguin joue également un rôle important dans la libération d'hormone parathyroïdienne (une concentration élevée stimule la sécrétion d'hormone parathyroïdienne, tandis qu'une concentration basse la supprime). Les principales cibles de l'hormone parathyroïdienne sont les reins et les os, mais son effet sur l'absorption intestinale du calcium, la tolérance aux glucides, les taux de lipides sériques, son rôle dans le développement de l'impuissance, les démangeaisons cutanées, etc. est connu.
Pour caractériser l'effet de l'hormone parathyroïdienne sur les os, il est nécessaire de fournir de brèves informations sur la structure du tissu osseux, les caractéristiques de sa résorption et de son remodelage physiologiques.
On sait que la majeure partie du calcium présent dans l'organisme (jusqu'à 99 %) se trouve dans le tissu osseux. Puisqu'il est présent dans les os sous forme de composés phosphorés-calciques, 100 % de la teneur totale en phosphore se trouve également dans les os. Malgré leur nature apparemment statique, ces tissus sont constamment remodelés, activement vascularisés et possèdent d'excellentes propriétés mécaniques. L'os est un « dépôt » dynamique de phosphore, de magnésium et d'autres composés nécessaires au maintien de l'homéostasie du métabolisme minéral. Sa structure comprend des composants minéraux denses, étroitement liés à la matrice organique, composée de 90 à 95 % de collagène, de faibles quantités de mucopolysaccharides et de protéines non collagéniques. La partie minérale de l'os est constituée d'hydroxyapatite (sa formule brute est Ca10(PO4)6(OH)2) et de phosphate de calcium amorphe.
L'os est formé par les ostéoblastes, issus de cellules mésenchymateuses indifférenciées. Ce sont des cellules mononucléées impliquées dans la synthèse des composants de la matrice osseuse organique. Elles forment une monocouche à la surface osseuse et sont en contact étroit avec l'ostéoïde. Les ostéoblastes sont responsables du dépôt d'ostéoïde et de sa minéralisation ultérieure. Leur activité vitale produit la phosphatase alcaline, dont la concentration sanguine est un indicateur indirect de leur activité. Entourés d'ostéoïde minéralisé, certains ostéoblastes se transforment en ostéocytes, des cellules mononucléées dont le cytoplasme forme des canaux associés à ceux des ostéocytes voisins. Ils ne participent pas au remodelage osseux, mais sont impliqués dans le processus de destruction périlacunaire, essentiel à la régulation rapide de la calcémie. La résorption osseuse est assurée par les ostéoclastes, des cellules polynucléaires géantes, apparemment issues de la fusion de macrophages mononucléaires. On suppose également que les précurseurs des ostéoclastes pourraient être des cellules souches hématopoïétiques de la moelle osseuse. Mobiles, elles forment une couche en contact avec l'os, localisée dans les zones de résorption osseuse la plus importante. Grâce à la libération d'enzymes protéolytiques et de phosphatase acide, les ostéoclastes provoquent la dégradation du collagène, la destruction de l'hydroxyapatite et l'élimination des minéraux de la matrice. Le tissu osseux néoformé et faiblement minéralisé (ostéoïde) résiste à la résorption ostéoclastique. Les fonctions des ostéoblastes et des ostéoclastes sont indépendantes, mais coordonnées, ce qui conduit au remodelage normal du squelette. La croissance osseuse en longueur dépend de l'ossification endochondrale, tandis que la croissance en largeur et en épaisseur dépend de l'ossification périostée. Des études cliniques avec le 47 Ca ont montré que jusqu'à 18 % du calcium total du squelette se renouvelle chaque année. En cas de lésions osseuses (fractures, infections), l'os altéré se résorbe et de l'os nouveau se forme.
Les complexes cellulaires impliqués dans le processus local de résorption et de formation osseuses sont appelés unités de remodelage multicellulaire de base (UMB). Ils régulent la concentration locale de calcium, de phosphore et d'autres ions, la synthèse des composants organiques de l'os, en particulier le collagène, son organisation et sa minéralisation.
L'effet principal de l'hormone parathyroïdienne sur les os du squelette est d'améliorer les processus de résorption, affectant à la fois les composants minéraux et organiques de la structure osseuse. L'hormone parathyroïdienne favorise la croissance et l'activité des ostéoclastes, ce qui s'accompagne d'un effet ostéolytique accru et d'une augmentation de la résorption osseuse. Dans ce cas, les cristaux d'hydroxyapatite se dissolvent et libèrent du calcium et du phosphore dans le sang. Ce processus est le principal mécanisme d'augmentation du taux de calcium sanguin. Il comprend trois composantes: la mobilisation du calcium de l'os périlacunaire (ostéocytes profonds); la prolifération des cellules ostéoprogénératrices en ostéoclastes; et le maintien d'un taux constant de calcium dans le sang en régulant sa libération par l'os (ostéocytes superficiels).
Ainsi, l'hormone parathyroïdienne augmente initialement l'activité des ostéocytes et des ostéoclastes, favorisant l'ostéolyse, entraînant une augmentation du taux de calcium dans le sang et une augmentation de l'excrétion urinaire de calcium et d'oxyproline. Il s'agit du premier effet qualitatif et rapide de l'hormone parathyroïdienne. Son deuxième effet sur les os est quantitatif. Il est associé à une augmentation du pool d'ostéoclastes. L'ostéolyse active stimule la prolifération des ostéoblastes, activant à la fois la résorption et la formation osseuse, avec une prédominance de résorption. Un excès d'hormone parathyroïdienne entraîne un bilan osseux négatif. Ceci s'accompagne d'une excrétion excessive d'oxyproline, un produit de la dégradation du collagène, et d'acides sialiques entrant dans la structure des mucopolysaccharides. L'hormone parathyroïdienne active l'adénosine monophosphate cyclique (AMPc). L'augmentation de l'excrétion urinaire d'AMPc après administration d'hormone parathyroïdienne peut servir d'indicateur de la sensibilité des tissus à cette substance.
L'effet le plus important de l'hormone parathyroïdienne sur les reins est sa capacité à réduire la réabsorption du phosphore, augmentant ainsi la phosphaturie. Le mécanisme de réduction varie selon les parties du néphron: dans la partie proximale, cet effet de l'hormone parathyroïdienne est dû à une perméabilité accrue et se produit avec la participation de l'AMPc, tandis que dans la partie distale, il ne dépend pas de l'AMPc. L'effet phosphaturique de l'hormone parathyroïdienne varie en cas de carence en vitamine D, d'acidose métabolique et de diminution de la teneur en phosphore. Les hormones parathyroïdiennes augmentent légèrement la réabsorption tubulaire totale du calcium. Parallèlement, elles la diminuent dans les parties proximales et l'augmentent dans les parties distales. Ce dernier point est d'importance majeure: l'hormone parathyroïdienne diminue la clairance du calcium. L'hormone parathyroïdienne diminue la réabsorption tubulaire du sodium et de ses bicarbonates, ce qui pourrait expliquer le développement de l'acidose dans l'hyperparathyroïdie. Il augmente la formation de 1,25-dioxycholécalciférol 1,25(OH2 ) D3 dans les reins – la forme active de la vitamine D3 . Ce composé augmente la réabsorption du calcium dans l'intestin grêle en stimulant l'activité d'une protéine spécifique de liaison au calcium (CaBP) dans sa paroi.
Le taux normal d'hormone parathyroïdienne est en moyenne de 0,15 à 0,6 ng/ml. Il varie selon l'âge et le sexe. La teneur moyenne en hormone parathyroïdienne dans le sang des personnes âgées de 20 à 29 ans est de (0,245 ± 0,017) ng/ml, celle des personnes âgées de 80 à 89 ans de (0,545 ± 0,048) ng/ml; celle des femmes de 70 ans est de (0,728 ± 0,051) ng/ml, et celle des hommes du même âge de (0,466 ± 0,40) ng/ml. Ainsi, la teneur en hormone parathyroïdienne augmente avec l'âge, mais de manière plus marquée chez les femmes.
En règle générale, plusieurs tests différents doivent être utilisés pour le diagnostic différentiel de l’hypercalcémie.
Nous présentons la classification clinique et pathogénique que nous avons développée, basée sur la classification d'OV Nikolaev et VN Tarkaeva (1974).
Classification clinique et pathogénique des maladies associées à une altération de la sécrétion de l'hormone parathyroïdienne et à une sensibilité à celle-ci
Hyperparathyroïdie primaire
- Par pathogénèse:
- adénome(s) hyperfonctionnel(s);
- hyperplasie de l'OGD;
- carcinome parathyroïdien hyperfonctionnel;
- néoplasie endocrinienne multiple de type I avec hyperparathyroïdie (syndrome de Wermer);
- néoplasie endocrinienne multiple de type II avec hyperparathyroïdie (syndrome de Sipple).
- Selon les caractéristiques cliniques:
- forme osseuse:
- ostéoporotique,
- ostéite fibrokystique,
- "Pagetoïde";
- forme viscéropathique:
- avec des lésions prédominantes des reins, du tractus gastro-intestinal, de la sphère neuropsychiatrique;
- forme mixte.
- forme osseuse:
- En aval:
- épicé;
- chronique.
Hyperparathyroïdie secondaire (hyperfonctionnement secondaire et hyperplasie des glandes parathyroïdes avec hypocalcémie et hyperphosphatémie prolongées)
- Pathologie rénale:
- insuffisance rénale chronique;
- tubulopathie (type Albright-Fanconi);
- rachitisme rénal.
- Pathologie intestinale:
- syndrome de malabsorption.
- Pathologie osseuse:
- ostéomalacie sénile;
- puerpéral;
- idiopathique;
- La maladie de Paget.
- Carence en vitamine D:
- maladie du rein;
- foie;
- déficits enzymatiques héréditaires.
- Maladies malignes: myélome.
Hyperparathyroïdie tertiaire
- Adénome(s) des glandes parathyroïdes à fonctionnement autonome, se développant dans le contexte d'une hyperparathyroïdie secondaire de longue date.
Pseudohyperparathyroïdie
- Production d'hormone parathyroïdienne par des tumeurs d'origine non parathyroïdienne.
Formations kystiques et tumorales des glandes parathyroïdes, inactives sur le plan hormonal
- Kyste.
- Tumeurs ou carcinomes hormonalement inactifs.
Hypoparathyroïdie
- Sous-développement congénital ou absence des glandes parathyroïdes.
- Origine idiopathique, auto-immune.
- Postopératoire, développé en relation avec l'ablation des glandes parathyroïdes.
- Postopératoire en raison d'une altération de l'apport sanguin et de l'innervation.
- Dommages causés par les radiations, exogènes et endogènes (radiothérapie externe, traitement des maladies de la thyroïde par l'iode radioactif).
- Lésion des glandes parathyroïdes due à une hémorragie ou à un infarctus.
- Lésions infectieuses.
Pseudohypoparathyroïdie
- Type I - insensibilité des organes cibles à l'hormone parathyroïdienne, dépendante de l'adénylate cyclase;
- Type II - insensibilité des organes cibles à l'hormone parathyroïdienne, indépendante de l'adénylate cyclase, possiblement d'origine auto-immune.
Pseudopseudohypoparathyroïdie
Présence de signes somatiques de pseudohypoparathyroïdie chez des parents sains dans les familles de patients atteints de pseudohypoparathyroïdie sans troubles biochimiques caractéristiques et sans tétanie.
 [ 13 ], [ 14 ], [ 15 ], [ 16 ], [ 17 ], [ 18 ], [ 19 ], [ 20 ], [ 21 ]
[ 13 ], [ 14 ], [ 15 ], [ 16 ], [ 17 ], [ 18 ], [ 19 ], [ 20 ], [ 21 ]

