Expert médical de l'article
Nouvelles publications
Médicaments
Neuroleptiques ou antipsychotiques
Dernière revue: 04.07.2025

Tout le contenu iLive fait l'objet d'un examen médical ou d'une vérification des faits pour assurer autant que possible l'exactitude factuelle.
Nous appliquons des directives strictes en matière d’approvisionnement et ne proposons que des liens vers des sites de médias réputés, des instituts de recherche universitaires et, dans la mesure du possible, des études évaluées par des pairs sur le plan médical. Notez que les nombres entre parenthèses ([1], [2], etc.) sont des liens cliquables vers ces études.
Si vous estimez qu'un contenu quelconque de notre contenu est inexact, obsolète ou discutable, veuillez le sélectionner et appuyer sur Ctrl + Entrée.
Les antipsychotiques (neuroleptiques) sont une classe de médicaments psychotropes principalement utilisés pour traiter la schizophrénie. On distingue actuellement deux groupes (ou catégories) de médicaments: les antipsychotiques typiques et les antipsychotiques atypiques. Vous trouverez ci-dessous des informations sur les propriétés pharmacologiques, les indications d'utilisation et les effets secondaires de chacun de ces groupes.
Indications d'utilisation des antipsychotiques typiques
Actuellement, les principales indications pour la prescription de neuroleptiques traditionnels, selon les recommandations fournies par des chercheurs faisant autorité dans le domaine de la psychopharmacothérapie, sont les suivantes.
- Soulagement de l'agitation psychomotrice et des troubles du comportement causés par des symptômes psychotiques sévères. Dans ces cas, l'utilisation de médicaments antipsychotiques oraux ou parentéraux est indiquée, qu'ils soient globaux (clopromazine, lévomépromazine, thiopropérazine, zuclopenthixol) ou sélectifs (effet sur les troubles hallucinatoires et paranoïaques) (halopéridol, trifluopérazine).
- Traitement préventif (anti-rechute). À cette fin, des médicaments à action retard sont prescrits, notamment chez les patients présentant une mauvaise observance thérapeutique (décanoate d'halopéridol, flupentixol à dose prolongée), ou des médicaments à faible ou moyenne dose pour obtenir un effet désinhibiteur (antinégatif), parmi ceux utilisés à fortes doses pour soulager les troubles psychotiques aigus (flupentixol, zuclopentixol). Dans ce type de traitement, il est également recommandé de prescrire des neuroleptiques dits « à faible dose » (thioridazine, chlorprothixène, sulpiride), dont l'activité psychotrope consiste en un effet sur les manifestations du pôle dépressif et les troubles insomniaques.
- Surmonter la résistance thérapeutique aux antipsychotiques atypiques dans le traitement des états psychotiques aigus. À cette fin, on utilise généralement des formes parentérales d'antipsychotiques traditionnels à action antipsychotique globale (chlorpromazine, lévomépromazine, etc.) et sélective (halopéridol).
Ces médicaments provoquent divers effets secondaires, dont la nature dépend du profil pharmacologique de chaque médicament. Les antipsychotiques à effet cholinolytique plus prononcé provoquent plus souvent des troubles de l'accommodation, de la constipation, une sécheresse buccale et une rétention urinaire. Un effet sédatif est plus fréquent chez les antipsychotiques à effet antihistaminique prononcé, et une hypotension orthostatique est plus fréquente chez les médicaments bloquant les récepteurs α1-adrénergiques. Le blocage des transmissions cholinergique, nordrénergique et dopaminergique par les neuroleptiques classiques peut entraîner divers troubles de la sphère sexuelle, tels qu'aménorrhée ou dysménorrhée, anorgasmie, galactorrhée, gonflement et douleur des glandes mammaires, et diminution de la puissance. Les effets secondaires sur la sphère sexuelle sont principalement associés aux propriétés cholinolytiques et adrénobloquantes de ces médicaments, ainsi qu'à une augmentation de la sécrétion de prolactine due au blocage du métabolisme de la dopamine. Les effets secondaires les plus graves des neuroleptiques classiques sont les troubles moteurs. Ils constituent la raison la plus fréquente d'arrêt du traitement. Les trois principaux effets secondaires du traitement associés à l'influence sur la sphère motrice sont les syndromes extrapyramidaux précoces, les dyskinésies tardives et le syndrome neuromusculaire.
Les syndromes extrapyramidaux seraient associés au blocage des récepteurs D2 dans les noyaux gris centraux. Ils comprennent la dystonie, le syndrome parkinsonien neuroleptique et l'akathisie. Les manifestations d'une réaction dystonique aiguë (dyskinésie précoce) incluent une hyperkinésie d'apparition soudaine, des crises oculogyres, des contractions des muscles du visage et du tronc, et un opisthotonus. Ces troubles sont dose-dépendants et surviennent souvent après 2 à 5 jours de traitement par des neuroleptiques très puissants tels que l'halopéridol et la fluphénazine. Pour soulager la dyskinésie précoce, la dose de neuroleptique est réduite et des anticholinergiques (bipéridène, trihexyphénidyle) sont prescrits. La dyskinésie tardive touche généralement les muscles du cou et, contrairement à la réaction dystonique aiguë, répond moins bien au traitement par anticholinergiques. Le syndrome parkinsonien neuroleptique se caractérise par une diminution de la motricité spontanée, une hypo- et une amimie, des tremblements de repos et une rigidité. Il est important de distinguer ces symptômes des troubles négatifs apparentés de la schizophrénie, caractérisés par une aliénation émotionnelle, un affaiblissement des affects et une anergie. Pour corriger ces effets secondaires, l'utilisation d'anticholinergiques, une réduction de la dose du neuroleptique ou son remplacement par un antipsychotique atypique sont indiqués. L'akathisie se manifeste par une anxiété interne, l'incapacité à rester longtemps au même endroit et le besoin de bouger constamment les bras ou les jambes. Pour la soulager, on utilise des anticholinergiques et des bêtabloquants centraux (propranolol).
La dyskinésie tardive se manifeste par des mouvements involontaires de n'importe quel groupe musculaire, le plus souvent des muscles de la langue et de la bouche. Cliniquement, on distingue plusieurs formes: dyskinésie des muscles des joues, de la langue et de la bouche (contractions périodiques des muscles masticateurs, donnant l'impression d'une personne grimaçante, la langue pouvant sortir involontairement de la bouche); dystonie tardive et akathisie tardive (le patient effectue des mouvements choréo-athétosiques de la tête, du tronc, des membres supérieurs et inférieurs). Cette forme de trouble est principalement observée lors d'un traitement au long cours par neuroleptiques traditionnels et est détectée chez environ 15 à 20 % des patients les prenant en traitement d'entretien. Le risque de développer des symptômes de dyskinésie est probablement accru chez certains patients, certains d'entre eux ayant été observés dans la clinique de la schizophrénie avant même l'ère des neuroleptiques. De plus, des dyskinésies tardives ont été décrites chez des femmes âgées et des patients souffrant de troubles affectifs. On pense que la dyskinésie tardive est associée à une augmentation du nombre de récepteurs de la dopamine dans le striatum, bien que les systèmes GABAergiques et d'autres neurotransmetteurs soient également susceptibles d'être impliqués dans sa pathogenèse. Il n'existe pas de traitement universel efficace contre ces effets secondaires. Il est suggéré que de faibles doses de neuroleptiques puissants à action bloquant la dopamine ou de vitamine E pourraient avoir un effet bénéfique modéré sur ces troubles. La mesure la plus efficace contre la dyskinésie tardive est la réduction de la dose d'un neuroleptique typique ou son remplacement par un antipsychotique atypique.
Selon les données actuelles, le syndrome malin des neuroleptiques survient dans environ 0,5 % des cas de psychopharmacothérapie. La rareté de cette complication potentiellement mortelle s'explique probablement par l'introduction généralisée des antipsychotiques atypiques, le risque de développer un SMN sous traitement par ces médicaments étant négligeable. Il est généralement admis que la principale cause du développement du SMN est un blocage excessif du système dopaminergique lors d'un traitement par neuroleptiques, notamment après une augmentation de la dose d'un antipsychotique très puissant. Les principaux symptômes du SMN sont l'hyperthermie, une augmentation du tonus musculaire et des réflexes tendineux, ainsi qu'une altération de la conscience avec transition vers le coma. Les analyses sanguines révèlent une leucocytose, une augmentation de la vitesse de sédimentation et de l'activité des transaminases hépatiques; les analyses d'urine révèlent une albuminurie. Des troubles de l'équilibre hydro-électrolytique surviennent rapidement, créant les conditions préalables à la formation d'un œdème cérébral. Le SMN est une affection aiguë nécessitant une hospitalisation urgente pour perfusion intensive. Dans le traitement du SMN, l'hydratation et le traitement symptomatique sont essentiels. Dans ce cas, tout neuroleptique prescrit doit être arrêté immédiatement. Dans certains cas, les agonistes des récepteurs de la dopamine (par exemple, la bromocriptine) ou les myorelaxants ont un effet positif, bien que leur efficacité n'ait pas été étudiée. Après la guérison du SMN, le neuroleptique ne doit pas être repris avant au moins deux semaines. Par la suite, un antipsychotique de faible puissance peut être prescrit, de préférence un médicament de nouvelle génération. La dose du nouveau médicament prescrit doit être augmentée avec une extrême prudence, en surveillant l'état des fonctions vitales et les analyses de sang et d'urine.
Les neuroleptiques classiques entraînent rarement des complications mortelles dangereuses. Les manifestations de surdosage sont principalement liées au profil individuel d'action antiadrénergique et anticholinergique du médicament. Ces médicaments ayant un puissant effet antiémétique, un lavage gastrique est indiqué pour leur élimination, plutôt que l'administration d'émétiques. L'hypotension artérielle est généralement une conséquence du blocage des récepteurs adrénergiques et doit être corrigée par l'administration de dopamine et de noradrénaline. En cas d'arythmie cardiaque, l'utilisation de lidocaïne est indiquée.
Mécanisme d'action et effets pharmacologiques des antipsychotiques typiques
Avec le développement de la psychopharmacologie, diverses hypothèses ont été avancées quant à l'effet des antipsychotiques sur les neurorécepteurs. L'hypothèse principale reste leur effet sur les neurostructures dopaminergiques (principalement les récepteurs D2), sur la base de données sur la perturbation du métabolisme normal de la dopamine dans les structures cérébrales lors de psychoses. Les récepteurs dopaminergiques D2 sont situés dans les noyaux gris centraux, le noyau accumbens et le cortex frontal; ils jouent un rôle majeur dans la régulation du flux d'informations entre le cortex cérébral et le thalamus.
La figure démontre une compréhension plus détaillée des perturbations de la transmission de la dopamine dans les zones corticales et sous-corticales du cerveau et du rôle de ces perturbations dans le développement des symptômes de la schizophrénie (adapté de la monographie de Jones RB, Buckley PF, 2006).
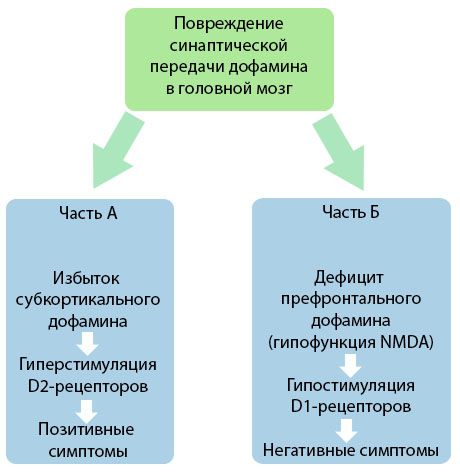
La partie A reflète la théorie classique et ancienne de la dopamine, postulant un excès de dopamine dans les zones sous-corticales et une hyperstimulation des récepteurs D2, conduisant à l'apparition de symptômes productifs. La partie B illustre la modernisation ultérieure de la théorie au début des années 1990. Les données obtenues à cette époque ont révélé qu'un déficit en dopamine dans les récepteurs D2, associé à une stimulation insuffisante de ces récepteurs dans le cortex préfrontal, entraîne l'apparition de symptômes négatifs et de déficits cognitifs. Par conséquent, selon les connaissances actuelles, les deux types de troubles de la transmission dopaminergique – un excès de dopamine sous-corticale et son déficit dans le cortex préfrontal – résultent d'une perturbation de la transmission synaptique dans la zone préfrontale et sont associés à une hypofonction du N-méthyl-N-aspartate. Outre la dopamine initialement isolée, d'autres neurotransmetteurs impliqués dans la pathogenèse de la schizophrénie ont été identifiés ultérieurement, tels que la sérotonine, l'acide gamma-aminobutyrique, le glutamate, la noradrénaline, l'acétylcholine et divers neuropeptides. Bien que le rôle de ces médiateurs n'ait pas été entièrement étudié, l'évolution des connaissances montre clairement qu'ils se manifestent par de nombreux changements neurochimiques dans l'organisme. Par conséquent, l'effet clinique d'un antipsychotique résulte de la synthèse des effets sur diverses formations de récepteurs et conduit à l'élimination des troubles de l'homéostasie.
Ces dernières années, grâce à l'émergence de nouvelles méthodes de recherche telles que la liaison de ligands radio-isotopiques et la TEP, des progrès significatifs ont été réalisés dans la compréhension du mécanisme d'action biochimique précis des neuroleptiques. En particulier, la force et le tropisme comparatifs des médicaments à se lier à des neurorécepteurs individuels dans diverses zones et structures du cerveau ont été déterminés. Une dépendance directe de la sévérité de l'effet antipsychotique d'un médicament à la force de son effet bloquant sur divers récepteurs dopaminergiques a été démontrée. Récemment, quatre types de ces récepteurs ont été identifiés:
- Les D1 sont situés principalement dans la région de la substance noire et du striatum (région dite nigro-striatale), ainsi que dans la région préfrontale;
- D2 - dans les régions nigrostriatales, mésolimbiques et l'hypophyse antérieure (sécrétion de prolactine);
- D3 (présynaptique) - dans diverses structures cérébrales, contrôle l'activité dopaminergique selon la loi de rétroaction négative;
- D4 (présynaptique) - principalement dans les zones nigrostriatales et mésolimbiques.
Parallèlement, il est désormais prouvé que c'est le blocage des récepteurs D2 qui provoque le développement d'effets antipsychotiques, sédatifs secondaires et d'effets secondaires extrapyramidaux. D'autres manifestations cliniques du blocage de ce type de récepteurs sont l'effet analgésique et antiémétique des neuroleptiques (réduction des nausées et des vomissements par suppression du centre du vomissement), ainsi qu'une diminution du taux d'hormone de croissance et une augmentation de la production de prolactine (effets secondaires neuroendocriniens, notamment galactorrhée et irrégularités menstruelles). Le blocage prolongé des récepteurs D2 nigrostriataux entraîne l'apparition de leur hypersensibilité, responsable du développement de dyskinésies tardives et de psychoses d'hypersensibilité. Les manifestations cliniques probables du blocage des récepteurs présynaptiques D3 et D4 sont principalement associées à l'effet stimulant des neuroleptiques. En raison du blocage partiel de ces récepteurs dans les zones nigrostriatales et mésolimbocorticales, les neuroleptiques activateurs et incisifs (puissants, très actifs) à petites doses peuvent stimuler et, à fortes doses, supprimer la transmission dopaminergique.
Ces dernières années, l'intérêt pour le fonctionnement des systèmes sérotoninergiques cérébraux, notamment des récepteurs de la sérotonine, a fortement augmenté. En effet, dans diverses parties du cerveau, le système sérotoninergique exerce un effet modulateur sur les structures dopaminergiques. En particulier, dans la région mésocorticale, la sérotonine inhibe la libération de dopamine; par conséquent, le blocage des récepteurs 5-HT postsynaptiques entraîne une augmentation de la concentration en dopamine. Comme on le sait, le développement de symptômes négatifs dans la schizophrénie est associé à un hypofonctionnement des neurones dopaminergiques dans les structures préfrontales du cortex cérébral. Actuellement, une quinzaine de types de récepteurs 5-HT centraux sont connus. Il a été démontré expérimentalement que les neuroleptiques se lient principalement aux récepteurs 5-HT des trois premiers types.
Ces médicaments ont principalement un effet stimulant (agoniste) sur les récepteurs 5-HT1α. Conséquences cliniques probables: augmentation de l’activité antipsychotique, diminution de la sévérité des troubles cognitifs, correction des symptômes négatifs, effet antidépresseur et diminution de l’incidence des effets secondaires extrapyramidaux.
L'effet des neuroleptiques sur les récepteurs 5-HT2, en particulier sur les sous-types 5-HT2a, est d'une importance capitale. Ils sont principalement localisés dans le cortex cérébral et leur sensibilité est accrue chez les patients atteints de schizophrénie. La capacité des neuroleptiques de nouvelle génération à réduire la sévérité des symptômes négatifs, à améliorer les fonctions cognitives, à réguler le sommeil en augmentant la durée totale des phases de sommeil lent (onde D), à réduire l'agressivité et à soulager les symptômes dépressifs et les céphalées de type migraineux (liées à des troubles cérébrovasculaires) est associée au blocage des récepteurs 5-HT2a. En revanche, le blocage des récepteurs 5-HT2a peut entraîner des effets hypotenseurs et des troubles de l'éjaculation chez l'homme.
On pense que l’effet des neuroleptiques sur les récepteurs 5-HT2c provoque un effet sédatif (anxiolytique), une augmentation de l’appétit (accompagnée d’une augmentation du poids corporel) et une diminution de la production de prolactine.
Les récepteurs 5-HT3 sont situés principalement dans la région limbique et, lorsqu'ils sont bloqués, l'effet antiémétique se développe en premier, et les effets antipsychotiques et anxiolytiques sont également renforcés.
L'apparition de symptômes parkinsoniens dépend également du pouvoir inhibiteur du médicament sur les récepteurs cholinergiques muscariniques. Les effets cholinolytiques et dopaminergiques sont, dans une certaine mesure, réciproques. On sait, par exemple, que dans la région nigrostriée, les récepteurs D2 inhibent la libération d'acétylcholine. Lorsque plus de 75 % des récepteurs D2 de la région nigrostriée sont bloqués, l'équilibre est perturbé en faveur du système cholinergique. C'est la raison pour laquelle les anticholinergiques (correcteurs) ont un effet correcteur sur les effets secondaires extrapyramidaux des neuroleptiques. Le chlorprothixène, la clozapine et l'olanzapine ont une forte affinité pour les récepteurs muscariniques et ne provoquent pratiquement pas d'effets secondaires extrapyramidaux, car ils bloquent simultanément les récepteurs cholinergiques et dopaminergiques. L'halopéridol et les dérivés de la phénothiazine pipérazine ont un effet prononcé sur les récepteurs de la dopamine, mais un effet très faible sur les récepteurs de la choline. Cela est dû à leur capacité à provoquer des effets secondaires extrapyramidaux prononcés, qui diminuent à très fortes doses, lorsque l'effet cholinolytique devient perceptible. Outre la réduction de l'effet bloquant de la dopamine sur les récepteurs D2 de la région nigro-striatale et l'atténuation des effets secondaires extrapyramidaux, un fort effet cholinergique peut entraîner une détérioration des fonctions cognitives, notamment des troubles de la mémoire, ainsi que des effets secondaires périphériques (sécheresse des muqueuses, troubles de l'accommodation visuelle, constipation, rétention urinaire, confusion, etc.). Les neuroleptiques ont un effet bloquant assez puissant sur les récepteurs histaminiques de type I, associé principalement à l'intensité de l'effet sédatif, ainsi qu'à une prise de poids due à une augmentation de l'appétit. Les effets antiallergiques et antiprurigineux des neuroleptiques sont également associés à leurs propriétés antihistaminiques.
Outre leurs effets inhibiteurs de la dopamine, antisérotoninergiques, cholinolytiques et antihistaminiques, la plupart des neuroleptiques possèdent des propriétés adrénolytiques, c'est-à-dire qu'ils bloquent les récepteurs α1-adrénergiques centraux et périphériques. Les adrénobloquants tels que la chlorpromazine et le chlorprothixène ont un effet sédatif prononcé. De plus, l'effet bloquant de ces médicaments peut entraîner des effets secondaires neurovégétatifs (hypotension artérielle, tachycardie, etc.), ainsi qu'une augmentation de l'effet hypotenseur des adrénobloquants.
Les travaux d’un grand nombre d’auteurs fournissent des données sur la force de liaison (affinité) des neuroleptiques individuels avec différents types de neurorécepteurs.
En fonction de leur profil d’action neurochimique, les antipsychotiques typiques et atypiques, parmi ceux principalement utilisés en pratique clinique, peuvent être conditionnellement divisés en six groupes.
Le premier groupe comprend les bloqueurs sélectifs des récepteurs D2 et D4 (sulpiride, amisudpride, halopéridol, etc.) issus des groupes des dérivés du benzamide et de la butyrophénone. À faibles doses, principalement grâce au blocage des récepteurs D4 présynaptiques, ils activent la transmission dopaminergique de l'influx nerveux et exercent un effet stimulant (désinhibiteur). À fortes doses, ils bloquent les récepteurs D2 dans toutes les zones du cerveau, ce qui se manifeste cliniquement par un effet antipsychotique prononcé, ainsi que par des effets secondaires extrapyramidaux et endocriniens (dus à la prolactinémie).
Le deuxième groupe comprend les inhibiteurs des récepteurs D2 hautement actifs, ainsi que les médicaments bloquant faiblement ou modérément les récepteurs 5-HT2a et 5-HT1a (flupentixol, fluphénazine, zuclopenthixol, etc.), c'est-à-dire principalement des dérivés pipéraziniques de la phénothiazine ou des thioxanthènes proches de leur structure stéréochimique. Comme les médicaments du premier groupe, ces neuroleptiques ont avant tout un effet antipsychotique prononcé (incisif) et provoquent également des effets extrapyramidaux et une prolactinémie. À faibles doses, ils ont un effet modérément activateur (psychostimulant).
Le troisième groupe comprend les neuroleptiques sédatifs polyvalents qui bloquent la plupart des neurorécepteurs de manière indifférenciée. Ces médicaments ont un effet bloquant clairement exprimé sur les récepteurs de la dopamine et induisent également de puissants effets adrénolytiques et cholinolytiques. Cela inclut la plupart des neuroleptiques sédatifs, principalement les dérivés aliphatiques et pipéridiniques de la phénothiazine, ainsi que les thioxanthènes qui leur sont proches par leur structure stéréochimique (chlorpromazine, lévomépromazine, chlorprothixène, etc.). Le spectre d'activité psychotrope de ces médicaments est dominé, tout d'abord, par un effet sédatif primaire prononcé, se développant quelle que soit la dose utilisée, et par un effet antipsychotique modéré. De plus, en raison de leur effet anticholinergique prononcé, les médicaments de ce groupe provoquent des effets secondaires extrapyramidaux et neuroendocriniens faibles à modérés, mais entraînent souvent le développement d'une hypotension orthostatique et d'autres réactions autonomes dues au blocage prononcé des récepteurs α1-adrénergiques.
Le quatrième groupe comprend les neuroleptiques qui bloquent les récepteurs D2 et 5-HT2a de manière équilibrée, c'est-à-dire dans la même mesure (ces derniers dans une mesure légèrement supérieure), et les récepteurs α1-adrénergiques dans une mesure modérée. Ce groupe comprend des représentants de la nouvelle génération d'antipsychotiques atypiques (rispéridone, ziprasidone, sertindole), qui présentent des structures chimiques différentes. Le mécanisme d'action neurochimique détermine leur influence sélective principalement sur les zones mésolimbiques et mésocorticales du cerveau. Outre un effet antipsychotique distinct, l'absence ou la faible expression d'effets secondaires extrapyramidaux (aux doses thérapeutiques), une prolactinémie faible ou modérée et des propriétés adrénolytiques modérées (réactions hypotensives), ce groupe de neuroleptiques est capable de corriger les symptômes négatifs par stimulation indirecte de la transmission dopaminergique dans le cortex cérébral.
Le cinquième groupe comprend les antipsychotiques atypiques polyvalents de type dibenzodiazépine tricyclique ou structure similaire (clozapine, olanzapine et quétiapine). Tout comme les médicaments du troisième groupe, ils bloquent la plupart des neurorécepteurs de manière indifférenciée. Cependant, les récepteurs 5-HT2a sont plus fortement bloqués que les récepteurs D2 et D4, en particulier ceux situés dans la région nigrostriatale. Ceci explique l'absence ou la faiblesse de l'effet extrapyramidal et l'absence d'effets secondaires neuroendocriniens associés à une augmentation de la production de prolactine, avec un effet antipsychotique marqué et la capacité à réduire la gravité des symptômes négatifs. De plus, tous les médicaments de ce groupe possèdent des propriétés adrénolytiques et antihistaminiques prononcées, ce qui explique leurs effets sédatifs et hypotenseurs. La clozapine et l'olanzapine ont également un effet bloquant assez prononcé sur les récepteurs muscariniques et entraînent le développement d'effets secondaires cholinolytiques.
Ainsi, la capacité de bloquer les récepteurs dopaminergiques postsynaptiques avec une augmentation compensatoire de la synthèse et du métabolisme de la dopamine est la seule propriété biochimique commune à tous les neuroleptiques considérés dans ces groupes.
Le sixième groupe comprend l'aripiprazole, seul antipsychotique atypique, apparu relativement récemment sur le marché national des médicaments psychopharmacologiques. Ce médicament est un agoniste partiel des récepteurs dopaminergiques D2 et agit comme antagoniste fonctionnel en cas d'hyperdopaminergie et d'hypodopamine. Ce profil récepteur unique de l'aripiprazole permet de réduire le risque de troubles extrapyramidaux et d'hyperprolactinémie. De plus, l'aripiprazole agit à la fois comme agoniste partiel des récepteurs 5-HT1a et comme antagoniste des récepteurs 5-HT2a. On suppose qu'une telle interaction avec les récepteurs conduit à un fonctionnement globalement équilibré des systèmes sérotoninergique et dopaminergique; le mécanisme d'action de l'aripiprazole peut donc être qualifié de stabilisateur du système dopaminergique.
Ainsi, l'état actuel des connaissances sur les mécanismes d'action neurochimiques des neuroleptiques nous permet de proposer une nouvelle classification pharmacodynamique, plus étayée sur le plan pathogénique, de ce groupe de médicaments psychotropes. L'utilisation de cette classification permet de prédire dans une large mesure le spectre d'activité psychotrope, la tolérance et les interactions médicamenteuses probables d'un médicament donné. En d'autres termes, les caractéristiques de l'activité neurochimique d'un médicament déterminent en grande partie son activité clinique, qui doit être prise en compte lors du choix d'un antipsychotique spécifique pour un patient donné.
L'efficacité de l'effet antipsychotique global de tout neuroleptique est estimée à l'aide de l'équivalent chlorpromazine, considéré comme égal à 1. Par exemple, l'équivalent chlorpromazine de l'halopéridol est égal à 50. Cela signifie que l'efficacité antipsychotique de 1 mg d'halopéridol est comparable à celle de 50 mg de chlorpromazine. Sur la base de cet indicateur, une classification a été élaborée, permettant de distinguer les neuroleptiques ayant une activité antipsychotique élevée (équivalent chlorpromazine > 10,0), moyenne (équivalent chlorpromazine = 1,0-10,0) et faible (équivalent chlorpromazine = 1,0), appelée patentité. Les neuroleptiques classiques (antipsychotiques de première génération) sont largement utilisés en psychopharmacothérapie clinique depuis près d'un demi-siècle. Leur spectre d'activité thérapeutique comprend:
- action antipsychotique globale sous la forme de la capacité à réduire de manière uniforme et différentielle diverses manifestations de la psychose:
- effet sédatif primaire (inhibiteur) - capacité des médicaments à soulager rapidement l'agitation psychomotrice;
- action antipsychotique sélective, sélective, se manifestant par la capacité d'influencer les symptômes individuels: délire, hallucinations, désinhibition des pulsions, etc.
- action neurotrope activatrice (désinhibitrice, désinhibitrice, antiautistique), se manifestant par le développement de symptômes extrapyramidaux;
- action somatotrope sous forme de développement d'effets secondaires neuroendocriniens et végétatifs;
- effet dépresseur, exprimé par la capacité de certains antipsychotiques à provoquer des symptômes dépressifs.
L'efficacité des antipsychotiques de première génération dans le traitement des troubles psychotiques, mais aussi des troubles de la psychiatrie limite, a été maintes fois démontrée et est incontestable. Par conséquent, malgré la fréquence élevée des effets secondaires liés à leur prescription, ils continuent d'être utilisés en pratique médicale.
Antipsychotiques atypiques
Les recommandations modernes contiennent des données sur les avantages de l'utilisation des antipsychotiques de deuxième génération en pharmacothérapie. Le terme « atypique » (synonyme d'antipsychotiques de deuxième génération) est conditionnel et est utilisé principalement pour désigner la nouvelle génération. Comparés aux neuroleptiques traditionnels, les médicaments de ce groupe sont plus efficaces pour corriger les troubles négatifs, affectifs et cognitifs, ce qui s'accompagne d'une meilleure tolérance et d'un risque moindre de symptômes extrapyramidaux. Les différences d'effet thérapeutique de l'un ou l'autre médicament d'une série d'antipsychotiques atypiques s'expliquent, comme pour le groupe des neuroleptiques typiques, par son profil d'action pharmacologique spécifique.
Pour clarifier les possibilités de psychopharmacothérapie avec des antipsychotiques atypiques, il est conseillé de se concentrer sur les médicaments de ce groupe enregistrés en Russie.
 [ 28 ], [ 29 ], [ 30 ], [ 31 ], [ 32 ], [ 33 ]
[ 28 ], [ 29 ], [ 30 ], [ 31 ], [ 32 ], [ 33 ]
Clozapine (dibenzodiazépine)
Fondateur du groupe des antipsychotiques atypiques. Le mécanisme d'action de la clozapine se caractérise par un léger blocage des récepteurs D2 associé à un fort antagonisme des récepteurs 5-HT2a, α1, α2-adrénergiques et H1-histaminiques. Elle s'est avérée efficace en cas de résistance à d'autres antipsychotiques (médicament de réserve) et est également indiquée pour le traitement des épisodes maniaques chroniques, de l'agitation psychotique et de l'agressivité. En pratique quotidienne, la clozapine est souvent prescrite pour la sédation et comme hypnotique chez les patients psychotiques. Il convient de reconnaître qu'une telle utilisation de la clozapine ne correspond pas à ses principales indications thérapeutiques. Il est probable que le traitement de cet antipsychotique, considéré comme un médicament d'importance secondaire, doive être revu, car il est aujourd'hui le seul médicament dont l'efficacité chez les patients résistants est prouvée.
Contrairement aux neuroleptiques classiques, la clozapine n'entraîne pas de troubles extrapyramidaux graves en raison de sa faible affinité pour les récepteurs O₂ mentionnée précédemment. Il s'est également avéré qu'elle peut être utilisée pour traiter la dystonie tardive et l'akathisie sévère. Compte tenu du faible risque de développer un SMN, la clozapine peut être considérée comme un médicament de choix chez les patients ayant déjà souffert de cette complication.
Cependant, un certain nombre d'effets secondaires graves peuvent survenir pendant le traitement par clozapine. Le plus dangereux d'entre eux (même à faible dose) est l'agranulocytose, qui survient chez 0,5 à 1 % des patients. D'autres effets secondaires importants peuvent survenir lors de l'utilisation de ce médicament, notamment la somnolence, l'hypersalivation et la prise de poids, souvent déjà importante au moment de la prescription de clozapine, sous l'influence d'un traitement antipsychotique antérieur. Il convient également de prêter attention au risque de développer une tachycardie, une hypotension artérielle et des crises d'épilepsie lors du traitement. La probabilité de crises dépend de la dose. Leur risque augmente significativement si la dose de clozapine dépasse 600 mg/jour. L'apparition de crises ne constitue pas une contre-indication à la poursuite du traitement, mais nécessite une réduction de moitié de la dose et la prescription d'anticonvulsivants, tels que l'acide valproïque. La prévention des effets secondaires du traitement par clozapine comprend une surveillance attentive de la numération leucocytaire, ainsi que de l'ECG et des paramètres endocriniens.
Un surdosage en clozapine peut entraîner une dépression de la conscience pouvant aller jusqu'au coma, ainsi que des symptômes associés à l'effet cholinolytique (tachycardie, délire), des crises d'épilepsie, une dépression respiratoire et des syndromes extrapyramidaux. Une dose supérieure à 2 500 mg peut entraîner le décès.
 [ 34 ], [ 35 ], [ 36 ], [ 37 ], [ 38 ], [ 39 ], [ 40 ], [ 41 ]
[ 34 ], [ 35 ], [ 36 ], [ 37 ], [ 38 ], [ 39 ], [ 40 ], [ 41 ]
Rispéridone
Dérivé du benzisoxazole présentant une forte affinité pour les récepteurs Dj de la sérotonine et de la dopamine, et exerçant une action prédominante sur le système sérotoninergique. Ce médicament a de nombreuses indications, notamment le soulagement des exacerbations, le traitement anti-rechute, le traitement du premier épisode psychotique et la correction des symptômes négatifs de la schizophrénie. Il a été démontré que ce médicament améliore les fonctions cognitives chez les patients schizophrènes. Des données préliminaires indiquent que la rispéridone réduit également les symptômes affectifs comorbides chez les patients schizophrènes et pourrait être un médicament de choix dans le traitement des troubles affectifs bipolaires.
Les effets secondaires du traitement par rispéridone, en particulier les troubles extrapyramidaux, sont dose-dépendants et surviennent plus fréquemment à des doses supérieures à 6 mg/jour. Parmi les autres effets secondaires, on peut citer les nausées, les vomissements, l'anxiété, la somnolence et l'augmentation du taux de prolactine sérique. L'utilisation prolongée de rispéridone peut entraîner une prise de poids et le développement d'un diabète de type 2, mais avec une probabilité plus faible que pour la clozapine ou l'olanzapine.
Un surdosage peut provoquer somnolence, crises d'épilepsie, allongement de l'intervalle QT et élargissement du complexe QRS, ainsi qu'hypotension artérielle. Des cas d'issue fatale par surdosage de rispéridone ont été décrits.
L'avantage incontestable du médicament réside dans sa disponibilité en formes liquide et à dissolution rapide (sublinguale), dont l'utilisation accélère l'absorption du médicament et facilite le contrôle de sa prise. Il existe également une forme prolongée: une poudre pour suspension pour administration intramusculaire (consta-rispéridone en microsphères). Ce médicament est recommandé pour le traitement d'entretien des patients atteints de schizophrénie, en particulier chez les patients présentant une mauvaise observance thérapeutique. Il est important de noter que le médicament met environ trois semaines à pénétrer dans la circulation sanguine. Par conséquent, lors de l'instauration d'un traitement par consta-rispéridone, le patient doit prendre en complément la forme orale de rispéridone pendant au moins trois semaines après la première injection.
Olanzapine
En termes d'action pharmacologique, l'olanzapine est proche de la clozapine, car elle possède un profil de récepteurs pléiomorphes avec une affinité significative pour les récepteurs sérotoninergiques, muscariniques, α1-adrénergiques et histaminiques. Son activité thérapeutique est similaire à celle de la clozapine et de la rispéridone en termes d'impact sur les symptômes positifs, négatifs et dépressifs de la schizophrénie. Parallèlement, des données ont été obtenues sur la plus grande efficacité de l'olanzapine par rapport à d'autres antipsychotiques atypiques chez les patients présentant un premier épisode psychotique et dans la correction des indicateurs du fonctionnement cognitif. Il convient de noter qu'au début du traitement par comprimé, un effet désinhibiteur rapide peut apparaître, accompagné d'une augmentation de l'agitation psychomotrice et de l'anxiété. Par conséquent, dans le traitement des crises accompagnées d'une agitation psychomotrice sévère, l'utilisation de la forme injectable est indiquée.
L'olanzapine provoque rarement des troubles extrapyramidaux ou des dyskinésies tardives, et ses effets secondaires les plus fréquents sont des troubles métaboliques et une prise de poids. Il a été établi que les patients traités par olanzapine présentent souvent une élévation du cholestérol et des lipides plasmatiques, ainsi qu'une prédisposition au diabète de type 2. Cependant, ces effets étaient tout aussi fréquents chez les patients traités par olanzapine et par clozapine. Parallèlement, des données ont montré que la prise de poids est corrélée à une réponse positive à l'olanzapine (c'est-à-dire qu'elle constitue un indicateur pronostique important du traitement) et qu'elle n'évolue vers l'obésité que chez 20 à 30 % des patients ayant pris du poids pendant le traitement.
Un surdosage peut entraîner une sédation, des effets anticholinergiques toxiques, des crises d'épilepsie et une hypotension artérielle. Il n'existe actuellement aucune donnée convaincante permettant d'évaluer le risque de décès par surdosage.
Quétiapine
Il est classé comme un composé dibenzothiazépine. Son profil de récepteurs est largement similaire à celui de la clozapine. Le taux de liaison de la quétiapine aux récepteurs D2 est faible (moins de 50 %) et de courte durée, même à fortes doses. Ce médicament est efficace dans le traitement des symptômes positifs, négatifs et généraux de la schizophrénie. Son efficacité a été démontrée tant en cas de forte résistance au traitement que pour améliorer les fonctions cognitives des patients, ce qui justifie sa recommandation comme antipsychotique de première intention pour le traitement d'entretien de la schizophrénie. Enfin, la quétiapine possède un effet antidépresseur modéré et activateur. Par conséquent, elle est indiquée dans le traitement des crises dépressives délirantes et des troubles du cercle sénesto-hypocondriaque.
L'activité thymotrope élevée de la quétiapine explique son homologation comme traitement pour le soulagement et la prévention secondaire des troubles dépressifs. Pour le traitement des épisodes maniaques dans les troubles bipolaires de type I et II, la quétiapine est utilisée en complément. L'absence de forme injectable limite quelque peu son utilisation chez les patients agités et agressifs.
La quétiapine est bien tolérée; elle ne provoque pratiquement pas de syndromes extrapyramidaux, sauf en cas d'utilisation de doses maximales. Elle n'entraîne pas d'hyperprolactinémie, mais, moins fréquemment que l'olanzapine et la clozapine, elle entraîne une prise de poids et une altération de la tolérance au glucose.
Ziprasidone
Possède un profil d'activité récepteur unique. Puissamment antagoniste des récepteurs 5HT2a et D2, il est également un inhibiteur actif de la recapture de la sérotonine et de la noradrénaline. Des études cliniques ont démontré une supériorité significative de la ziprasidone sur les symptômes psychotiques et les manifestations d'agressivité par rapport à l'halopéridol. Des données attestent également de l'effet positif de la ziprasidone sur les fonctions cognitives des patients schizophrènes, ainsi que sur les symptômes affectifs comorbides, indicateurs du fonctionnement social. La ziprasidone est généralement bien tolérée et provoque très rarement des syndromes extrapyramidaux, une prise de poids et des troubles métaboliques. Un allongement de l'intervalle QT supérieur à 460 ms est plus fréquent; il est donc conseillé aux patients traités par ce médicament de réaliser un ECG avant la prescription et une surveillance pendant le traitement. Une attention particulière doit être portée au traitement concomitant (prise de médicaments antiarythmiques), qui peut aggraver l'allongement de l'intervalle QT et conduire au développement d'une arythmie cardiaque, d'une fibrillation ventriculaire.
Sertindole
Appartient à la famille des dérivés du phénylindole. Il présente un fort antagonisme fonctionnel vis-à-vis des récepteurs D2, sérotoninergiques (notamment les récepteurs 5-HT2a) et α1-adrénergiques. D'après des études électroneurochimiques, le sertindole inhibe sélectivement les récepteurs dopaminergiques de la région segmentaire ventrale. Cette sélectivité garantit vraisemblablement un faible risque de syndromes extrapyramidaux et d'hyperprolactinémie lors de l'utilisation de ce médicament. Des études comparatives ont montré que le sertindole est comparable à l'halopéridol en termes d'activité antipsychotique. Ce médicament exerce un effet désinhibiteur prononcé chez les patients présentant des symptômes négatifs et dépressifs, supérieur à un effet similaire du rispolept. Des données confirment également l'efficacité du sertindole pour la correction des troubles cognitifs chez les patients atteints de schizophrénie. Le sertindole est généralement bien toléré par les patients, provoque rarement une sédation et est donc recommandé comme médicament de substitution en cas d'effets secondaires lors d'un traitement par d'autres antipsychotiques modernes.
Parmi les effets secondaires graves, on peut citer la capacité du médicament à allonger l'intervalle QT, ce qui peut entraîner une arythmie cardiaque. L'analyse des études post-commercialisation a montré que le profil cardiaque du sertindole ne diffère pas de celui des autres antipsychotiques de nouvelle génération.
Aripiprazole
Son activité antipsychotique est comparable à celle d'autres agents atypiques, mais son effet sur les fonctions cognitives des patients schizophrènes est plus marqué. L'action pharmacologique unique du médicament, agoniste partiel des récepteurs D2, permet de réduire le risque de syndromes extrapyramidaux et d'hyperprolactinémie.
 [ 42 ], [ 43 ], [ 44 ], [ 45 ], [ 46 ], [ 47 ]
[ 42 ], [ 43 ], [ 44 ], [ 45 ], [ 46 ], [ 47 ]
Amisulpride
Appartient à la classe des benzamides substitués. Ce médicament se lie sélectivement aux sous-types de récepteurs dopaminergiques D2 et D3 et n'a aucune affinité pour les sous-types D1, D4 et D5, ni pour les récepteurs sérotoninergiques, histaminiques H1, α1-adrénergiques et cholinergiques. À fortes doses, il bloque les récepteurs postsynaptiques D2. À faibles doses, son effet désinhibiteur se manifeste par le blocage des récepteurs présynaptiques D2 et D3, ce qui le rend également efficace dans le traitement des symptômes négatifs, bien qu'il ne soit pas un antagoniste combiné des récepteurs D2 et sérotoninergiques. Les résultats de plusieurs études indiquent une activité antipsychotique prononcée du médicament à fortes doses, supérieure à celle des médicaments traditionnels.
 [ 48 ], [ 49 ], [ 50 ], [ 51 ], [ 52 ], [ 53 ], [ 54 ], [ 55 ]
[ 48 ], [ 49 ], [ 50 ], [ 51 ], [ 52 ], [ 53 ], [ 54 ], [ 55 ]
Effets secondaires du traitement antipsychotique
Le tableau répertorie les principaux effets secondaires du traitement antipsychotique atypique.
Préparation |
|
Trouble de conduction à l'ECG |
Troubles métaboliques (prise de poids, augmentation des taux de glucose, de cholestérol, de triglycérides dans le sang) |
||
Clozapine |
. |
++ |
++ |
++- |
|
Rispéridone |
++ |
+/- |
++ |
+/- |
|
Olanzapine |
+ |
+/- |
+++ |
++ |
+++ |
Quétiapine |
+/- |
+ |
+/- |
--- |
|
Ziprasidone |
+ |
++ |
+/- |
+/- |
+/- |
Sertindole |
++ |
-- |
+/- |
-- |
|
Ariliprazole |
-- |
--- |
+/- |
-- |
-- |
Amisulpride |
++ |
+/- |
|||
Remarque. Gravité des effets secondaires: « +++ » - élevée; « ++ » - moyenne; « + » - faible; « +/- » - discutable; « - » - absente.
Syndromes extrapyramidaux
L'une des principales caractéristiques des antipsychotiques atypiques, contrairement aux antipsychotiques traditionnels, est leur faible potentiel à induire des syndromes extrapyramidaux, ce qui constitue une avancée majeure dans le traitement pharmacologique d'entretien de la schizophrénie. Cependant, comme le montre le tableau, l'utilisation de certains médicaments de cette série (rispéridone, amisulpride) peut entraîner l'apparition de tels symptômes, nécessitant une attention particulière lors de leur prescription.
 [ 3 ], [ 4 ], [ 5 ], [ 6 ], [ 7 ], [ 8 ], [ 9 ], [ 10 ]
[ 3 ], [ 4 ], [ 5 ], [ 6 ], [ 7 ], [ 8 ], [ 9 ], [ 10 ]
Anomalies de l'ECG
Le risque d'effets secondaires cardiaques constitue un problème sérieux lors de l'utilisation de certains antipsychotiques modernes en traitement. Dans ces cas, on parle d'allongement de l'intervalle QT, pouvant entraîner une arythmie. Des troubles de la conduction, principalement un allongement de l'intervalle QT, sont le plus souvent observés lors d'un traitement par clozapine, sertindole et ziprasidone. Une pathologie concomitante telle qu'une bradycardie, un bloc auriculo-ventriculaire ou une hypothyroïdie peut contribuer à l'apparition de cette complication lors d'un traitement par ces médicaments. Actuellement, une surveillance ECG est recommandée environ tous les trois mois chez les patients recevant un traitement d'entretien par antipsychotiques atypiques.
 [ 11 ], [ 12 ], [ 13 ], [ 14 ], [ 15 ]
[ 11 ], [ 12 ], [ 13 ], [ 14 ], [ 15 ]
Troubles endocriniens
Actuellement, la principale préoccupation concerne la capacité des antipsychotiques atypiques à entraîner une prise de poids. Une augmentation du poids corporel, de la glycémie et des triglycérides peut entraîner des troubles métaboliques et le développement d'un diabète de type 2. Une prudence particulière et une surveillance hebdomadaire des paramètres biochimiques sont nécessaires lors d'un traitement par clozapine et olanzapine. Selon J. Geddes et al. (2000), PB Jones, PF Buckley (2006), il convient de procéder à un examen approfondi des patients avant de leur prescrire un antipsychotique de nouvelle génération, car il est connu que les troubles métaboliques surviennent plus souvent chez les patients présentant une prédisposition héréditaire, un excès de poids, des troubles du spectre lipidique et une hyperglycémie avant le début du traitement. L'algorithme de surveillance proposé par PB Jones et PF Buckley (2006) comprend plusieurs points.
- Recueil des antécédents médicaux et des facteurs familiaux concernant le risque de troubles métaboliques.
- Enregistrement de l'indice de masse corporelle, de l'ECG, de la tension artérielle et du pouls avant le début du traitement.
- Recueil de données de laboratoire (glycémie, profil lipidique, cholestérol) avant le début du traitement.
- Surveillance régulière de l’indice de masse corporelle et des signes vitaux pendant le traitement.
- Suivi des données de laboratoire pendant le traitement.
L'apparition d'une hyperprolactinémie sous traitement antipsychotique est due au blocage central des récepteurs de la dopamine dans l'hypothalamus, ce qui entraîne la libération de prolactine par l'hypophyse antérieure. L'hyperprolactinémie survient le plus souvent lors d'un traitement par olanzapine, rispéridone et amisulpride.
 [ 16 ], [ 17 ], [ 18 ], [ 19 ], [ 20 ]
[ 16 ], [ 17 ], [ 18 ], [ 19 ], [ 20 ]
Agranulocytose
Une autre complication grave du traitement antipsychotique peut être observée lors d'un traitement par clozapine et olanzapine. Selon J. Geddes et al. (2000), elle a été diagnostiquée au cours des trois premiers mois chez 1 à 2 % des patients prenant ces médicaments. À cet égard, des analyses sanguines hebdomadaires sont recommandées pour les patients prenant ces médicaments pendant les 18 premières semaines de traitement, puis une surveillance mensuelle par la suite. Il a été démontré qu'une réduction de la dose des neuroleptiques mentionnés précédemment normalise les analyses sanguines. Il convient toutefois de noter qu'à ce jour, il n'existe pas de stratégie claire pour les patients présentant les effets secondaires mentionnés ci-dessus associés à des troubles métaboliques. Le plus souvent, un antipsychotique atypique est remplacé par un autre. Une autre piste prometteuse est la mise en place d'un traitement correctif spécifique, notamment l'utilisation de bromocriptine pour corriger l'hyperprolactinémie. L'idéal est que la prise en charge d'un patient présentant de tels troubles soit assurée avec la participation régulière d'internistes, notamment d'endocrinologues, de cardiologues et d'autres spécialistes.
En conclusion, il convient de noter que si les algorithmes donnés pour la prescription et le suivi non seulement de l'état mental mais aussi physique des patients sont suivis, l'utilisation de médicaments de deuxième génération est plus sûre que les neuroleptiques classiques.
Plusieurs autres antipsychotiques sont actuellement en cours de développement. Les médicaments de nouvelle génération auront probablement un mécanisme d'action différent (par exemple, un profil GABAergique) et pourront influencer diverses manifestations de la schizophrénie, y compris les troubles déficitaires proprement dits.
Attention!
Pour simplifier la perception de l'information, cette instruction pour l'utilisation du médicament "Neuroleptiques ou antipsychotiques " traduit et présenté sous une forme spéciale sur la base des instructions officielles pour l'usage médical du médicament. Avant l'utilisation, lisez l'annotation qui a été directement envoyée au médicament.
Description fournie à titre informatif et ne constitue pas un guide d'auto-guérison. Le besoin de ce médicament, le but du régime de traitement, les méthodes et la dose du médicament sont déterminés uniquement par le médecin traitant. L'automédication est dangereuse pour votre santé.

