Expert médical de l'article
Nouvelles publications
Malformation artérioveineuse
Dernière revue: 04.07.2025

Tout le contenu iLive fait l'objet d'un examen médical ou d'une vérification des faits pour assurer autant que possible l'exactitude factuelle.
Nous appliquons des directives strictes en matière d’approvisionnement et ne proposons que des liens vers des sites de médias réputés, des instituts de recherche universitaires et, dans la mesure du possible, des études évaluées par des pairs sur le plan médical. Notez que les nombres entre parenthèses ([1], [2], etc.) sont des liens cliquables vers ces études.
Si vous estimez qu'un contenu quelconque de notre contenu est inexact, obsolète ou discutable, veuillez le sélectionner et appuyer sur Ctrl + Entrée.
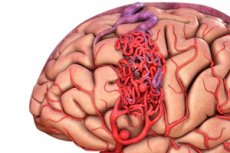
La malformation artérioveineuse est une anomalie congénitale du développement des vaisseaux sanguins, caractérisée par la présence d'un réseau anormal d'anastomoses artérioveineuses. Le plus souvent, les malformations artérioveineuses se situent dans la fosse crânienne postérieure et présentent une structure assez typique: une ou deux artères vraies, un enchevêtrement de MAV et une veine de drainage.
 [ 1 ]
[ 1 ]
Causes malformation artérioveineuse
Les causes possibles du développement des MAV ne sont pas entièrement comprises, mais on pense qu'elles pourraient être liées à des facteurs génétiques et environnementaux. Voici quelques-unes des causes possibles:
- Facteurs génétiques: Des études ont montré que certains patients atteints de MAV ont des antécédents familiaux. Des mutations génétiques pourraient jouer un rôle dans la formation de cette anomalie vasculaire.
- Anomalies congénitales: Des anomalies vasculaires congénitales peuvent se développer au cours du développement embryonnaire. Elles peuvent être dues à des anomalies dans le développement des tissus vasculaires cérébraux.
- Facteurs environnementaux: Certaines études ont démontré un lien entre les MAV et certains facteurs environnementaux, comme les radiations ou l’exposition à des substances toxiques pendant la grossesse. Cependant, ces liens ne sont pas toujours confirmés et n’expliquent pas tous les cas de MAV.
- Facteurs régionaux: Dans certains cas, l’AVM peut être associée à certaines zones géographiques ou à certains groupes ethniques, mais ces associations nécessitent des études plus approfondies.
Outre ces facteurs susceptibles d'influencer le développement des MAV, il est important de noter qu'il s'agit d'une maladie congénitale généralement détectée à la naissance ou dans la petite enfance, bien que des symptômes puissent apparaître plus tard. Des recherches supplémentaires sont nécessaires pour comprendre précisément les causes et les mécanismes du développement des MAV.
Pathogénèse
Le plus dangereux est la rupture des parois malformatives, qui s'accompagne d'une hémorragie intracrânienne spontanée. Cela est dû au fait que du sang mélangé circule dans les vaisseaux malformés sous une pression proche de celle de l'artère. Naturellement, cette pression élevée entraîne un étirement des vaisseaux dégénératifs, une augmentation de leur volume et un amincissement de la paroi. Finalement, la rupture se produit à l'endroit le plus fin. Selon les données statistiques, cela survient chez 42 à 60 % des patients atteints de MAV. La mortalité à la première rupture de MAV atteint 12 à 15 %. Chez les autres patients, les saignements peuvent se répéter, sans périodicité. Nous avons observé un patient ayant présenté onze hémorragies intracrâniennes spontanées en huit ans. Cette évolution relativement « bénigne » de la rupture de MAV, comparée à celle des anévrismes artériels, s'explique par les particularités des troubles hémodynamiques qui surviennent après la rupture. On sait que la rupture d'un anévrisme artériel conduit le plus souvent à une hémorragie sous-arachnoïdienne (HSA) et au développement d'un angiospasme, qui dans les premières minutes est de nature protectrice, aidant à arrêter rapidement le saignement, mais représente par la suite un danger majeur pour la vie du patient.
C'est l'angiospasme, responsable de l'ischémie cérébrale et de l'œdème, qui détermine la gravité de l'état du patient et son pronostic. À l'inverse, l'angiospasme des artères afférentes de la MAV améliore l'apport sanguin au cerveau grâce à une diminution du débit artérioveineux. La rupture d'une MAV entraîne plus souvent la formation d'hématomes intracérébraux et sous-duraux. La percée du sang dans les citernes sous-arachnoïdiennes est secondaire. Le saignement au niveau de la paroi rompue de la MAV s'arrête plus rapidement, car la pression artérielle y est plus faible que dans les artères principales et la paroi est plus sensible à la compression du sang. Naturellement, l'issue n'est pas toujours favorable pour le patient. Les ruptures de MAV les plus dangereuses se produisent près des ventricules cérébraux, dans les ganglions sous-corticaux et dans le tronc cérébral. Dans ce cas, l'angiospasme des artères afférentes permet d'arrêter le saignement.
Le facteur déterminant dans la pathogénèse de la rupture d'une MAV est le volume de sang répandu et la localisation de l'hématome. Les hématomes intracérébraux hémisphériques, même d'un volume allant jusqu'à 60 cm³ , évoluent relativement bien. Ils peuvent provoquer des troubles neurologiques focaux graves, mais entraînent rarement des troubles vitaux graves. La rupture d'un hématome dans les ventricules cérébraux aggrave considérablement le pronostic. D'une part, le sang, irritant l'épendyme des ventricules, augmente la production de liquide céphalorachidien; d'autre part, en affectant le fond du ventricule, il entraîne de graves troubles fonctionnels des centres vitaux situés dans l'hypothalamus. La propagation du sang dans le système ventriculaire entraîne une tamponnade de ce dernier, incompatible avec la vie.
Le sang pénétrant dans les citernes sous-arachnoïdiennes perturbe également la circulation du liquide céphalorachidien, rendant difficile l'accès du liquide céphalorachidien aux granulations du pacchion obstruées par le sang. Par conséquent, la résorption du liquide céphalorachidien ralentit et une hypertension aiguë du liquide céphalorachidien peut se développer, suivie d'une hydrocéphalie interne et externe. La dégradation des éléments figurés du sang répandu entraîne la formation d'une grande quantité de substances toxiques, dont la plupart ont un effet vasoactif. D'une part, cela entraîne une vasoconstriction des petites artères piales et, d'autre part, une augmentation de la perméabilité capillaire. Les produits de dégradation du sang affectent également les cellules nerveuses, modifiant leurs processus biochimiques et perturbant la perméabilité des membranes cellulaires. Tout d'abord, la fonction de la pompe potassium-sodium est modifiée: le potassium commence à quitter la cellule, remplacé par le cation sodium, quatre fois plus hydrophile que le potassium.
Cela entraîne d'abord un œdème intracellulaire autour de l'hémorragie, puis un gonflement des cellules. L'hypoxie contribue également au développement de l'œdème, qui s'ajoute inévitablement à la compression des vaisseaux cérébraux par l'hématome et à l'augmentation de la pression du liquide céphalo-rachidien, comme déjà mentionné. Un dysfonctionnement des régions diencéphaliques du cerveau et, surtout, de la régulation de l'équilibre hydro-électrolytique entraîne une rétention d'eau dans l'organisme et une perte de potassium, ce qui augmente également la réaction œdémateuse du cerveau. La pathogénèse de la rupture des MAV ne se limite pas aux troubles cérébraux. Les complications extracérébrales sont tout aussi dangereuses. Il s'agit tout d'abord du syndrome cérébrocardique, qui, à l'électrocardiogramme, peut simuler une insuffisance coronarienne aiguë.
Les patients atteints d'hémorragies intracérébrales développent rapidement une pneumonie et une insuffisance respiratoire. De plus, la flore bactérienne joue un rôle secondaire. L'effet principal est une atteinte pulmonaire centrale, caractérisée par un bronchospasme généralisé, une production accrue d'expectorations et de mucus, une ischémie du parenchyme pulmonaire due à un spasme généralisé des petites artères pulmonaires, ce qui entraîne rapidement des troubles dystrophiques, une desquamation de l'épithélium alvéolaire et une diminution des échanges gazeux pulmonaires.
Si cela s'accompagne d'une suppression du réflexe de toux et d'une insuffisance respiratoire bulbaire, le pronostic vital du patient est sérieusement menacé. Dans la plupart des cas, la trachyobronchite purulente qui en résulte est difficilement traitée par un traitement antibactérien et aggrave l'insuffisance respiratoire, ce qui entraîne immédiatement une augmentation de l'hypoxie cérébrale. Ainsi, une altération de la respiration externe, même avec une compensation relative des troubles cérébraux, peut être fatale. Souvent, les patients après un coma reprennent conscience, mais décèdent ensuite d'une insuffisance respiratoire croissante et d'un œdème cérébral hypoxique.
Les changements dystrophiques se développent rapidement non seulement dans les poumons, mais aussi dans le foie, le tube digestif, les glandes surrénales et les reins. Les infections urinaires et les escarres, qui se développent rapidement en l'absence de soins appropriés, menacent la vie du patient. Mais ces complications peuvent être évitées si les médecins les prennent en compte et savent comment les traiter.
En résumant l'étude de la pathogénèse de la rupture des MAV, il convient de souligner que la mortalité liée à ces hémorragies intracrâniennes est inférieure à celle des ruptures d'anévrismes artériels et des accidents vasculaires cérébraux hémorragiques hypertensifs, bien qu'elle atteigne 12 à 15 %. Les MAV se caractérisent par des hémorragies répétées, parfois multiples, dont la périodicité est variable et imprévisible. En cas d'évolution défavorable de la période post-hémorragique, les mécanismes pathogéniques mentionnés peuvent entraîner une issue fatale.
Symptômes malformation artérioveineuse
Forme hémorragique de la maladie (50 à 70 % des cas). Ce type se caractérise par la présence d'hypertension artérielle, la petite taille du ganglion malformatif et son drainage dans les veines profondes. Une malformation artérioveineuse de la fosse crânienne postérieure est assez fréquente.
Dans 50 % des cas, le type hémorragique est le premier symptôme d'une malformation artérioveineuse. Il entraîne des complications chez 10 à 15 % des patients et une invalidité chez 20 à 30 % des patients (N. Martin et al.). Le risque annuel d'hémorragie chez les patients atteints de malformation artérioveineuse est de 1,5 à 3 %. Le risque d'hémorragie répétée au cours de la première année atteint 8 % et augmente avec l'âge. Les saignements dus à une malformation artérioveineuse sont responsables de 5 à 12 % de la mortalité maternelle et de 23 % des hémorragies intracrâniennes chez la femme enceinte. Une hémorragie sous-arachnoïdienne est observée chez 52 % des patients. Des formes compliquées d'hémorragie surviennent chez 17 % des patients: formation d'hématomes intracérébraux (38 %), sous-duraux (2 %) et mixtes (13 %), et une hémotamponnade ventriculaire se développe chez 47 % des patients.
L'évolution torpide est typique des patients présentant de volumineuses malformations artérioveineuses localisées dans le cortex. L'apport sanguin à la malformation artérioveineuse est assuré par des branches de l'artère cérébrale moyenne.
Les symptômes les plus caractéristiques du type torpide sont le syndrome convulsif (chez 26 à 27 % des patients atteints de malformation artérioveineuse), les céphalées en grappe et le déficit neurologique progressif, comme dans les tumeurs cérébrales.
Variantes des manifestations cliniques des malformations artérioveineuses
Comme mentionné précédemment, la première manifestation clinique la plus fréquente d'une MAV est une hémorragie intracrânienne spontanée (40 à 60 % des patients). Elle survient souvent sans aucun signe précurseur, en pleine santé. Les facteurs déclenchants peuvent être un effort physique, une situation stressante, une tension neuropsychique, la consommation de fortes doses d'alcool, etc. Au moment de la rupture d'une MAV, les patients ressentent un mal de tête soudain et aigu, semblable à un coup ou à une rupture. La douleur s'intensifie rapidement, provoquant des étourdissements, des nausées et des vomissements.

Une perte de connaissance peut survenir en quelques minutes. Dans de rares cas, les céphalées peuvent être légères; les patients ne perdent pas connaissance, mais ressentent un affaiblissement et un engourdissement des membres (généralement controlatéral à l'hémorragie) et des troubles de la parole. Dans 15 % des cas, l'hémorragie se manifeste par une crise d'épilepsie complète, après laquelle les patients peuvent rester dans un état comateux.
Pour déterminer la gravité d'une hémorragie due à une MAV, l'échelle Hunt-Hess présentée ci-dessus peut être utilisée comme base, avec quelques ajustements. Les hémorragies dues à une MAV pouvant présenter des symptômes très différents, les symptômes neurologiques focaux peuvent prévaloir sur les symptômes cérébraux généraux. Par conséquent, les patients dont le niveau de conscience est de niveau I ou II de l'échelle peuvent présenter des troubles neurologiques focaux graves (hémiparésie, hémihypoesthésie, aphasie, hémianopsie). Contrairement aux hémorragies anévrismales, la rupture d'une MAV n'est pas déterminée par la gravité et la prévalence de l'angiospasme, mais par le volume et la localisation de l'hématome intracérébral.
Le syndrome méningé se développe après quelques heures et sa gravité peut varier. La pression artérielle augmente généralement, mais moins brutalement et moins longtemps qu'en cas de rupture d'anévrisme artériel. Habituellement, cette augmentation ne dépasse pas 30 à 40 mm Hg. Le deuxième ou le troisième jour, une hyperthermie d'origine centrale apparaît. L'état des patients s'aggrave naturellement avec l'augmentation de l'œdème cérébral et l'intensification de la dégradation du sang. Cette situation persiste jusqu'à 4 à 5 jours. En cas d'évolution favorable, après stabilisation au 6e ou 8e jour, l'état des patients commence à s'améliorer. La dynamique des symptômes focaux dépend de la localisation et de la taille de l'hématome.
En cas d'hémorragie dans des zones cérébrales fonctionnellement importantes ou de destruction de conducteurs moteurs, les symptômes de perte apparaissent immédiatement et persistent longtemps sans évolution. Si les symptômes de perte n'apparaissent pas immédiatement, mais s'aggravent parallèlement à l'œdème cérébral, on peut s'attendre à une restauration du déficit en 2 à 3 semaines, lorsque l'œdème régresse complètement.
Le tableau clinique d'une rupture de MAV est assez diversifié et dépend de nombreux facteurs, les principaux étant: le volume et la localisation de l'hémorragie, la gravité de la réaction d'œdème cérébral et le degré d'implication des structures du tronc cérébral dans le processus.
Les malformations artérioveineuses peuvent se manifester par des crises d'épilepsie (30 à 40 %). Leur développement peut être dû à des troubles hémocirculatoires dans les zones cérébrales adjacentes, dus au phénomène de vol. De plus, la malformation elle-même peut irriter le cortex cérébral, générant des décharges épileptiques. Nous avons déjà évoqué certains types de MAV, autour desquels se développe une gliose du tissu cérébral, souvent également manifestée par des crises d'épilepsie.
Un syndrome épileptique causé par la présence d'une MAV se caractérise par sa survenue sans cause à l'âge adulte, souvent en l'absence totale de facteur déclenchant. Les crises peuvent être généralisées ou focales. La présence d'une composante focale claire dans une crise d'épilepsie, en l'absence de symptômes cérébraux généraux, doit faire évoquer une possible MAV. Même les crises généralisées, si elles débutent par des convulsions touchant principalement les mêmes membres, avec une rotation forcée de la tête et des yeux d'un côté ou de l'autre, sont souvent une manifestation d'une MAV. Plus rarement, les patients présentent des crises mineures telles que des absences ou des pertes de conscience crépusculaires. La fréquence et la périodicité des crises d'épilepsie peuvent varier: isolées ou récurrentes.
Formes
VV Lebedev et ses co-auteurs ont identifié trois variantes du syndrome cérébrocardique sur la base des données ECG:
- Type I - violation des fonctions d'automatisme et d'excitabilité (tachycardie sinusale ou bradycardie, arythmie, fibrillation auriculaire);
- Type II - modifications des processus de repolarisation, modifications transitoires de la phase finale du complexe ventriculaire selon le type d'ischémie, lésions myocardiques avec modifications de l'onde T et de la position du segment ST;
- Type III – trouble de la conduction (bloc, signes d'augmentation de la charge sur le cœur droit). Ces modifications de l'ECG peuvent être combinées et leur gravité est corrélée à la gravité de l'état général des patients.
Complications et conséquences
Une malformation artérioveineuse (MAV) est une anomalie vasculaire congénitale dans laquelle les artères et les veines sont connectées sans couche capillaire intermédiaire. Les complications et les conséquences des MAV peuvent être graves et dépendent de la taille, de la localisation et des caractéristiques de la malformation. En voici quelques exemples:
- Accident vasculaire cérébral (AVC): L’une des complications les plus graves des MAV est le risque d’AVC. Les malformations peuvent créer des voies anormales de circulation sanguine, ce qui peut entraîner une hémorragie cérébrale et provoquer un AVC. L’AVC peut avoir des degrés de gravité variables et laisser des déficits neurologiques résiduels.
- Épilepsie: les MAV peuvent provoquer des crises d’épilepsie chez certains patients, notamment si la malformation est localisée dans certaines zones du cerveau.
- Hémorragie: Les malformations peuvent être imprévisibles et provoquer des saignements cérébraux. Cela peut constituer une complication potentiellement mortelle et entraîner de graves conséquences.
- Hydrocéphalie: si la MAV est située près des ventricules du cerveau, elle peut provoquer une hydrocéphalie, ce qui peut entraîner une accumulation de liquide supplémentaire dans le cerveau et une augmentation de la pression intracrânienne.
- Déficits neurologiques: une MAV peut endommager les tissus cérébraux environnants et provoquer divers déficits neurologiques, notamment une paralysie, des troubles sensoriels et des déficits de la parole et de la coordination motrice.
- Douleur et maux de tête: les patients atteints de MAV peuvent ressentir des douleurs chroniques et des maux de tête liés à la malformation.
- Effets psychologiques: Les complications des MAV peuvent avoir un impact significatif sur le bien-être psychologique des patients, notamment l’anxiété, la dépression et le stress.
- Restrictions de style de vie: une fois qu'une MAV est détectée, les patients peuvent avoir besoin de changements de style de vie et de recommandations de gestion des risques, notamment la limitation de l'activité physique et de certaines activités.
Diagnostics malformation artérioveineuse
Le diagnostic d'une malformation artérioveineuse (MAV) repose généralement sur divers examens d'imagerie pour confirmer la présence et évaluer les caractéristiques de la malformation. Les principales méthodes utilisées pour diagnostiquer une MAV sont:
- Angiographie par résonance magnétique (ARM): L'ARM est l'une des principales méthodes de diagnostic des MAV. Il s'agit d'un examen non invasif qui visualise la structure des vaisseaux sanguins et le flux sanguin dans le cerveau à l'aide de champs magnétiques et d'ondes radio. L'ARM permet de déterminer l'emplacement, la taille et la forme de la MAV.
- Angiographie par soustraction numérique (DSA): Il s'agit d'une procédure plus invasive qui consiste à injecter un agent de contraste directement dans les vaisseaux par un cathéter et à utiliser des rayons X pour produire des images de haute qualité des vaisseaux cérébraux. L'DSA permet un examen plus détaillé de la structure de la MAV et des schémas de circulation sanguine.
- Tomodensitométrie (TDM): La TDM permet de détecter les MAV et d'évaluer d'éventuelles complications, comme les saignements. Si nécessaire, un produit de contraste peut être utilisé pour améliorer la visualisation.
- Échographie duplex vasculaire (Doppler): cette technique peut être utile pour examiner les vaisseaux du cou et de la tête et identifier les troubles du flux sanguin associés aux MAV.
- Spectroscopie par résonance magnétique (SRM): la SRM peut fournir des informations sur la composition chimique des tissus dans la zone de la MAV et révéler des signes de changements métaboliques.
- Échoencéphalographie: Il s’agit d’un examen échographique qui peut être utilisé pour évaluer le flux sanguin et la structure du cerveau.
- Angiographie par tomodensitométrie (CTA): la CTA combine la TDM et l'angiographie pour produire des images tridimensionnelles des vaisseaux sanguins du cerveau.
Une fois le diagnostic posé, il est important de procéder à une évaluation détaillée des caractéristiques de la malformation, telles que sa taille, sa forme et sa gravité. Cela permettra de déterminer si un traitement est nécessaire et la meilleure option thérapeutique, notamment l'ablation chirurgicale, l'embolisation, la radiothérapie ou l'observation. La décision de traiter une MAV doit être prise en collaboration avec le patient et l'équipe soignante, en tenant compte des circonstances particulières de chaque cas.
Diagnostic différentiel
Le diagnostic différentiel des malformations artérioveineuses (MAV) peut constituer une étape importante dans l'évaluation d'un patient présentant des modifications vasculaires cérébrales. Les MAV sont des anomalies vasculaires où les artères et les veines sont connectées sans couche capillaire intermédiaire. Elles peuvent provoquer divers symptômes et affections, et il est important de les différencier d'autres troubles vasculaires pour un traitement adapté. Parmi les affections pouvant nécessiter un diagnostic différentiel avec les MAV, on peut citer:
- Accident vasculaire cérébral (AVC): Les AVC peuvent imiter les symptômes d'une MAV, surtout s'ils sont causés par des modifications vasculaires. La distinction peut nécessiter une tomodensitométrie (TDM) ou une imagerie par résonance magnétique (IRM) du cerveau pour visualiser les modifications vasculaires.
- Hématome: Les hématomes, comme les hématomes sous-duraux ou épiduraux, peuvent imiter les symptômes d'une MAV, surtout s'ils s'accompagnent de céphalées et de symptômes neurologiques. Un scanner ou une IRM peuvent aider à déterminer la cause de ces symptômes.
- Tumeurs cérébrales: Les tumeurs cérébrales peuvent provoquer divers symptômes pouvant être similaires à ceux d'une MAV. Le diagnostic peut inclure une IRM avec produit de contraste et d'autres examens d'imagerie.
- Migraine: Les migraines avec aura peuvent imiter les symptômes d'une malformation artérioveineuse, tels que des troubles visuels et des étourdissements. L'anamnèse et des examens complémentaires peuvent aider à les différencier.
- Vascularite cérébrale: La vascularite peut provoquer une inflammation des vaisseaux sanguins et des anomalies vasculaires pouvant imiter les symptômes d'une malformation artérioveineuse. Une biopsie ou une angiographie peuvent être utilisées pour diagnostiquer la vascularite.
- Thrombose veineuse: Les thromboses veineuses peuvent simuler les symptômes d'une MAV, notamment en cas de perturbation du flux veineux cérébral. Des examens complémentaires peuvent aider à identifier une thrombose.
Pour un diagnostic différentiel précis des MAV, l'investigation comprend un examen clinique approfondi, des méthodes neuroéducatives (TDM, IRM, angiographie), parfois une biopsie et d'autres procédures spécialisées en fonction des symptômes et des circonstances spécifiques.
Qui contacter?
Traitement malformation artérioveineuse
Le traitement d'une malformation artérioveineuse (MAV) dépend de sa taille, de sa localisation, de ses symptômes et des complications potentielles. Dans certains cas, une MAV peut être petite et asymptomatique, et ne nécessiter aucun traitement actif. Cependant, en cas de symptômes ou de risque hémorragique, un traitement peut s'avérer nécessaire. Voici quelques traitements possibles:
- Chirurgie: L’ablation chirurgicale de la MAV peut être envisagée lorsque la malformation est accessible et peu complexe. Elle permet de prévenir le risque de saignement et de réduire les symptômes. Il s’agit d’une intervention complexe qui peut comporter des risques tels que des lésions des tissus et des nerfs environnants.
Interventions ouvertes (transcrâniennes):
- Stade I - coagulation des afférences;
- Stade II - isolement du noyau de la malformation artérioveineuse;
- Stade III - ligature et coagulation de l'efférence et ablation de la malformation artérioveineuse,
Interventions endovasculaires:
- occlusion par ballonnet stationnaire des artères nourricières - embolisation en flux (non contrôlée);
- combinaison d'occlusion temporaire ou permanente par ballonnet avec embolisation en flux;
- embolisation supersélective.
Les malformations artérioveineuses sont également traitées par radiochirurgie (Gamma-knife, Cyber-knife, Li nac, etc.).
- Embolisation: L’embolisation est une procédure qui consiste à insérer du matériel médical ou de la colle dans les vaisseaux sanguins afin de bloquer le flux sanguin vers la MAV. L’embolisation peut être utilisée comme étape préparatoire à une intervention chirurgicale ou comme traitement autonome. Elle peut contribuer à réduire le saignement et la taille de la MAV.
- Radiothérapie: La radiothérapie peut être utilisée pour traiter les MAV, notamment lorsque d'autres traitements sont trop risqués. Elle vise à réduire le saignement de la MAV et peut nécessiter plusieurs séances.
- Médicaments: Dans certains cas, des médicaments peuvent être utilisés pour atténuer les symptômes tels que la douleur ou les crampes. Ils peuvent également être utilisés pour contrôler la tension artérielle et réduire le risque de saignement.
- Observation et gestion des symptômes: Dans certaines situations, en particulier si la MAV est petite et ne provoque pas de symptômes, une décision peut être prise de simplement observer la maladie et de gérer les symptômes si nécessaire.
Le traitement des MAV doit être individualisé pour chaque patient, et le choix de la méthode dépend des circonstances particulières. Il est important de discuter de toutes les options thérapeutiques avec un professionnel de santé et de procéder à une évaluation approfondie du patient afin de déterminer le plan de traitement le plus adapté. Les résultats du traitement peuvent être positifs et les patients peuvent obtenir une amélioration ou une guérison complète, mais chaque cas est unique.
Prévoir
Le pronostic d'une malformation artérioveineuse (MAV) dépend de plusieurs facteurs, notamment sa taille, sa localisation, ses symptômes, l'âge du patient et la réussite du traitement. Il est important de rappeler qu'une MAV est une affection médicale qui peut se manifester différemment selon les patients et que le pronostic peut varier d'une personne à l'autre. Voici quelques aspects généraux du pronostic d'une MAV:
- Risque hémorragique: Le principal risque d'une MAV est le risque de saignement (hémorragie) cérébral. Les MAV de petite taille présentant un faible risque hémorragique peuvent avoir un bon pronostic et ne pas entraîner de problèmes graves. En revanche, les MAV de grande et moyenne taille peuvent présenter un risque important.
- Symptômes: Les symptômes associés à une MAV, tels que maux de tête, convulsions, paralysie ou troubles sensoriels, peuvent influencer le pronostic. Dans certains cas, un traitement efficace peut améliorer ou faire disparaître les symptômes.
- Taille et localisation: Les MAV situées dans des zones plus dangereuses, comme les profondeurs cérébrales ou à proximité de structures critiques, peuvent avoir un pronostic plus sombre. Cependant, même de grandes MAV peuvent être traitées avec succès.
- Traitement: Le traitement des MAV peut inclure l'ablation chirurgicale, l'embolisation, la radiothérapie ou la prise de médicaments. Un traitement efficace peut réduire le risque de saignement et améliorer le pronostic.
- Âge: L’âge du patient peut également influencer le pronostic. Les enfants et les jeunes adultes ont souvent un meilleur pronostic que les patients plus âgés.
- Comorbidités: La présence d’autres pathologies ou facteurs de risque, tels que l’hypertension artérielle ou des troubles de la coagulation, peut affecter le pronostic et le traitement de la MAV.
Il est important de noter que la MAV nécessite une surveillance médicale et un traitement attentifs. La décision concernant le traitement et le pronostic doit être prise par des neurochirurgiens et des neuroradiologues qualifiés, sur la base d'une évaluation approfondie de chaque cas.

