Expert médical de l'article
Nouvelles publications
Glioma ng utak
Last reviewed: 29.06.2025

Tout le contenu iLive fait l'objet d'un examen médical ou d'une vérification des faits pour assurer autant que possible l'exactitude factuelle.
Nous appliquons des directives strictes en matière d’approvisionnement et ne proposons que des liens vers des sites de médias réputés, des instituts de recherche universitaires et, dans la mesure du possible, des études évaluées par des pairs sur le plan médical. Notez que les nombres entre parenthèses ([1], [2], etc.) sont des liens cliquables vers ces études.
Si vous estimez qu'un contenu quelconque de notre contenu est inexact, obsolète ou discutable, veuillez le sélectionner et appuyer sur Ctrl + Entrée.
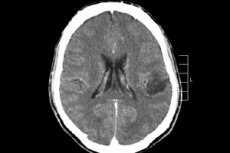
Parmi les nombreux processus tumoraux du système nerveux central, le gliome cérébral est le plus souvent diagnostiqué. Ce terme est générique: ce néoplasme regroupe des foyers diffus oligodendrogliaux et astrocytaires, astrocytome, astroblastome, etc. Cette tumeur peut avoir différents degrés de malignité et se forme à partir de structures gliales (cellules localisées autour des neurones). Les gliomes se localisent principalement dans les hémisphères cérébraux, les parois des ventricules cérébraux et le chiasma (zone d'intersection partielle des fibres du nerf optique). À l'extérieur, la tumeur se présente sous la forme d'un nodule de teinte rosâtre ou rougeâtre, de forme ronde ou fusiforme, aux limites floues. [ 1 ]
Épidémiologie
Dans environ 5 % des cas, les gliomes sont associés à des pathologies héréditaires, notamment la neurofibromatose et d'autres syndromes à transmission dominante. Les experts soulignent que la grande majorité des gliomes cérébraux se développent de manière sporadique, c'est-à-dire sans cause évidente.
Globalement, les néoplasies primaires du système nerveux central représentent environ 2 % de l'ensemble des tumeurs, soit un peu plus de 21 cas pour 100 000 habitants. Parmi elles, les gliomes surviennent dans 35 à 36 % des cas, et plus de 15 % d'entre eux sont des glioblastomes.
Selon certaines données, le gliome touche plus souvent les hommes que les femmes - la tumeur est particulièrement fréquente chez les personnes de plus de 50 ans.
L'incidence mondiale des gliomes chez les personnes âgées a considérablement augmenté au cours des dernières décennies. Les raisons de ce phénomène ne sont pas encore établies.
Selon la définition de l'Organisation mondiale de la santé, trois principales variantes de tumeurs gliales, différant par leurs caractéristiques histologiques, ont été identifiées: les oligodendrogliomes, les astrocytomes et les oligoastrocytomes combinés. L'incidence de chaque sous-type de pathologie de faible malignité n'a pas été déterminée de manière fiable. Certaines études indiquent une augmentation de l'incidence des oligodendrogliomes de 5 % à 30 % et une diminution de l'incidence des astrocytomes.
Les tumeurs gliales sont capables d’infiltrer le tissu cérébral et la grande majorité des foyers de bas grade deviennent malins en quelques années. [ 2 ]
Causes ng mga glioma ng utak
Les gliomes cérébraux regroupent un ensemble de processus tumoraux dont la caractéristique commune est leur formation à partir de structures gliales du système nerveux central (SNC) situées dans le tissu cérébral. Ces tumeurs se divisent en deux variantes histopathologiques: les gliomes hautement malins et les gliomes faiblement malins.
La source de la formation de la croissance est constituée par les cellules de la névroglie (astrocytes, oligodendrocytes), qui fournissent la base structurelle et la viabilité des neurones cérébraux.
Les processus tumoraux gliales diffèrent considérablement par leur structure, leurs mutations génétiques, leur agressivité, leurs caractéristiques cliniques, leurs caractéristiques diagnostiques, leur réponse au traitement et leur pronostic. Les néoplasmes embryonnaires et épendymaires du système nerveux central, en particulier les médulloblastomes et les épendymomes, diffèrent par leur structure histologique, mais sont similaires en termes de traitement.
Les éléments gliaux ont été classés pour la première fois comme une catégorie structurelle distincte du système nerveux à la fin du XIXe siècle.
Le tissu névroglique est constitué de cellules aux fonctions auxiliaires: trophiques, de soutien, protectrices et sécrétoires. Neurones et gliocytes cohabitent; ils forment ensemble le système nerveux et jouent un rôle essentiel dans les processus vitaux de l'organisme.
Les gliocytes sont grossièrement classés en plusieurs formes principales: astrocytes, oligodendrocytes, cellules épendymaires et microglie.
À ce jour, les scientifiques ne peuvent pas répondre à la question des causes fiables de la formation de tumeurs neurogliales. On suppose que les effets de la radioactivité, les maladies infectieuses et les intoxications (notamment chimiques et professionnelles) y contribuent négativement. Le facteur héréditaire joue également un rôle important.
Les gliomes cérébraux se développent à partir de neurogliocytes anormaux présentant un défaut génétique entraînant une croissance et une fonctionnalité anormales; ces structures sont dites « immatures ». Les cellules incomplètes sont le plus souvent localisées dans une zone, là où la tumeur s'est formée.
En termes simples, la formation gliale résulte de la croissance chaotique et sporadique de cellules névroglies modifiées. Ce processus peut se développer à partir d'épendymocytes, d'oligodendrocytes et d'astrocytes (astrocytomes, notamment à cellules géantes et anaplasiques). [ 3 ]
Facteurs de risque
Bien que les experts ne puissent pas caractériser avec précision les causes de la formation des oncopathologies gliales, dans certains cas, leur apparition peut être évitée en éliminant les principaux facteurs de risque:
- L'exposition aux rayonnements ionisants a une activité cancérigène et peut entraîner le développement de leucémies et la formation de cancers à structure dense, y compris chez les jeunes. Les interventions médicales radiologiques fréquentes et non raisonnables, ainsi que les rayonnements ultraviolets (y compris les solariums), sont également des facteurs potentiellement cancérigènes et peuvent provoquer l'apparition de tumeurs dans divers organes, dont le cerveau.
- Les effets indésirables professionnels et les intoxications ont souvent un lien de causalité avec le développement de tumeurs cancéreuses. La production de caoutchouc et de verre, de pesticides et de carburants, de métaux et de textiles, de peintures et de réactifs de laboratoire est considérée comme particulièrement dangereuse. Sont également à risque les travailleurs des industries aérospatiale, charbonnière et métallurgique, des usines de fabrication de produits chimiques et de sous-produits, des matériaux de construction et des électrodes, des carburants et lubrifiants, des plastiques et des monomères.
- La pollution de l'air, de l'eau et des sols est responsable de près de 4 % des cancers dans le monde. Les substances cancérigènes, présentes en grande quantité dans l'environnement, pénètrent dans l'organisme par l'air inhalé, l'eau potable et les aliments. Vivre dans des zones écologiquement dangereuses – à proximité de grandes installations industrielles ou d'axes de transport très fréquentés – est considéré comme particulièrement dangereux.
- Les pathologies infectieuses, notamment les infections virales, peuvent également créer des conditions favorables au développement de tumeurs. Il est important d'en tenir compte et de se faire vacciner à l'avance, ainsi que de prévenir les maladies infectieuses et parasitaires.
- L’intoxication au tabac et à l’alcool est considérée comme un facteur de risque pour de nombreuses variétés de cancer, et pas seulement pour les gliomes cérébraux.
- Activité physique insuffisante, surpoids, mauvaise alimentation, troubles métaboliques, traumatismes crâniens, pathologies vasculaires - des facteurs de stress supplémentaires qui peuvent provoquer l'apparition de troubles intracellulaires.
- L'âge avancé est la période la plus courante pour le développement de néoplasmes dans le corps, c'est pourquoi les personnes de plus de 55 ans doivent prendre particulièrement soin de leur propre santé.
Cependant, le facteur de risque principal et le plus significatif du développement du gliome reste la prédisposition héréditaire.
Pathogénèse
À ce jour, les experts émettent plusieurs hypothèses concernant le développement des gliomes cérébraux. Chaque théorie a ses propres fondements, mais le seul mécanisme pathogénique correct et fiable n'a pas encore été identifié par les scientifiques. Dans la plupart des cas, les facteurs suivants sont impliqués dans le développement des néoplasmes:
Échec de l'embryogenèse, qui consiste en la perturbation de la ponte des organes et la formation de « mauvaises » structures cellulaires;
- Exposition aux rayons ionisants, cancérigènes potentiels sous forme d’agents chimiques, d’additifs alimentaires, etc.
- Traumatisme crânien;
- Maladies génétiques transmises de génération en génération (gliome « familial »);
- Dysfonctionnement immunitaire, neuroinfections.
La plupart des gliomes ont une croissance diffuse, avec pénétration dans le tissu cérébral normal environnant. Selon le degré de malignité, la tumeur peut se développer pendant plusieurs années sans aucune manifestation. En cas d'évolution agressive, la symptomatologie s'aggrave rapidement sur plusieurs mois.
Une partie de la tumorigenèse est due à des changements dysembryogénétiques.
Le tronc cérébral peut être affecté à différents niveaux: le gliome diffus du tronc cérébral, quant à lui, diffère tant sur le plan anatomo-morphologique que clinique. Certaines de ces tumeurs, notamment le gliome de la plaque tétraplégique, peuvent être relativement bénignes, sans signe de progression. Le gliome pontique, quant à lui, se caractérise par sa malignité particulière, son agressivité et son pronostic défavorable.
Lésions diffuses des structures cérébrales, dans lesquelles plus de trois zones anatomiques des grands hémisphères sont impliquées dans le processus pathologique, avec une possible divergence périventriculaire et un passage à travers le corps, appelées gliomatose. [ 4 ]
Le gliome cérébral est-il héréditaire?
Un risque bien établi de formation de gliome cérébral est héréditaire, c'est-à-dire la présence de tumeurs intracérébrales similaires ou différentes chez des ancêtres directs ou au sein de la même génération. L'exposition aux radiations et le contact régulier ou prolongé avec des cancérogènes potentiels aggravent la situation.
Les gliomes peuvent être héréditaires, mais il peut également s'agir de maladies s'accompagnant d'une croissance tumorale accrue, quelle que soit la localisation, comme la neurofibromatose de type 1 et 2, le syndrome de Li-Fraumeni ou le syndrome de Hippel-Lindau. Des modifications de certains gènes ou chromosomes sont souvent détectées dans les cellules des gliomes.
Les principales pathologies associées au développement du gliome chez l’homme sont résumées dans le tableau:
Pathologie |
Chromosome |
Gène |
Variété de néoplasmes |
Syndrome de Li-Fraumeni |
17r13 |
TR53 |
Néoplasmes neuroectodermiques, astrocytome. |
Neurofibromatose |
17q11 |
NF1 |
Gliome du nerf optique, astrocytome pilocytique, neurofibromatose |
Syndrome de Turcotte |
3p21, 7p22 |
HMLH1, HPSM2 |
Astrocytome |
Sclérose tubéreuse (syndrome de Burneville). |
9q34, 16p13 |
TSC1, TSC2 |
Astrocytome sous-épendymaire gigantocellulaire |
Quelle que soit la nature de la tumeur gliale, qu'il s'agisse d'un cas sporadique ou d'une pathologie héréditaire, il s'agit d'une maladie caractérisée par l'expression d'un gène pathologiquement altéré. Hormis les néoplasmes résultant d'effets d'apprentissage, dans d'autres situations, les causes des altérations génétiques restent obscures.
Symptômes ng mga glioma ng utak
Les caractéristiques de la symptomatologie focale dépendent directement de la zone de localisation du gliome cérébral et deviennent la conséquence de toutes sortes de troubles endocriniens, de compression du tissu nerveux ou de processus destructeurs locaux.
Si le néoplasme est situé dans la zone pariétale, la personne est alors dominée par des manifestations telles que des convulsions, des troubles sensoriels, une déficience auditive.
Lorsque le gliome est localisé dans la zone de l'hémisphère dominant, des troubles de la parole, une agraphie, une agnosie sont détectés.
Les néoplasmes du lobe temporal s'accompagnent souvent de crises convulsives, d'aphasie, d'altération de l'odorat et de la fonction visuelle, ainsi que de dyspnée.
Lorsque la pression intracrânienne augmente, une image correspondante se développe avec une restriction des champs visuels, une paralysie des muscles oculaires et une hémiplégie.
En raison de la spécificité du processus tumoral, le gliome cérébral s'accompagne toujours de symptômes neurologiques plus ou moins importants. Au début, on observe une faiblesse générale notable, le patient a constamment envie de dormir, sa capacité de travail est altérée et ses processus de pensée sont ralentis. C'est à ce stade que le risque d'un diagnostic erroné et, par conséquent, d'une prescription inadaptée du traitement est élevé. Parmi les autres manifestations non spécifiques:
- Troubles vestibulaires, notamment démarche instable, perte d’équilibre (par exemple, en faisant du vélo ou en montant des escaliers), engourdissement des membres, etc.
- Détérioration progressive de la vision, dédoublement de l’image visuelle;
- Détérioration de la fonction auditive;
- Troubles de l'élocution;
- Nausées et vomissements sous forme de crises indépendantes de la nourriture ou de la boisson;
- Affaiblissement des muscles mimiques et des autres muscles du visage;
- Gêne lors de la déglutition;
- Maux de tête réguliers (souvent le matin).
Le tableau clinique s'étend et s'aggrave progressivement: chez certains patients, il apparaît lentement, chez d'autres, brutalement, littéralement « sous nos yeux », en quelques semaines. Dans ce dernier cas, on parle d'un gliome cérébral agressif à évolution rapide.
Premiers signes
Aux premiers stades de développement, le gliome cérébral ne présente pas de symptômes prononcés. Les premières manifestations sont souvent confondues avec celles d'autres pathologies moins dangereuses.
En général, le tableau clinique du gliome est varié et déterminé par la localisation et la taille du foyer pathologique. À mesure que la tumeur se développe, des symptômes cérébraux généraux apparaissent et s'aggravent:
- Maux de tête persistants et réguliers qui ne répondent pas aux médicaments standards (anti-inflammatoires non stéroïdiens);
- Nausées intermittentes, allant parfois jusqu’aux vomissements;
- Une sensation inconfortable et lourde dans la région du globe oculaire;
- Crises d'épilepsie.
Les manifestations cérébrales sont particulièrement intenses lorsque la tumeur se développe dans les ventricules ou le système digestif. Le drainage du liquide céphalorachidien est altéré, la pression intracrânienne augmente et une hydrocéphalie se développe. Ce processus affecte une zone spécifique du cerveau, ce qui influence le développement clinique correspondant:
- Il y a des problèmes de fonction visuelle;
- Troubles de la parole;
- Des troubles vestibulaires (vertiges, troubles de la coordination des mouvements) surviennent;
- Parésie, paralysie des bras, des jambes;
- La mémoire et la concentration sont altérées;
- Les processus de pensée sont altérés;
- Des troubles du comportement apparaissent.
Au stade initial, les symptômes sont pratiquement absents, ou si insignifiants qu'ils passent inaperçus. C'est pourquoi les experts recommandent vivement des examens préventifs et des bilans de santé réguliers. En effet, plus le processus tumoral est détecté tôt, plus les chances de guérison et de survie sont élevées. [ 5 ]
Gliome du cerveau chez un enfant
Parmi les nombreuses tumeurs cérébrales observées chez l'enfant, le pourcentage de gliomes varie de 15 à 25 %. Les enfants peuvent être atteints de la maladie au début de l'adolescence et au début de la vingtaine, bien qu'il soit très rare que les bébés de moins de 3 ans en soient atteints.
La pathologie débute par une mutation des cellules gliales. À ce jour, la cause de cette mutation reste inexpliquée.
La seule chose qui a été apprise de manière fiable est que certaines maladies héréditaires associées à un risque accru de croissance tumorale augmentent également la probabilité de développer un gliome cérébral.
De plus, les scientifiques ont découvert que les cellules gliales peuvent présenter une divergence au niveau de certains gènes ou chromosomes. Ce trouble déclenche un mécanisme de mutation, non héréditaire. Il est possible que ce phénomène se produise à l'un des premiers stades du développement.
Il est prouvé que la présence d'une leucémie aiguë ou d'un rétinoblastome dans l'histoire de l'enfant, ou une irradiation cérébrale pour toute autre raison, augmente considérablement les risques de formation de gliome (après un certain laps de temps).
La symptomatologie infantile dépend du degré de malignité et de la localisation du foyer pathologique. On distingue les symptômes spécifiques des symptômes non spécifiques:
- Les symptômes non spécifiques ne sont pas liés à la zone où se trouve le gliome. Les manifestations courantes peuvent inclure des maux de tête, des étourdissements, un manque d'appétit, des vomissements sans rapport avec la prise alimentaire, une perte de poids (pour des raisons inconnues), une sensation de fatigue constante, une baisse des résultats scolaires, des difficultés de concentration et des troubles du comportement. Ces signes sont dus à la compression des structures intracrâniennes, qui peut s'expliquer par une pression directe exercée par la masse en croissance, et à un trouble de la circulation du liquide céphalorachidien. Il existe un risque d'hydrocèle cérébrale.
- La symptomatologie spécifique dépend de la localisation immédiate du foyer pathologique glial. Par exemple, une tumeur cérébelleuse s'accompagne généralement de troubles de la marche et de l'équilibre chez l'enfant. La lésion du gros cerveau se manifeste par des crises convulsives et la croissance tumorale dans la moelle épinière entraîne une paralysie musculaire. Il arrive que la vision du bébé se détériore fortement, que sa conscience soit perturbée, que son sommeil soit perturbé ou que d'autres troubles du développement surviennent.
En règle générale, dans l'enfance, le gliome malin se révèle en quelques semaines ou quelques mois de son développement: il est souvent caractérisé par une croissance rapide et incontrôlée du néoplasme.
Les enfants atteints de tumeurs gliales malignes sont pris en charge par des médecins de centres cliniques pédiatriques spécialisés en oncologie pédiatrique. En règle générale, un traitement chirurgical, une radiothérapie et une chimiothérapie sont utilisés.
L'étape thérapeutique la plus importante est la neurochirurgie. Plus elle est radicale, meilleures sont les chances de guérison de l'enfant. Cependant, l'intervention chirurgicale n'est pas toujours possible: des problèmes peuvent notamment survenir lors de l'ablation des gliomes du tronc cérébral, ainsi que lors de la radiothérapie chez les enfants de moins de 3 ans.
Les gliomes du cerveau central (encéphale intermédiaire et mésencéphale) sont difficiles à retirer complètement, car ils risquent d'endommager les tissus sains. Si la résection complète de la tumeur est impossible, un traitement palliatif est prescrit.
Les enfants atteints de gliomes malins sont traités selon des protocoles standardisés, issus d'essais cliniques rigoureusement contrôlés. Les protocoles les plus courants sont les suivants:
- HIT HGG 2007: concerne le traitement des enfants âgés de 3 à 17 ans.
- HIT SKK: convient aux nourrissons (jusqu'à trois ans) et n'implique pas de traitements de radiothérapie.
Les statistiques de survie pédiatrique pour les gliomes ne sont généralement pas très optimistes. Cependant, il est impossible de prédire à l'avance l'efficacité des mesures thérapeutiques pour un enfant donné. Il est important de suivre scrupuleusement toutes les prescriptions du médecin, ce qui augmente considérablement les chances de guérison.
Formes
Les gliomes peuvent être de faible malignité ou de forte malignité, avec une croissance intense et une propension aux métastases. Il est important de comprendre qu'une faible malignité n'est pas synonyme de sécurité tumorale. Toute tumeur cérébrale crée un volume supplémentaire, comprime les structures cérébrales, ce qui entraîne leur déplacement et une augmentation de la pression intracrânienne. Le patient peut alors mourir.
Il existe deux principaux types d'astrocytomes malins: les glioblastomes et les astrocytomes anaplasiques, subdivisés en fonction des modifications moléculaires. Les tumeurs malignes secondaires, issues d'astrocytomes et présentant un faible degré de malignité, sont le plus souvent observées chez les patients jeunes. Les tumeurs gliales initialement malignes surviennent plus souvent chez les patients âgés.
Selon la localisation structurelle, les gliomes se présentent sous les formes suivantes:
- Supratentorielle (avec localisation au-dessus du cervelet dans la région des ventricules latéraux, grands hémisphères);
- Sous-tentoriel (avec localisation sous le cervelet dans la fosse crânienne postérieure).
Selon les caractéristiques histologiques, on distingue les types de gliomes suivants:
- Le gliome astrocytaire est le plus fréquent. Il se subdivise en gliome nodulaire et gliome diffus (ce dernier pouvant se caractériser par une croissance rapide et une forme d'AVC).
- Oligodendrogliome: il survient chez 5 % des patients. Il présente des pétrifications (zones de calcification), le plus souvent au niveau du lobe frontal.
- Gliome épendymaire – se développe à partir des structures tapissant les parois du canal central de la moelle épinière et des ventricules. Il se développe souvent dans l'épaisseur de la substance cérébrale, ainsi que dans la lumière cérébrale.
Des foyers pathologiques mixtes tels que sous-épendymome, oligoastrocytome, etc. sont également possibles.
Tous les gliomes sont classés selon les stades suivants:
- Néoplasmes relativement bénins à croissance lente sans symptômes cliniques évidents.
- Gliomes « limites » à croissance lente qui se transforment progressivement en stade III et au-delà.
- Gliome malin.
- Gliome malin à croissance et propagation agressives intenses, avec un mauvais pronostic.
Plus le stade de malignité est bas, moins le risque de métastases et de récidive de la tumeur retirée est élevé, et plus les chances de guérison sont élevées. Le glioblastome multiforme, un processus peu différencié à croissance et développement intensifs, représente le plus grand danger. [ 6 ]
Variantes possibles et les plus courantes du neurogliome:
- Le gliome avec lésions du tronc cérébral et du pont se situe dans la zone de connexion entre le cerveau et la moelle épinière. C'est là que se trouvent d'importants neurocentres responsables des fonctions respiratoires, cardiaques et motrices. Si cette zone est endommagée, le fonctionnement des appareils vestibulaire et de la parole est perturbé. Il est souvent détecté dès l'enfance.
- Le gliome visuel affecte les cellules neurogliales qui entourent le nerf optique. Cette pathologie provoque une déficience visuelle et une exophtalmie. Elle se développe plus fréquemment chez l'enfant.
- Le neurogliome malin de faible malignité se caractérise par une croissance lente, localisée plus souvent dans les grands hémisphères et le cervelet. Il survient plus souvent chez les sujets jeunes (adolescents et jeunes adultes vers 20 ans).
- Le gliome du corps calleux est plus caractéristique des individus entre 40 et 60 ans et est le plus souvent représenté par le glioblastome.
- Le gliome du chiasma est localisé dans la zone de la jonction optique; il s'accompagne donc de myopie, de perte du champ visuel, d'hydrocéphalie occlusive et de troubles neuroendocriniens. Il peut survenir à tout âge, mais touche le plus souvent les patients atteints de neurofibromatose de type I.
Complications et conséquences
Gliomes de faible malignité (grade I-II, hautement malins - par exemple, astrocytome, oligoastrocytome, oligodendrogliome, xanthoastrocytome pléomorphe, etc.) et de forte malignité (grade III-IV - glioblastome, oligodendrogliome anaplasique, oligoastrocytome et astrocytome). Les gliomes de grade IV sont particulièrement malins.
Le pronostic du gliome du tronc cérébral est très défavorable, précisément parce que la tumeur affecte cette région du cerveau, où se concentrent les connexions nerveuses les plus importantes entre le cerveau et les membres. Même une petite tumeur dans cette zone peut rapidement aggraver l'état du patient et provoquer une paralysie.
Des conséquences tout aussi néfastes surviennent lorsque d'autres régions du cerveau sont touchées. Il s'agit souvent d'une tumeur du cortex cérébral, qui, malgré le traitement, compromet l'espérance de vie du patient. Il est souvent seulement possible de retarder la mort.
Selon les statistiques médicales, le taux de survie à cinq ans n'est souvent que de 10 à 20 %. Ces chiffres dépendent toutefois largement du degré de malignité, de la localisation exacte et de l'ampleur de l'intervention chirurgicale. Après l'ablation complète du foyer pathologique, le taux de survie augmente considérablement (parfois jusqu'à 50 %). L'absence ou l'impossibilité de traitement (pour une raison ou une autre) entraîne inévitablement le décès du patient.
La majorité des tumeurs gliales de faible malignité sont capables d’infiltrer le tissu cérébral et de se maligner sur plusieurs années.
Le risque de récidive du gliome est considéré par les experts comme « hautement probable ». Néanmoins, le traitement ne doit pas être négligé: il est important de garantir une bonne qualité de vie le plus longtemps possible.
Les gliomes récurrents ont toujours un pronostic plus sombre que les tumeurs primaires. Cependant, les protocoles thérapeutiques modernes, basés sur des études d'optimisation thérapeutique, obtiennent souvent de bons résultats, même chez les patients atteints de tumeurs hautement malignes.
Résultats possibles après la chimiothérapie:
- Émaciation, amaigrissement, troubles digestifs, maladies bucco-dentaires;
- Augmentation de l’excitabilité du système nerveux central, asthénie;
- Détérioration de la fonction auditive, acouphènes et bourdonnements d’oreilles;
- Crises d’épilepsie, troubles dépressifs;
- Crise hypertensive, modification du profil sanguin;
- Insuffisance rénale;
- Processus allergiques, perte de cheveux, apparition de taches pigmentaires sur le corps.
Après la chimiothérapie, les patients constatent un affaiblissement prononcé du système immunitaire, ce qui peut provoquer le développement de diverses pathologies infectieuses.
Diagnostics ng mga glioma ng utak
Un gliome cérébral peut être suspecté par les signes suivants:
- Le patient présente des crises épileptiques localisées ou généralisées, caractéristiques de la localisation corticale de la tumeur et de sa lente évolution. Des crises épileptiques sont observées chez 80 % des patients atteints de tumeurs gliales de bas grade et chez 30 % des patients atteints de gliomes de haut grade.
- L'hypertension intracrânienne est particulièrement caractéristique des masses situées dans les lobes frontal et pariétal droits. Associée à une hypertension intracrânienne, une perturbation de la circulation sanguine et de l'humeur aqueuse entraîne l'apparition de céphalées constantes et croissantes, de nausées avec vomissements, de troubles visuels et de somnolence. On observe également un œdème du nerf optique et une paralysie du nerf optique de dérivation. Une augmentation de la pression intracrânienne à des valeurs critiques peut entraîner le coma et le décès. L'hydrocéphalie est une autre cause d'hypertension intraoculaire.
- Le patient présente une image focale croissante. Dans les formations supratentorielles, les sphères motrices et sensitives sont perturbées, et une hémiopie, une aphasie et des troubles cognitifs progressent.
Si le médecin suspecte une tumeur cérébrale, il est préférable de réaliser une IRM avec ou sans produit de contraste (gadolinium) afin d'en déterminer la localisation, la taille et d'autres caractéristiques. Si l'imagerie par résonance magnétique (IRM) est impossible, une tomodensitométrie (TDM) est réalisée et la spectroscopie par résonance magnétique (SRM) est utilisée comme méthode de différenciation. Malgré la valeur informative de ces méthodes diagnostiques, le diagnostic définitif n'est posé qu'après confirmation histologique lors de la résection du foyer tumoral.
Compte tenu des critères ci-dessus, il est recommandé de commencer le diagnostic par une anamnèse complète, une évaluation de l'état somato-neurologique et fonctionnel. L'état neurologique est évalué, ainsi que la recherche de probables troubles intellectuels et mnésiques.
Tests de laboratoire recommandés:
- Un bilan sanguin clinique général complet;
- Un bilan biochimique sanguin complet;
- Analyse d'urine;
- Étude de la coagulation sanguine;
- Analyse des marqueurs oncologiques (AFP, bêta-hCG, LDH - pertinent si une lésion de la zone pinéale est suspectée).
Afin de clarifier les points pronostiques chez les patients atteints de glioblastome et d'astrocytome anaplasique, la mutation du gène IDH1|2-1 et la méthylation du gène MGMT sont évaluées. Chez les patients atteints d'oligodendrogliome et d'oligoastrocytome, la codélétion 1p|19q est déterminée.
Le diagnostic instrumental repose avant tout sur l'imagerie par résonance magnétique (IRM) obligatoire du cerveau (et parfois de la moelle épinière). L'IRM est réalisée en trois projections, en modes standard T1-2, FLAIR et T1 avec contraste.
Lorsque cela est indiqué, une échographie du réseau vasculaire, une imagerie par résonance magnétique fonctionnelle des sections motrices et vocales, ainsi qu'une angiographie, une spectroscopie, une tractographie IRM et une perfusion sont réalisées.
Des investigations supplémentaires peuvent inclure:
- Électroencéphalographie du cerveau;
- Consultations avec un neurochirurgien, un oncologue, un radiologue, un ophtalmologue, un radiologue.
Diagnostic différentiel
Le diagnostic différentiel est nécessairement réalisé avec des pathologies non tumorales - en particulier, avec une hémorragie causée par une malformation artério-veineuse ou artérielle, ainsi qu'avec des processus démyélinisants pseudotumoraux, des maladies inflammatoires (toxoplasmose, abcès cérébral, etc.).
De plus, différenciez le foyer tumoral primaire et les métastases du système nerveux central.
Grâce aux capacités modernes d'imagerie par résonance magnétique, il est possible d'effectuer des mesures diagnostiques suffisamment précises pour déterminer l'origine du foyer primaire dans le SNC. L'IRM cérébrale est réalisée avec ou sans produit de contraste, en mode FLAIR T1, T2 (trois projections), ou en coupes fines en projection axiale (mode SPGR). Ces méthodes diagnostiques permettent de déterminer avec précision la localisation, la taille, les caractéristiques structurelles de la tumeur, ainsi que ses relations avec le réseau vasculaire et les zones cérébrales environnantes.
De plus, une TDM (avec ou sans contraste), une angiographie par tomodensitométrie (angiographie par IRM), une tractographie par IRM, une perfusion par IRM ou par TDM peuvent être réalisées dans le cadre du diagnostic différentiel. Une TDM/TEP du cerveau avec de la méthionine, de la choline, de la tyrosine et d'autres acides aminés est utilisée lorsque cela est indiqué.
Traitement ng mga glioma ng utak
Le traitement spécifique comprend des mesures chirurgicales, chimiothérapeutiques et radiologiques. Il est impératif, si possible, de réaliser une résection complète du foyer tumoral, ce qui permet un soulagement rapide des symptômes et une confirmation histologique du diagnostic.
L'irradiation a un effet positif sur l'allongement de l'espérance de vie des patients. Une dose totale de 58 à 60 Gy, divisée en doses individuelles de 1,8 à 2 Gy, est administrée en standard. La tumeur est irradiée localement, capturant également jusqu'à 3 cm autour. La radiothérapie est plus acceptable que la curiethérapie. Dans certains cas, des méthodes radiochirurgicales sont recommandées, notamment l'irradiation au Gamma Knife ou à l'accélérateur linéaire, ainsi que la thérapie au bore par capture de neutrons.
La nécessité d'une chimiothérapie adjuvante est controversée. Dans certains cas, les préparations à base de nitrosourée ont permis d'augmenter l'espérance de vie des patients jusqu'à un an et demi, mais certains résultats de ces chimiothérapies se sont avérés négatifs. Aujourd'hui, les agents cytotoxiques, le traitement néoadjuvant (avant radiothérapie), les médicaments combinés, la chimiothérapie intra-artérielle ou la chimiothérapie à haute dose avec transplantation de cellules souches sont activement utilisés.
En général, pour un traitement réussi des gliomes, une approche globale est très importante, dont l'étendue dépend de la localisation et du degré de malignité de la masse, de sa taille et de l'état de santé général du patient.
En cas de gliome du tronc cérébral, l'intervention chirurgicale est rarement pratiquée. La principale contre-indication à la chirurgie est la localisation du foyer, à proximité immédiate des organes vitaux. Dans certains cas, il est possible d'enlever un gliome du tronc par microchirurgie, avec chimiothérapie préopératoire et postopératoire. Cette intervention est très complexe et nécessite les compétences spécifiques d'un neurochirurgien.
La radiochirurgie, et en particulier la chirurgie stéréotaxique avec exposition à de fortes doses ionisantes, est très efficace. L'utilisation d'une telle technique aux premiers stades du développement néoplasique permet parfois d'obtenir une rémission prolongée, voire une guérison complète du patient.
La radiothérapie est souvent associée à la chimiothérapie, ce qui améliore l'efficacité des interventions et réduit la charge de radiation. Dans les gliomes, tous les agents chimiopréventifs ne sont pas efficaces sur le plan thérapeutique; ils sont donc prescrits individuellement et les prescriptions sont ajustées si nécessaire.
Pour réduire la douleur et abaisser la pression intracrânienne, quel que soit le traitement principal, une thérapie symptomatique est prescrite - en particulier, des corticostéroïdes, des analgésiques, des sédatifs.
Médicaments
Les corticostéroïdes agissent sur l'œdème et réduisent la gravité des symptômes neurologiques pendant plusieurs jours. Cependant, en raison de leurs multiples effets secondaires et du risque accru d'interactions indésirables avec les médicaments de chimiothérapie, des doses minimales de corticoïdes sont utilisées, et leur administration doit être interrompue dès que possible (par exemple, après une intervention chirurgicale).
Les anticonvulsivants sont systématiquement utilisés en prévention secondaire chez les patients ayant déjà présenté des crises d'épilepsie. Ces médicaments peuvent provoquer des symptômes indésirables graves et interagir avec les médicaments de chimiothérapie.
Les anticoagulants sont particulièrement pertinents au stade postopératoire, car les risques de formation de thrombophlébite dans le gliome sont assez élevés (jusqu'à 25 %).
La prise d'antidépresseurs-anxiolytiques est bénéfique. L'administration de méthylphénidate à raison de 10 à 30 mg/jour en deux prises permet souvent d'optimiser les capacités cognitives, d'améliorer la qualité de vie et de maintenir la capacité de travail.
L'insuffisance neurologique et les signes d'œdème cérébral (douleurs à la tête, troubles de la conscience) sont éliminés par des médicaments corticostéroïdes - en particulier, la prednisolone ou la dexaméthasone. |
Le schéma et la posologie des corticostéroïdes sont choisis individuellement, en respectant la dose minimale efficace. À la fin du traitement, les médicaments sont progressivement arrêtés. |
Les corticostéroïdes sont pris en association avec des médicaments gastroprotecteurs - bloqueurs de la pompe à protons ou bloqueurs de l'histamine H2. |
Les diurétiques (furosémide, mannitol) sont prescrits en cas de gonflement sévère et de déplacement des structures cérébrales, en complément des corticostéroïdes. |
En cas de crises convulsives (y compris l'anamnèse) ou de symptômes épileptiformes à l'électroencéphalogramme, un traitement anticonvulsivant est prescrit en complément. Les anticonvulsivants ne sont pas prescrits à titre prophylactique. |
Il est recommandé aux patients présentant des indications de chimiothérapie de prendre des anticonvulsivants n'affectant pas les fonctions enzymatiques hépatiques. Médicaments de choix: lamotrigine, acide valproïque, lévétiracétam. Ne doivent pas être utilisés: carbamazépine, phénobarbital. |
Les maux de tête dans les gliomes cérébraux sont traités par un traitement aux corticostéroïdes. |
Dans certains cas de maux de tête, des anti-inflammatoires non stéroïdiens ou du tramadol peuvent être utilisés. |
Si le patient prend des anti-inflammatoires non stéroïdiens, ils sont arrêtés quelques jours avant l’intervention afin de minimiser le risque de saignement pendant l’intervention. |
Dans certains cas de douleur, des analgésiques narcotiques, tels que le fentanyl ou la trimépéridine, peuvent être recommandés. |
Pour prévenir l'embolie pulmonaire dès le troisième jour postopératoire, l'administration d'héparines de bas poids moléculaire - notamment l'énoxaparine sodique ou la nadroparine calcique - est prescrite. |
Si le patient est sous traitement anticoagulant ou antiagrégant systématique, il est transféré aux héparines de bas poids moléculaire au plus tard une semaine avant l'intervention chirurgicale, avec leur arrêt ultérieur la veille de l'intervention et leur reprise 24 à 48 heures après l'intervention. |
En cas de thrombose veineuse des membres inférieurs chez un patient atteint de gliome, un traitement par anticoagulants directs est mis en place. La mise en place d'un filtre CAVA n'est pas exclue. |
Chimiothérapie pour les gliomes malins du cerveau
Les schémas de chimiothérapie antitumorale de base pour les gliomes sont considérés comme étant:
- Lomustine 100 mg/m² le premier jour, Vincristine 1,5 mg/m² les premier et huitième jours, Procarbazine 70 mg/m² du huitième au vingt et unième jour, cures toutes les six semaines.
- Lomustine 110 mg/m² toutes les six semaines.
- Témozolomide 5/23 150 à 200 mg/m² du jour 1 au jour 5, tous les 28 jours.
- Témozolomide dans le cadre d'un traitement de chimioradiothérapie, 75 mg/m² chaque jour où la radiothérapie est administrée.
- Témozolomide avec cisplatine ou carboplatine (80 mg/m²) et témozolomide 150-200 mg/m² les jours 1 à 5 toutes les 4 semaines.
- Témozolomide 7/7 à 100 mg/m² les jours 1 à 8 et 15 à 22 du traitement, avec une répétition toutes les quatre semaines.
- Bevacizumab 5 à 10 mg/kg les jours un et quinze, et Irinotecan 200 mg/m² les jours un et quinze, répétés toutes les quatre semaines.
- Bevacizumab 5 à 10 mg/kg les jours un, quinze et vingt-neuf, et Lomustine 90 mg/m² le jour un toutes les six semaines.
- Bevacizumab 5 à 10 mg/kg les jours un et quinze, Lomustine 40 mg les jours un, huit, quinze et vingt-deux, répété toutes les six semaines.
- Bevacizumab 5 à 10 mg/kg les jours un et quinze, répété toutes les quatre semaines.
Dans de nombreux cas, les médicaments cytostatiques inhibent efficacement la croissance des cellules tumorales, mais ne présentent pas de sélectivité pour les tissus et organes sains. Par conséquent, les experts ont identifié un certain nombre de contre-indications rendant impossible la chimiothérapie du gliome:
- Sensibilité individuelle excessive aux agents chimiopréventifs;
- Décompensation des fonctions cardiaque, rénale, hépatique;
- Hématopoïèse diminuée dans la moelle osseuse;
- Problèmes de fonction surrénalienne.
La chimiothérapie est administrée avec une extrême prudence:
- Patients présentant des troubles importants du rythme cardiaque;
- Avec le diabète;
- Pour les infections virales aiguës;
- Aux patients âgés;
- Patients souffrant d'alcoolisme chronique (intoxication alcoolique chronique).
L'effet secondaire le plus grave des médicaments chimiopréventifs est leur toxicité: les cytostatiques interfèrent sélectivement avec la fonctionnalité des cellules sanguines et modifient leur composition. Par conséquent, la masse plaquettaire et érythrocytaire diminue et une anémie se développe.
Avant de prescrire une chimiothérapie à un patient, le médecin prend toujours en compte le degré de toxicité des médicaments et les complications possibles. Les traitements de chimiothérapie font toujours l'objet d'un suivi attentif par des spécialistes et d'analyses sanguines régulières.
Conséquences possibles du traitement cytostatique:
- Maigreur, émaciation;
- Difficulté à avaler les aliments, muqueuses sèches, parodontite, dyspepsie;
- Instabilité du système nerveux central, troubles maniaco-dépressifs, syndrome épileptique, asthénie;
- Détérioration de la fonction auditive;
- Augmentation de la pression artérielle jusqu'au développement d'une crise hypertensive;
- Diminution des plaquettes, des globules rouges, des globules blancs, hémorragies multiples, saignements internes et externes;
- Insuffisance rénale;
- Processus allergiques;
- Chute de cheveux, apparition de zones de pigmentation accrue.
Après des cycles de chimiothérapie, les patients présentent un risque accru de développer des maladies infectieuses et les douleurs musculaires et articulaires sont fréquentes.
Afin de réduire le risque d'effets indésirables post-chimiothérapie, des mesures de réadaptation complémentaires sont obligatoirement prescrites, visant à rétablir une numération sanguine normale, à stabiliser l'activité cardiovasculaire et à normaliser l'état neurologique. Un soutien psychologique adéquat est indispensable.
Traitement chirurgical
L'opération est réalisée pour éliminer autant que possible le foyer tumoral, ce qui devrait à son tour réduire la pression intracrânienne, réduire l'insuffisance neurologique et fournir le biomatériau nécessaire à la recherche.
- L'intervention est réalisée dans un service ou une clinique neurochirurgicale spécialisé dont les spécialistes sont expérimentés dans les interventions neuro-oncologiques.
- Le chirurgien réalise un accès par trépanation osseuse plastique dans la zone de localisation suspectée du gliome.
- Si le néoplasme est situé anatomiquement à proximité des zones ou voies motrices, ou dans les noyaux ou le long des nerfs crâniens, une surveillance neurophysiologique peropératoire est utilisée.
- Systèmes de neuronavigation, la navigation par fluorescence peropératoire avec l'acide 5-aminolévulénique est souhaitable pour maximiser l'élimination du néoplasme.
- Après l'intervention, un scanner ou une IRM de contrôle (avec ou sans injection de contraste) est réalisé au jour 1-2.
Si la résection chirurgicale du gliome est impossible ou initialement reconnue comme inopportune, ou si un lymphome du système nerveux central est suspecté, une biopsie (ouverte, stéréotaxique, avec surveillance par navigation, etc.) est réalisée. |
Les patients atteints de gliomatose cérébrale sont vérifiés par biopsie stéréotaxique, car les tactiques thérapeutiques dépendent en grande partie du tableau histologique. |
Dans certaines situations - chez les patients âgés, en cas de troubles neurologiques sévères, en cas de localisation du gliome dans le tronc et d'autres parties vitales - le traitement est planifié en fonction des symptômes et des informations d'imagerie après une consultation médicale générale. |
Il est recommandé aux patients atteints d'astrocytome piloïde ainsi que de formes nodulaires de néoplasmes du tronc cérébral et de processus exophytiques de subir une résection ou une biopsie ouverte. |
Les patients atteints de gliome pontique diffus et d'autres néoplasies diffuses du tronc sont traités par radiothérapie et traitement antitumoral. Dans ces cas, aucune vérification n'est nécessaire. |
Les patients atteints de gliome en plaques tétraplégiques bénéficient d'une IRM et d'une surveillance clinique systématiques après l'ablation de l'hydrocèle cérébrale. Si la tumeur présente des signes de croissance, elle est retirée avec une nouvelle irradiation. |
Lorsqu'une résection partielle ou une biopsie d'un gliome malin de bas grade est réalisée, les patients présentant deux facteurs de risque ou plus sont nécessairement traités par radiothérapie et/ou chimiothérapie. |
La résection totale est obligatoire pour les patients atteints d'astrocytome à cellules géantes sous-épendymaire. |
L'évérolimus est prescrit pour l'astrocytome diffus à cellules géantes sous-épendymaires. |
L'astrocytome piloïde doit être retiré par imagerie par résonance magnétique après l'intervention pour clarifier la qualité de la résection radicale du tissu tumoral. |
Dans le cas du glioblastome, le traitement postopératoire doit être associé (radiothérapie + chimiothérapie) à l'administration de témozolomide. |
En cas d'astrocytome anaplasique après intervention chirurgicale, une radiothérapie associée à un traitement médicamenteux complémentaire est indiquée. La lomustine et le témozolomide sont utilisés. |
Les patients atteints d’oligodendrogliome anaplasique ou d’oligoastrocytome reçoivent à la fois une radiothérapie et une chimiothérapie (témozolomide ou monothérapie PCV) après la chirurgie. |
Les patients âgés atteints d'un gliome malin étendu sont irradiés en mode hypofractionné ou une monothérapie par témozolomide est réalisée. |
En cas de récidive du gliome, la possibilité d'une réintervention et les stratégies thérapeutiques ultérieures sont discutées en conseil de spécialistes. Le schéma thérapeutique optimal en cas de récidive est le suivant: réintervention + chimiothérapie systémique + radiothérapie répétée + mesures palliatives. En cas de récidive tumorale localisée et mineure, la radiochirurgie peut être utilisée. |
Les médicaments de choix pour la croissance récurrente du gliome sont le témozolomide et le bévacizumab. |
La récidive d’oligodendrogliomes hautement malins et d’astrocytomes anaplasiques est une indication de traitement par témozolomide. |
Le xanthoastrocytome pléomorphe est retiré sans chimiothérapie adjuvante obligatoire. |
L'une des particularités des gliomes réside dans la difficulté de leur traitement et de leur ablation. Le chirurgien vise à retirer les tissus tumoraux aussi complètement que possible afin de compenser la pathologie. De nombreux patients parviennent à améliorer et à prolonger leur qualité de vie, mais pour les tumeurs hautement malignes, le pronostic reste défavorable: le risque de récidive du foyer pathologique est accru.
Nutrition pour le gliome cérébral
Le régime alimentaire des patients atteints de tumeurs malignes est un point important auquel, malheureusement, beaucoup de gens ne prêtent pas attention. Cependant, grâce à des changements alimentaires, il est possible de ralentir le développement du gliome et de renforcer et d'affaiblir le système immunitaire.
Principaux domaines de changement alimentaire:
- Normalisation des processus métaboliques, renforcement de la protection immunitaire;
- Détoxification du corps;
- Optimisation du potentiel énergétique;
- Assurer le fonctionnement normal de tous les organes et systèmes du corps pendant une période aussi difficile pour eux.
Une alimentation équilibrée et rationnelle est essentielle, tant pour les patients atteints de tumeurs malignes à un stade précoce que pour ceux atteints de glioblastome à un stade avancé. Une alimentation soigneusement sélectionnée contribue à l'amélioration du bien-être général et à la régénération des tissus endommagés, ce qui est particulièrement important dans le contexte d'une radiothérapie et d'une cytostatique. L'équilibre nutritionnel et le bon fonctionnement des processus métaboliques préviennent la formation de foyers infectieux, bloquent les réactions inflammatoires et préviennent l'épuisement de l'organisme.
Les aliments et boissons suivants sont recommandés en cas de gliome cérébral:
- Fruits et légumes de couleur rouge, jaune et orange (tomates, pêches, abricots, carottes, betteraves, agrumes) contenant des caroténoïdes, qui protègent les cellules saines des effets négatifs de la radiothérapie;
- Chou (chou-fleur, brocoli, choux de Bruxelles), radis, moutarde et autres produits végétaux contenant de l'indole - une substance active qui neutralise les facteurs toxiques et chimiques indésirables;
- Légumes verts (aneth, persil, jeunes feuilles de pissenlit et d'ortie, rhubarbe, roquette, épinards), petits pois et asperges, haricots asperges et algues (algues, spiruline, chlorella);
- Thé vert;
- L'ail, l'oignon, l'ananas, qui ont des capacités antitumorales et détoxifiantes;
- Son, céréales, pain complet, pousses de légumineuses, céréales et graines germées;
- Raisins noirs, framboises, fraises et fraises, myrtilles, mûres, grenades, groseilles, cassis, sorbes, myrtilles, argousier, cerises et autres baies qui contiennent des antioxydants naturels qui réduisent les effets négatifs des radicaux libres, des virus et des cancérigènes;
- Produits laitiers faibles en gras.
Il est conseillé d'éviter de surcharger le système digestif et l'organisme avec des aliments lourds et gras. Il est conseillé de consommer des jus, smoothies et autres collations maison fraîchement pressés. Des sources d'acides gras oméga-3, comme l'huile de poisson, l'huile de lin ou les graines de lin, devraient être ajoutées à vos plats.
Il est préférable d'éviter complètement le sucre et les sucreries. Cependant, une cuillerée de miel avec un verre d'eau ne fera pas de mal: les produits de la ruche ont un effet anti-inflammatoire, antioxydant et antitumoral prononcé. La seule contre-indication à l'utilisation du miel est une allergie au produit.
Il convient d'exclure du régime alimentaire:
- Viande, saindoux, abats;
- Beurre, produits laitiers gras;
- Viandes fumées, saucisses, conserves de viande et de poisson;
- L'alcool sous toutes ses formes;
- Confiseries, pâtisseries, gâteaux et viennoiseries, bonbons et chocolats;
- Plats cuisinés, restauration rapide, snacks;
- Aliments frits.
Vous devriez consommer quotidiennement suffisamment de légumes, de légumes verts, de fruits et d’eau potable.
Pendant et après la chimiothérapie, il est conseillé de boire des jus de fruits et légumes faits maison, de consommer du fromage blanc allégé, du lait et du fromage maison. Il est important de boire beaucoup, de se brosser les dents et de se rincer la bouche régulièrement (environ quatre fois par jour).
Repas optimaux pour les patients atteints de gliome cérébral:
- Casseroles de légumes;
- Accompagnements et soupes à base de céréales (de préférence sarrasin, flocons d'avoine, riz, couscous, boulgour);
- Gâteaux au fromage cuits à la vapeur, puddings, ragoûts;
- Légumes mijotés et cuits au four;
- Ragoûts, soupes de légumes, entrées et plats principaux à base de légumineuses (y compris de soja), pâtés et soufflés;
- Smoothies, thé vert, compotes et bouchées.
La prévention
Si une personne mène une vie saine et qu'aucun cas de cancer n'a été signalé parmi ses proches, elle a toutes les chances de ne pas développer de gliome cérébral. Il n'existe pas de prévention spécifique contre ces tumeurs; les principaux points de prévention sont donc une alimentation équilibrée, l'activité physique, l'évitement des mauvaises habitudes et l'absence de risques professionnels et domestiques.
Les spécialistes donnent un certain nombre de recommandations simples mais efficaces:
- Buvez plus d’eau pure, évitez les sodas sucrés, les jus conditionnés, les boissons énergisantes et l’alcool.
- Évitez les risques professionnels et domestiques: moins de contact avec les produits chimiques, les solutions corrosives et les liquides.
- Privilégiez la cuisson à l'eau, à la vapeur ou au four, mais évitez la friture. Privilégiez les aliments sains et de qualité, faits maison.
- Une grande partie de votre alimentation doit être composée d’aliments végétaux, y compris de légumes verts, quelle que soit la période de l’année.
- Le surpoids est un autre facteur négatif, dont il faut se débarrasser. Le contrôle du poids est essentiel à la santé de tout le corps.
- Les huiles végétales doivent toujours être préférées au beurre et au saindoux.
- Si possible, privilégiez les produits respectueux de l'environnement, la viande sans hormones, les légumes et les fruits sans nitrates ni pesticides. Il est préférable d'éviter complètement la viande rouge.
- Ne prenez pas de préparations multivitaminées sans indication et en grande quantité. Ne prenez aucun médicament sans ordonnance: l'automédication est souvent très dangereuse.
- Si des symptômes suspects apparaissent, il est nécessaire de consulter un médecin, sans attendre l'aggravation de la situation, le développement d'effets indésirables et de complications.
- Les sucreries et les aliments à indice glycémique élevé sont des composants indésirables du régime alimentaire.
- Plus tôt une personne consulte un médecin, meilleures sont ses chances de guérison (et cela s’applique à presque toutes les maladies, y compris le gliome cérébral).
Pour prévenir la formation d'oncopathologie, vous avez besoin de suffisamment de temps pour dormir et vous reposer, éviter la consommation excessive de boissons alcoolisées, privilégier les aliments naturels de haute qualité, réduire l'utilisation de gadgets (en particulier les téléphones portables).
Les maladies tumorales surviennent souvent chez les personnes âgées. Il est donc important de surveiller sa santé dès le plus jeune âge et de ne pas provoquer de processus pathologiques par un mode de vie et des habitudes malsains.
Les causes exactes du cancer ne sont pas encore élucidées. Cependant, des conditions professionnelles et environnementales défavorables, l'exposition aux rayonnements ionisants et électromagnétiques, ainsi que les variations hormonales jouent un rôle important. Évitez de vous exposer trop longtemps et régulièrement au soleil, de subir des variations brusques de température ambiante, de vous exposer trop chaudement au bain ou au sauna, et de prendre souvent des bains ou des douches chaudes.
Autre question: comment prévenir la récidive d'un gliome cérébral après un traitement réussi? La récidive néoplasique est une complication complexe et malheureusement fréquente, difficile à prévoir. Il est recommandé aux patients de se soumettre à des examens préventifs réguliers, de consulter un oncologue et un médecin traitant au moins deux fois par an, d'adopter un mode de vie sain, de manger des aliments sains et naturels et de pratiquer une activité physique modérée. Il est également essentiel d'avoir la joie de vivre, un optimisme sain et une attitude positive face à la réussite en toutes circonstances. Cela implique également une ambiance familiale et professionnelle conviviale, de la patience et le soutien inconditionnel de ses proches.
Prévoir
L'état cérébral et les caractéristiques du gliome au moment de sa détection influencent le taux de survie autant que le traitement administré. Un bon état de santé général et l'âge du patient améliorent le pronostic (le pronostic est plus optimiste chez les patients jeunes). L'image histologique du néoplasme est un indicateur important. Ainsi, les gliomes de bas grade ont un meilleur pronostic que les gliomes anaplasiques et, plus encore, que les glioblastomes (les processus tumoraux les plus défavorables). Les astrocytomes ont un pronostic plus sombre que les oligodendrogliomes.
Les astrocytomes malins répondent mal au traitement et présentent un taux de survie relativement faible, de six à cinq ans. Parallèlement, l'espérance de vie des gliomes de bas grade est estimée entre 1 et 10 ans.
Les astrocytomes malins sont généralement incurables. Le traitement vise généralement à réduire les manifestations neurologiques (y compris les troubles cognitifs) et à augmenter l'espérance de vie tout en maintenant la meilleure qualité de vie possible. Un traitement symptomatique est associé à des mesures de réadaptation. Le travail d'un psychologue est également important.
Au cours de la dernière décennie, les scientifiques ont progressé dans la compréhension de la nature des tumeurs cérébrales et de leur traitement. Il reste encore beaucoup à faire pour optimiser le pronostic de la maladie. La principale tâche des spécialistes est aujourd'hui la suivante: le gliome cérébral doit bénéficier de plusieurs schémas thérapeutiques pour une élimination efficace et simultanée, tant à un stade précoce qu'à un stade ultérieur de son développement.

