Nouvelles publications
De nouveaux mécanismes génétiques pourraient constituer une cible thérapeutique contre le gliome
Dernière revue: 02.07.2025

Tout le contenu iLive fait l'objet d'un examen médical ou d'une vérification des faits pour assurer autant que possible l'exactitude factuelle.
Nous appliquons des directives strictes en matière d’approvisionnement et ne proposons que des liens vers des sites de médias réputés, des instituts de recherche universitaires et, dans la mesure du possible, des études évaluées par des pairs sur le plan médical. Notez que les nombres entre parenthèses ([1], [2], etc.) sont des liens cliquables vers ces études.
Si vous estimez qu'un contenu quelconque de notre contenu est inexact, obsolète ou discutable, veuillez le sélectionner et appuyer sur Ctrl + Entrée.
Une étude menée par le laboratoire du Dr Shi-Yuan Cheng, professeur à la division de neuro-oncologie Ken et Ruth Davey du département de neurologie, a identifié de nouveaux mécanismes sous-jacents à l'épissage alternatif de l'ARN dans les cellules tumorales du gliome, qui pourraient servir de nouvelles cibles thérapeutiques. Les résultats de l'étude sont publiés dans le Journal of Clinical Investigation.
« Nous avons trouvé une manière différente de traiter le gliome à travers le prisme de l'épissage alternatif et découvert de nouvelles cibles qui n'avaient pas été identifiées auparavant mais qui sont importantes pour la malignité du gliome », a déclaré Xiao Song, MD, PhD, professeur agrégé de neurologie et auteur principal de l'étude.
Les gliomes sont le type de tumeur cérébrale primaire le plus fréquent chez l'adulte. Ils proviennent des cellules gliales, présentes dans le système nerveux central et soutenant les neurones voisins. Leur grande résistance aux traitements standards, notamment la radiothérapie et la chimiothérapie, est due à leur hétérogénéité génétique et épigénétique, ce qui souligne la nécessité de trouver de nouvelles cibles thérapeutiques.
Des recherches antérieures du laboratoire Cheng, publiées dans la revue Cancer Research, ont montré que le facteur d'épissage important SRSF3 est significativement élevé dans les gliomes par rapport aux cerveaux normaux, et que l'épissage de l'ARN régulé par SRSF3 favorise la croissance et la progression du gliome en influençant de multiples processus cellulaires dans les cellules tumorales.
L'épissage de l'ARN est un processus qui implique la suppression des introns (régions non codantes de l'ARN) et la jonction des exons (régions codantes) pour former une molécule d'ARNm mature qui soutient l'expression des gènes dans une cellule.
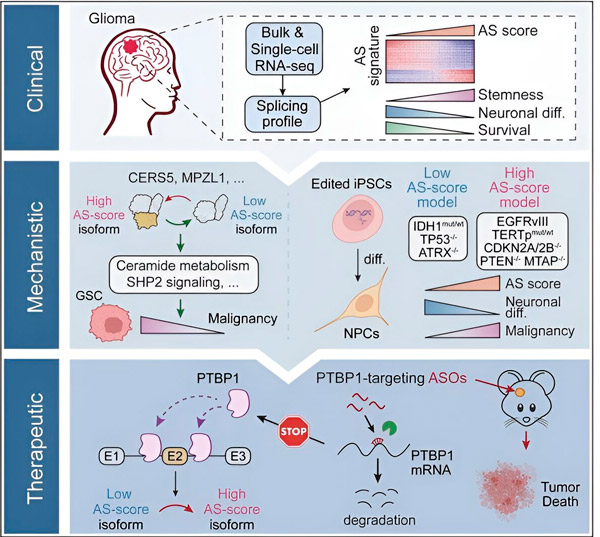
Dans la présente étude, les scientifiques ont cherché à identifier les altérations de l’épissage alternatif dans les cellules tumorales du gliome, les mécanismes sous-jacents à ces altérations et à déterminer leur potentiel en tant que cibles thérapeutiques.
À l'aide de méthodes informatiques et de technologies de séquençage de l'ARN, les chercheurs ont examiné les modifications de l'épissage des cellules tumorales de gliome provenant d'échantillons de patients. Pour confirmer ces modifications, ils ont utilisé les technologies d'édition génétique CRISPR pour introduire différentes mutations motrices du gliome dans des modèles de gliome dérivés de cellules souches pluripotentes induites humaines (CSPi).
Ils ont découvert que ces changements d'épissage sont renforcés par une variante du récepteur du facteur de croissance épidermique III (EGFRIII), qui est connu pour être surexprimé dans de nombreuses tumeurs, y compris les gliomes, et sont inhibés par une mutation du gène IDH1.
Des chercheurs ont confirmé la fonction de deux événements d’épissage d’ARN qui créent différentes isoformes de protéines avec différentes séquences d’acides aminés.
« Seule une de ces isoformes peut favoriser la croissance tumorale, contrairement à l'autre isoforme, normalement exprimée dans le cerveau normal. Les tumeurs exploitent ce mécanisme pour exprimer sélectivement l'isoforme favorisant la croissance tumorale plutôt que l'isoforme cérébrale normale », a expliqué Song.
L'équipe a ensuite analysé les protéines de liaison à l'ARN en amont et a découvert que le gène PTBP1 régule l'épissage de l'ARN favorisant la tumeur dans les cellules de gliome. En utilisant un modèle de gliome orthotopique chez des souris immunodéficientes, les chercheurs ont ciblé PTBP1 avec une thérapie à base d'oligonucléotides antisens (ASO), ce qui a finalement inhibé la croissance tumorale.
« Nos données mettent en évidence le rôle de l'épissage alternatif de l'ARN dans l'influence de la malignité et de l'hétérogénéité des gliomes et son potentiel en tant que vulnérabilité thérapeutique pour le traitement des gliomes adultes », ont écrit les auteurs de l'étude.
La prochaine étape pour les chercheurs est d’explorer le potentiel de ciblage de PTBP1 pour provoquer une réponse immunitaire antitumorale, a déclaré Song.
« Grâce à l'analyse du séquençage de l'ARN à lecture longue, nous avons découvert que le ciblage de PTBP1 dans les cellules de gliome entraîne la production de multiples transcrits à épissage alternatif, absents dans les tissus normaux. Notre prochain projet consiste donc à déterminer si cet isoforme peut générer des antigènes permettant au système immunitaire de mieux reconnaître la tumeur », a déclaré Song.
Song a également ajouté que son équipe s'intéresse à l'analyse des changements d'épissage dans les cellules non tumorales des patients atteints de gliome, telles que les cellules immunitaires.
Nous savons déjà que l'épissage est essentiel à la régulation du fonctionnement cellulaire. Il devrait donc non seulement réguler la malignité tumorale, mais aussi la fonction des cellules immunitaires afin de déterminer leur efficacité contre le cancer. Nous effectuons donc également des analyses bioinformatiques sur des cellules immunitaires infiltrées par la tumeur afin de déterminer si l'épissage change après l'infiltration de la tumeur par une cellule immunitaire.
« Notre objectif est de déterminer le rôle de l'épissage alternatif dans la formation du microenvironnement tumoral immunosuppresseur et d'identifier des cibles potentielles pour améliorer l'efficacité des immunothérapies dans le gliome », a déclaré Song.
