Expert médical de l'article
Nouvelles publications
Fausses couches habituelles - Causes
Dernière revue: 04.07.2025

Tout le contenu iLive fait l'objet d'un examen médical ou d'une vérification des faits pour assurer autant que possible l'exactitude factuelle.
Nous appliquons des directives strictes en matière d’approvisionnement et ne proposons que des liens vers des sites de médias réputés, des instituts de recherche universitaires et, dans la mesure du possible, des études évaluées par des pairs sur le plan médical. Notez que les nombres entre parenthèses ([1], [2], etc.) sont des liens cliquables vers ces études.
Si vous estimez qu'un contenu quelconque de notre contenu est inexact, obsolète ou discutable, veuillez le sélectionner et appuyer sur Ctrl + Entrée.
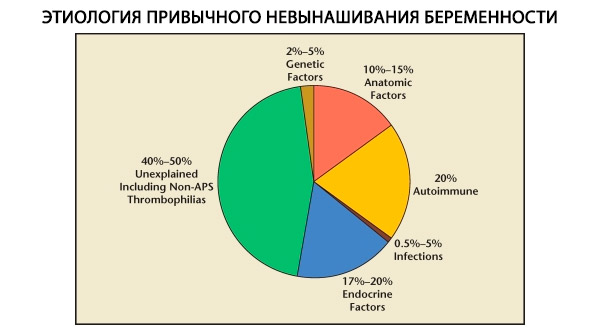
Dans la structure des fausses couches habituelles, on distingue des facteurs génétiques, anatomiques, endocriniens, immunologiques et infectieux. Si l'on exclut toutes ces causes, il reste un groupe de patientes chez lesquelles l'origine des fausses couches habituelles est incertaine (fausses couches idiopathiques). Selon C. Coulam et al. (1996), 80 % des fausses couches idiopathiques sont dues à des troubles immunitaires non diagnostiqués.
Il n’existe aucune preuve convaincante que l’endométriose provoque des fausses couches à répétition, ou que le traitement médical ou chirurgical de l’endométriose réduit l’incidence des fausses couches à répétition.
Selon les théories actuelles, outre les causes génétiques et partiellement infectieuses conduisant à la formation d'un embryon anormal, l'effet néfaste d'autres facteurs (anatomiques, endocriniens, immunologiques) consiste à créer un contexte défavorable au développement d'un ovule fécondé génétiquement complet, ce qui entraîne l'épuisement des réserves choriales et l'arrêt du développement (embryogenèse). Les périodes critiques du premier trimestre de grossesse sont définies comme étant de 6 à 8 semaines (mort de l'embryon) et de 10 à 12 semaines (expulsion de l'ovule fécondé).
 [ 1 ]
[ 1 ]
Causes génétiques des fausses couches à répétition
Les facteurs génétiques sont responsables de 3 à 6 % des causes de fausses couches à répétition. Lors d'interruptions de grossesse sporadiques au premier trimestre, environ 50 % des avortements sont dus à des anomalies chromosomiques. La plupart (95 %) sont des modifications du nombre de chromosomes: monosomie (perte d'un chromosome), trisomie (présence d'un chromosome supplémentaire), résultant d'erreurs de méiose, ainsi que polyploïdie (augmentation de la composition chromosomique d'un ensemble haploïde complet), qui survient lorsqu'un ovule est fécondé par deux spermatozoïdes ou plus. Lors des fausses couches sporadiques, la trisomie est la plus fréquente: 60 % des mutations (le plus souvent sur les chromosomes 16, 13, 18, 21 et 22). Le syndrome de Shereshevsky-Turner (chromosome 45 X0) arrive en deuxième position (20 %), les 15 % restants étant dus à la polyploïdie (en particulier la triploïdie).
En cas de modification du nombre de chromosomes lors d'un avortement, l'examen du caryotype des parents ne révèle généralement aucune pathologie et la probabilité d'une maladie chromosomique du fœtus lors d'une grossesse ultérieure est de 1 %. En revanche, lors de l'examen des avortements chez les couples ayant des fausses couches à répétition, des modifications structurelles des chromosomes (intrachromosomiques et interchromosomiques) sont observées dans 3 à 6 % des cas. L'examen du caryotype des parents révèle des réarrangements chromosomiques équilibrés dans 7 % des cas. Il s'agit le plus souvent de translocations réciproques, où un segment d'un chromosome se trouve à la place d'un autre segment d'un chromosome non homologue, ainsi que de mosaïcisme des chromosomes sexuels, d'inversion et de détection de chromosomes en anneau. En cas de présence de tels réarrangements chez l'un des conjoints, les processus d'appariement et de séparation des chromosomes sont entravés lors de la méiose, ce qui entraîne la perte (délétion) ou le doublement (duplication) de segments chromosomiques dans les gamètes. Il en résulte des réarrangements chromosomiques dits déséquilibrés, dans lesquels l'embryon est soit non viable, soit porteur d'une pathologie chromosomique grave. La probabilité d'avoir un enfant présentant des anomalies chromosomiques déséquilibrées en présence de réarrangements chromosomiques équilibrés dans le caryotype de l'un des parents est de 1 à 15 %. Les différences de données sont associées à la nature des réarrangements, à la taille des segments impliqués, au sexe du porteur et aux antécédents familiaux.
Diagnostic
Anamnèse
- Maladies héréditaires chez les membres de la famille.
- Présence d'anomalies congénitales dans la famille.
- Naissance d'enfants atteints de retard mental.
- Présence d'infertilité et/ou de fausse couche d'origine inconnue chez un couple marié ou chez des proches.
- Présence de cas peu clairs de mortalité périnatale.
Méthodes de recherche spéciales
- L'étude du caryotype des parents est particulièrement indiquée pour les couples mariés à la naissance d'un nouveau-né présentant des défauts de développement en plus d'antécédents de fausse couche, ainsi que dans les cas de fausse couche habituelle au début de la grossesse.
- Analyse cytogénétique de l'avortement en cas de mortinatalité ou de mortalité néonatale.
Indications de consultation avec d'autres spécialistes
Si des modifications du caryotype sont détectées chez les parents, une consultation chez un généticien est nécessaire pour évaluer le degré de risque d'avoir un enfant atteint d'une pathologie ou, si nécessaire, pour décider de la question du don d'ovule ou de sperme.
Prise en charge ultérieure du patient
Si un couple marié présente un caryotype pathologique, même chez l'un des parents, il est recommandé d'effectuer un diagnostic prénatal pendant la grossesse - biopsie chorionique ou amniocentèse - en raison du risque élevé de troubles du développement du fœtus.
Causes anatomiques des fausses couches habituelles
Les causes anatomiques des fausses couches habituelles comprennent:
- anomalies congénitales du développement de l'utérus (doublement complet de l'utérus; utérus bicorne, en selle, unicorne; septum intra-utérin partiel ou complet);
- défauts anatomiques acquis;
- adhérences intra-utérines (syndrome d'Asherman);
- fibromes utérins sous-muqueux;
- insuffisance isthmo-cervicale.
La fréquence des anomalies anatomiques chez les patientes présentant des fausses couches à répétition varie de 10 à 16 %. La fréquence d'apparition des malformations utérines pouvant entraîner une fausse couche (mais pas une infertilité) par rapport à l'ensemble des malformations utérines est la suivante: utérus bicorne – 37 %, utérus en selle – 15 %, cloison intra-utérine – 22 %, dédoublement complet de l'utérus – 11 %, utérus unicorne – 4,4 %.
Diagnostic des fausses couches habituelles
Anamnèse
En cas de pathologie anatomique de l'utérus, des interruptions tardives de grossesse et des naissances prématurées sont plus souvent observées, cependant, en cas d'implantation sur le septum intra-utérin ou à proximité du ganglion myomateux, des interruptions précoces de grossesse sont également possibles.
En cas d'insuffisance isthmo-cervicale, le signe pathognomonique est l'interruption spontanée de la grossesse au deuxième trimestre ou l'accouchement prématuré précoce, qui survient relativement rapidement et avec peu de douleur.
En cas de malformations de l'utérus, il faut prêter attention aux indications anamnestiques de pathologie des voies urinaires (accompagnant souvent des anomalies congénitales de l'utérus) et à la nature du développement de la fonction menstruelle (indications d'hématomètre avec une corne utérine rudimentaire fonctionnelle).
Méthodes d'examen spéciales
- Actuellement, l'hystérosalpingographie est pratiquée pour établir un diagnostic. Elle permet d'étudier la forme de la cavité utérine, d'identifier la présence de fibromes sous-muqueux, d'adhérences et de cloisons, et de déterminer la perméabilité des trompes de Fallope. Pour diagnostiquer une pathologie utérine, il est judicieux de réaliser l'hystérosalpingographie entre les règles et l'ovulation, c'est-à-dire au cours de la première phase du cycle menstruel après l'arrêt des pertes sanguines (7-9e jour du cycle). Pour diagnostiquer une insuffisance isthmo-cervicale, l'examen est réalisé au cours de la deuxième phase du cycle menstruel (18e-20e jour) afin de déterminer l'état de l'orifice interne du col de l'utérus. Avant de réaliser une hystérosalpingographie, il est nécessaire d'exclure ou de traiter une inflammation des organes pelviens.
- L'hystéroscopie s'est généralisée ces dernières années et est devenue la méthode de référence pour le diagnostic des pathologies intra-utérines. Cependant, en raison de son coût plus élevé que l'hystérosalpingographie, cette méthode est utilisée chez les femmes présentant une indication de pathologie intra-utérine sur la base de données échographiques préliminaires. L'hystéroscopie permet d'examiner la cavité utérine, de déterminer la nature de la pathologie intra-utérine et, si l'équipement nécessaire (résectoscope) est disponible, de réaliser un traitement chirurgical mini-invasif: ablation des adhérences, des ganglions myomateux sous-muqueux et des polypes endométriaux. Lors de l'ablation d'une cloison intra-utérine, l'hystéro-séctoscopie sous contrôle laparoscopique est privilégiée, ce qui prévient le risque de perforation de la paroi utérine.
- L'échographie est réalisée au cours de la première phase du cycle menstruel, permettant le diagnostic présomptif de myome utérin sous-muqueux et d'adhérences intra-utérines. Au cours de la deuxième phase du cycle, elle permet d'identifier un septum intra-utérin et un utérus bicorne. Cette méthode est particulièrement importante en début de grossesse, où sa sensibilité diagnostique est de 100 % et sa spécificité de 80 %. En dehors de la grossesse, le diagnostic nécessite une confirmation par d'autres méthodes.
- Des auteurs étrangers soulignent l'avantage de l'échographie hystérographique (échographie utilisant un capteur transvaginal avec introduction préalable d'une solution de chlorure de sodium à 0,9 % dans la cavité utérine) par rapport à l'hystérosalpingographie, car elle permet un diagnostic différentiel entre la cloison intra-utérine et l'utérus bicorne. L'échographie hystérographique permet non seulement d'étudier la forme de la cavité utérine, mais aussi de déterminer la configuration du fond utérin. Dans notre pays, cette méthode n'est pas encore répandue.
- Dans certains cas complexes, l'IRM des organes pelviens est utilisée pour confirmer le diagnostic. Cette méthode permet d'obtenir des informations précieuses en cas d'anomalies du développement utérin accompagnées d'une disposition atypique des organes dans le bassin. L'IRM est importante en cas de corne utérine rudimentaire pour décider de l'opportunité de son ablation. L'ablation de la corne utérine rudimentaire est nécessaire en cas de connexion avec la trompe et l'ovaire, empêchant la formation et le développement de l'ovule fécondé. L'interruption de grossesse en cas d'anomalies anatomiques de l'utérus peut être associée à une implantation infructueuse de l'ovule fécondé (sur la cloison intra-utérine, à proximité du myome sous-muqueux), à une vascularisation et une réception insuffisantes de l'endomètre, à des relations spatiales étroites dans la cavité utérine (par exemple, en cas de déformation de la cavité par un myome), souvent accompagnées d'une ICI, et à des troubles hormonaux.
Traitement des fausses couches à répétition
Traitement chirurgical
En présence d'une cloison intra-utérine, de ganglions myomateux sous-muqueux et d'adhérences, le traitement chirurgical le plus efficace est l'hystéro-résectoscopie. La fréquence des fausses couches ultérieures dans ce groupe de femmes après traitement est de 10 %, contre 90 % avant la chirurgie. En comparant les résultats d'une métroplastie par laparotomie et d'une hystéro-résectoscopie transcervicale, P. Heinonen (1997) a obtenu des résultats indiquant un traumatisme moindre et une plus grande efficacité de l'hystéro-résectoscopie; le pourcentage de grossesses aboutissant à la naissance d'enfants viables était respectivement de 68 et 86 %.
L'ablation chirurgicale du septum intra-utérin, des adhérences et des ganglions myomateux sous-muqueux permet d'éviter une fausse couche dans 70 à 80 % des cas. Cependant, elle est inefficace chez les femmes présentant des malformations utérines et ayant accouché normalement, mais ayant ensuite connu des fausses couches à répétition. Dans ce cas, il est probable que le facteur anatomique ne soit pas la cause principale et qu'il soit nécessaire de rechercher d'autres causes de fausse couche.
Il a été démontré que la métroplastie abdominale est associée à un risque significatif d'infertilité postopératoire et n'améliore pas le pronostic des grossesses ultérieures. Il est donc préférable de privilégier l'hystéroscopie et la laparoscopie.
Traitement médicamenteux
L'efficacité de la pose d'un DIU, de doses élevées d'œstrogéniques et de l'insertion d'une sonde de Foley dans la cavité utérine après une intervention chirurgicale visant à éliminer les adhérences et le septum intra-utérin n'a pas été démontrée. Il est recommandé de planifier une grossesse au plus tôt 3 mois après l'opération. Pour améliorer la croissance de l'endomètre, un traitement hormonal cyclique est administré pendant 3 cycles menstruels [14]. Pendant 3 mois, au cours des 14 premiers jours du cycle, il est conseillé de prendre un médicament contenant 2 mg de 17-bêta-estradiol, puis, au cours des 14 jours suivants, 2 mg de 17-bêta-estradiol et 20 mg de dydrogestérone (10 mg de dydrogestérone en association avec 10 mg de dydrogestérone sous forme de comprimés séparés).
Prise en charge ultérieure du patient
Caractéristiques du déroulement de la grossesse avec un utérus bicorne ou un doublement de l'utérus (lorsqu'il y a 2 cavités utérines):
- au début de la grossesse, des saignements se produisent souvent à partir de la corne « vide » ou de la cavité utérine en raison d'une réaction déciduale prononcée; la tactique dans ce cas doit être conservatrice et consister en l'utilisation d'agents antispasmodiques et hémostatiques;
- menace d’interruption de grossesse à différents stades;
- développement d'une insuffisance isthmo-cervicale;
- retard de croissance intra-utérin dû à une insuffisance placentaire.
Au début de la grossesse, en cas de saignement, il est conseillé de rester au lit ou de rester au semi-lit, ainsi que d'administrer des médicaments hémostatiques, antispasmodiques et sédatifs, et de suivre un traitement par gestagènes (dydrogestérone à une dose quotidienne de 20 à 40 mg) jusqu'à 16-18 semaines de gestation.
Causes endocriniennes des fausses couches à répétition
Selon divers auteurs, les causes endocriniennes des fausses couches représentent 8 à 20 % des cas. Les plus importantes sont le déficit en phase lutéale (DPL), l'hypersécrétion de LH, le dysfonctionnement thyroïdien et le diabète sucré.
Une maladie thyroïdienne grave ou un diabète sucré peuvent entraîner des fausses couches à répétition. Cependant, dans le diabète sucré compensé, le risque de fausses couches à répétition ne diffère pas de celui de la population générale.
Parallèlement, la forte incidence de l'hypothyroïdie dans la population nécessite un dépistage par dosage de la TSH. Chez les patientes présentant des fausses couches à répétition, une insuffisance lutéale est observée dans 20 à 60 % des cas et des signes échographiques d'ovaires polykystiques dans 44 à 56 % des cas. D'après la littérature, l'influence de certains troubles hormonaux sur la formation du complexe symptomatique des fausses couches à répétition reste controversée. Les études de M. Ogasawara et al. (1997) n'ont pas révélé de différences significatives dans la fréquence des interruptions de grossesse avec et sans IVG chez les patientes ayant déjà subi deux fausses couches ou plus, hors causes auto-immunes, anatomiques et infectieuses.
L’insuffisance de la fonction du corps jaune peut être le résultat d’un certain nombre de facteurs défavorables:
- troubles de la sécrétion de FSH et de LH dans la première phase du cycle menstruel;
- pic de libération de LH précoce ou, au contraire, trop tardif;
- Hypoestrogénie due à une folliculogenèse inadéquate. Aucune de ces pathologies ne peut être corrigée par un traitement substitutif par gestagènes en période postovulatoire. Des études prospectives menées par L. Regan et al. ont montré une augmentation significative de la fréquence des fausses couches chez les patientes présentant une hypersécrétion de LH au 8e jour du cycle menstruel, par rapport aux femmes présentant des taux sanguins normaux de LH (respectivement 65 % et 12 % de fausses couches). L'effet néfaste d'une poussée intempestive de LH est associé à une reprise prématurée de la deuxième division méiotique et à l'ovulation d'un ovule immature, ainsi qu'à l'induction de la production d'androgènes par les cellules thécales et à une altération de la réception endométriale sous l'influence d'une insuffisance de gestagène. Cependant, une réduction préliminaire des taux de LH préovulatoires par des agonistes de la gonadolibérine, sans mesures complémentaires visant à prolonger la grossesse ultérieure, n'entraîne pas la réduction escomptée de la fréquence des fausses couches.
La norme de référence pour le diagnostic de la NLF est l’examen histologique du matériel obtenu à partir d’une biopsie endométriale au cours de la deuxième phase du cycle sur 2 cycles menstruels.
Le diagnostic d'autres causes de dysfonctionnement ovulatoire, telles que l'hyperprolactinémie, l'hypothyroïdie, l'excès fonctionnel d'androgènes (ovariens ou surrénaliens), doit s'accompagner de la prescription d'un traitement adapté.
Diagnostic
Antécédents et examen physique
- Antécédents. Facteurs à prendre en compte: ménarche tardive, cycle menstruel irrégulier (oligoménorrhée, aménorrhée, prise de poids soudaine, perte de poids, infertilité, fausses couches précoces habituelles).
- Examen: type corporel, taille, poids corporel, hirsutisme, gravité des caractères sexuels secondaires, présence de vergetures, examen des glandes mammaires pour la galactorrhée.
- Tests diagnostiques fonctionnels: mesure de la température rectale au cours de 3 cycles menstruels.
Méthodes de recherche spéciales
- Étude hormonale:
- dans la 1ère phase du cycle menstruel (7-8ème jour) – détermination de la teneur en FSH, LH, prolactine, TSH, testostérone, 17-hydroxyprogestérone (17-OP), DHEAS;
- dans la 2ème phase du cycle menstruel (21–22 jours) – détermination de la teneur en progestérone (les indicateurs normatifs des niveaux de progestérone sont très variables, la méthode ne peut pas être utilisée sans prendre en compte d'autres facteurs).
- Ultrason:
- dans la 1ère phase du cycle menstruel (5–7ème jour) – diagnostic de pathologie endométriale, ovaires polykystiques;
- dans la 2ème phase du cycle menstruel (20–21 jours) – mesure de l'épaisseur de l'endomètre (normale 10–11 mm, corrélée à la teneur en progestérone).
- Une biopsie endométriale pour vérifier la NLF est réalisée deux jours avant la date prévue des règles (le 26e jour pour un cycle de 28 jours). Cette méthode est utilisée lorsque le diagnostic est incertain. Pour étudier les modifications de l'endomètre pendant la période dite de « fenêtre d'implantation », une biopsie est réalisée le 6e jour après l'ovulation.
Traitement
Lors du diagnostic de NLF (selon les graphiques de température rectale, la durée de la 2ème phase est inférieure à 11 jours, une augmentation progressive de la température est observée, une transformation sécrétoire insuffisante de l'endomètre selon les données de la biopsie endométriale, de faibles niveaux de progestérone dans le sérum sanguin), il est nécessaire d'identifier la cause de ces troubles.
Si le NLF s'accompagne d'une hyperprolactinémie, une IRM cérébrale est réalisée. Une autre méthode est la radiographie du crâne (région de la selle turcique).
La première étape de l'hyperprolactinémie consiste à exclure un adénome hypophysaire, qui nécessite un traitement chirurgical. En l'absence de modifications significatives, l'hyperprolactinémie est considérée comme fonctionnelle et un traitement par bromocriptine est prescrit pour normaliser le taux de prolactine. La dose initiale de bromocriptine est de 1,25 mg/jour pendant deux semaines. Après surveillance du taux de prolactine, si les paramètres ne se normalisent pas, la dose est augmentée à 2,5 mg/jour. En cas d'augmentation significative du taux de prolactine, la dose initiale est de 2,5 mg/jour. En cas de grossesse, le traitement par bromocriptine doit être interrompu.
En cas d'hypothyroïdie, la nature de la pathologie thyroïdienne est déterminée en collaboration avec un endocrinologue. Dans tous les cas, un traitement quotidien par lévothyroxine sodique est indiqué, la dose étant choisie individuellement jusqu'à normalisation du taux de TSH. En cas de grossesse, le traitement par lévothyroxine sodique doit être poursuivi. L'opportunité d'une augmentation de la dose au cours du premier trimestre de la grossesse est déterminée en collaboration avec un endocrinologue après examen des résultats d'un bilan hormonal (taux de TSH, thyroxine libre).
La correction du NLF peut se faire de deux manières: la stimulation de l'ovulation, et le traitement substitutif par progestérone.
La première option thérapeutique est la stimulation de l'ovulation par le citrate de clomifène. Cette méthode repose sur le fait que la plupart des troubles de la phase lutéale surviennent pendant la phase folliculaire du cycle. Une baisse constante du taux de progestérone pendant la deuxième phase est la conséquence d'une altération de la folliculogenèse pendant la première phase du cycle. Ce trouble sera corrigé avec plus de succès par de faibles doses de citrate de clomifène en début de phase folliculaire que par la prescription de progestérone pendant la deuxième phase du cycle.
Au cours du 1er cycle, la dose de citrate de clomifène est de 50 mg/jour du 5e au 9e jour du cycle menstruel. L'efficacité est contrôlée à l'aide de courbes de température rectale, de mesures du taux de progestérone au cours de la 2e phase du cycle ou d'une échographie dynamique. En cas d'effet insuffisant au cours du 2e cycle de stimulation de l'ovulation, la dose de citrate de clomifène doit être augmentée à 100 mg/jour du 5e au 9e jour du cycle. La dose maximale possible au cours du 3e cycle de stimulation de l'ovulation est de 150 mg/jour. Une telle augmentation de dose n'est possible que si le médicament est bien toléré (absence de douleurs intenses dans le bas-ventre et le bas du dos, et absence d'autres signes d'hyperstimulation ovarienne).
La deuxième option thérapeutique est le traitement substitutif par des préparations de progestérone, qui favorisent la transformation sécrétoire complète de l'endomètre, ce qui produit l'effet recherché chez les patientes présentant des fausses couches à répétition avec une ovulation préservée. De plus, ces dernières années, il a été démontré que l'administration de préparations de progestérone a un effet non seulement hormonal, mais aussi immunomodulateur, supprimant les réactions de rejet des cellules immunocompétentes de l'endomètre. Un effet similaire a notamment été décrit pour la dihydrogestérone à la dose de 20 mg/jour. En traitement substitutif, la dydrogestérone est utilisée à la dose de 20 mg/jour par voie orale ou la progestérone micronisée par voie vaginale à la dose de 200 mg/jour. Le traitement est administré le deuxième jour après l'ovulation (le lendemain de l'augmentation de la température rectale) et se poursuit pendant 10 jours. En cas de grossesse, le traitement par progestérone doit être poursuivi.
Les recherches modernes n’ont pas confirmé l’efficacité de la gonadotrophine chorionique humaine dans le traitement des fausses couches à répétition.
En cas d'hyperandrogénie (d'origine ovarienne ou surrénalienne) chez les patientes présentant des fausses couches à répétition, un traitement médicamenteux est indiqué en raison de l'effet des androgènes sur la complétude de l'ovulation et l'état de l'endomètre. En cas de perturbation de la biosynthèse des androgènes surrénaliens, leur effet virilisant sur le fœtus féminin est possible; une corticothérapie est donc mise en place dans l'intérêt du fœtus.
Hyperandrogénie d'origine ovarienne (ovaires polykystiques)
Antécédents, examen physique et résultats d'examens spéciaux
- Antécédents: ménarche tardive, troubles du cycle menstruel tels qu'une oligoménorrhée (généralement primaire, plus rarement secondaire). Les grossesses sont rares, généralement interrompues spontanément au premier trimestre, avec de longues périodes d'infertilité entre les grossesses.
- Examen: hirsutisme, acné, vergetures, indice de masse corporelle élevé (facultatif).
- Courbes de température rectale: cycles anovulatoires alternant avec cycles avec ovulation et NLF.
- Examen hormonal: taux de testostérone élevé, les taux de FSH et de LH peuvent être élevés, le rapport LH/FSH est supérieur à 3. Échographie: ovaires polykystiques.
Traitement
Traitement non médicamenteux
Perte de poids - thérapie diététique, activité physique.
Traitement médicamenteux
- Orlistat à la dose de 120 mg à chaque repas principal. La durée du traitement est déterminée en fonction de l'effet et de la tolérance.
- Réduction préliminaire de la testostérone avec des préparations contenant de l'acétate de cyprotérone (2 mg) et de l'EE (35 mcg) pendant 3 cycles menstruels.
- Arrêt de la contraception, soutien hormonal de la deuxième phase du cycle (traitement gestagène): dydrogestérone à la dose de 20 mg/jour du 16e au 25e jour du cycle menstruel. En l'absence d'ovulation spontanée, passer à l'étape suivante.
- Stimulation de l'ovulation par le citrate de clomifène à la dose initiale de 50 mg/jour du 5ème au 9ème jour du cycle menstruel avec traitement simultané par des gestagènes (dydrogestérone à la dose de 20 mg/jour du 16ème au 25ème jour du cycle) et de la dexaméthasone (0,5 mg).
- En l'absence de grossesse, la dose de citrate de clomifène est augmentée à 100–150 mg/jour avec l'administration de gestagènes pendant la deuxième phase du cycle et de dexaméthasone (0,5 mg). Il a été établi que, bien que la dexaméthasone ne réduise que le taux d'androgènes surrénaliens, l'ovulation et la conception sont significativement plus fréquentes avec un traitement par citrate de clomifène et dexaméthasone qu'avec le citrate de clomifène seul [12].
- Trois cycles de stimulation de l'ovulation sont réalisés, après quoi une pause de trois cycles menstruels avec support gestagène et une décision de traitement chirurgical utilisant un accès laparoscopique (résection cunéiforme des ovaires, vaporisation au laser) est recommandée.
Prise en charge ultérieure du patient
La prise en charge de la grossesse doit s'accompagner d'un soutien gestagène jusqu'à 16 semaines de grossesse (dydrogestérone à la dose de 20 mg/jour ou progestérone micronisée à la dose de 200 mg/jour). La dexaméthasone n'est prescrite qu'au premier trimestre de la grossesse. Une surveillance est obligatoire pour diagnostiquer rapidement une insuffisance isthmo-cervicale et, si nécessaire, pour sa correction chirurgicale.
Hyperandrogénie surrénalienne (syndrome adrénogénital pubertaire et postpubertaire)
Le syndrome adrénogénital (SAG) est une maladie héréditaire associée à une perturbation de la synthèse hormonale du cortex surrénalien due à une atteinte des gènes responsables de la synthèse de plusieurs systèmes enzymatiques. La maladie se transmet selon un mode autosomique récessif, par la transmission de gènes mutants par les deux parents, porteurs sains.
Dans 90 % des cas, le syndrome adrénogénital est causé par des mutations du gène CYP21B, entraînant une perturbation de la synthèse de la 21-hydroxylase.
Antécédents, examen physique et résultats d'examens spéciaux
- Antécédents: ménarche tardive, cycle menstruel légèrement prolongé, oligoménorrhée possible, avortements spontanés au premier trimestre, infertilité possible.
- Examen: acné, hirsutisme, morphologie androïde (épaules larges, bassin étroit), hypertrophie clitoridienne.
- Courbes de température rectale: cycles anovulatoires alternant avec cycles avec ovulation et NLF.
- Test hormonal: taux élevés de 17-OP, DHEAS.
- Échographie: les ovaires sont inchangés.
Un signe pathognomonique en dehors de la grossesse est une augmentation de la concentration de 17-OP dans le plasma sanguin.
Actuellement, un test à l'ACTH est utilisé pour diagnostiquer la forme latente et non classique de l'hyperandrogénie surrénalienne. Ce test utilise le synacthène, un polypeptide synthétique possédant les propriétés de l'ACTH endogène, c'est-à-dire qu'il stimule les phases initiales de la synthèse des hormones stéroïdes à partir du cholestérol dans les glandes surrénales.
Test au synacthène (analogue de l'ACTH): 1 ml (0,5 mg) de synacthène est injecté par voie sous-cutanée dans l'épaule. Les concentrations initiales en 17-OP et en cortisol sont d'abord déterminées dans le plasma sanguin prélevé à 9 heures du matin. Un échantillon sanguin de contrôle est prélevé 9 heures après l'injection afin de déterminer les concentrations de 17-OP et de cortisol. L'indice de dosage (D) est ensuite calculé selon la formule suivante:
D = 0,052 × 17-OP + 0,005 × Cortisol/17-OP - 0,018 × Cortisol/17-OP
Si le coefficient D est inférieur ou égal à 0,069, cela indique l'absence d'hyperandrogénie surrénalienne. S'il est supérieur à 0,069, il faut considérer que l'hyperandrogénie est due à un dysfonctionnement des glandes surrénales.
Traitement médicamenteux
Le traitement principal de l’hyperandrogénie due à un déficit en 21-hydroxylase est constitué par les glucocorticoïdes, qui sont utilisés pour supprimer la sécrétion excessive d’androgènes.
Prise en charge ultérieure du patient
En raison de l'effet virilisant des androgènes maternels sur le fœtus, en cas d'hyperandrogénie surrénalienne diagnostiquée, un traitement par dexaméthasone à la dose initiale de 0,25 mg est prescrit avant la grossesse et poursuivi à une dose individuelle (de 0,5 à 1 mg) tout au long de la grossesse. Chez une femme présentant des fausses couches à répétition et souffrant d'hyperandrogénie surrénalienne, il est inapproprié d'interrompre le traitement, car la fréquence des fausses couches en l'absence de traitement atteint 14 %, et 9 % en cas de poursuite du traitement.
Étant donné que les patientes atteintes du syndrome adrénogénital peuvent transmettre ce gène au fœtus, un diagnostic prénatal est nécessaire: à 17-18 semaines de grossesse, une analyse sanguine est prescrite pour déterminer le taux de 17-OP chez la mère. Si le taux sanguin de l'hormone est élevé, sa concentration dans le liquide amniotique est mesurée. Si le taux de 17-OP dans le liquide amniotique est élevé, un syndrome adrénogénital fœtal est diagnostiqué. Malheureusement, il est impossible de déterminer la gravité du syndrome adrénogénital (forme légère ou sévère avec perte de sel) par le taux de 17-OP dans le liquide amniotique. La décision de poursuivre la grossesse dans ce cas appartient aux parents.
Si le père de l'enfant est porteur du gène du syndrome adrénogénital et qu'il existe des cas familiaux d'enfants nés avec ce syndrome, la patiente, même sans hyperandrogénie surrénalienne, reçoit de la dexaméthasone dans l'intérêt du fœtus (pour prévenir la virilisation du fœtus féminin) à la dose de 20 µg/kg de poids corporel, maximum 1,5 mg/jour en 2 à 3 prises après les repas. À 17-18 semaines, après détermination du sexe du fœtus et de l'expression du gène du syndrome adrénogénital (sur la base des résultats de l'amniocentèse), le traitement est poursuivi jusqu'à la fin de la grossesse si le fœtus est une fille atteinte du syndrome adrénogénital. Si le fœtus est un garçon ou une fille non porteur du gène du syndrome adrénogénital, la dexaméthasone peut être interrompue.
Si une femme présentant des fausses couches à répétition souffre d'hyperandrogénie surrénalienne, le traitement par dexaméthasone est poursuivi tout au long de la grossesse et n'est interrompu qu'après l'accouchement. Le troisième jour après l'accouchement, la dose de dexaméthasone est progressivement réduite (de 0,125 mg tous les trois jours) jusqu'à son arrêt complet en post-partum.
Hyperandrogénie d'origine mixte (ovarienne et surrénalienne)
Antécédents, examen physique et résultats d'examens spéciaux
- Antécédents: ménarche tardive, troubles du cycle menstruel tels qu'oligoménorrhée (généralement primaire, moins souvent secondaire), aménorrhée, possibles blessures, commotions cérébrales. Les grossesses sont rares, généralement interrompues spontanément au premier trimestre, et présentent de longues périodes d'infertilité entre les grossesses.
- Examen physique: hirsutisme, acné, vergetures, acanthosis nigricans, indice de masse corporelle élevé, hypertension.
- Courbes de température rectale: cycles anovulatoires alternant avec cycles avec ovulation et NLF.
- Examen hormonal: taux élevés de testostérone, taux de FSH et de LH pouvant être élevés, rapport LH/FSH supérieur à 3, taux élevés de DHEAS, taux de 17-OP, hyperprolactinémie pouvant être présente.
- Échographie: ovaires polykystiques.
- Électroencéphalographie: modifications de l'activité bioélectrique du cerveau.
- Hyperinsulinémie, trouble du métabolisme lipidique (cholestérol élevé, lipoprotéines de basse densité et lipoprotéines de très basse densité), diminution de la tolérance au glucose ou glycémie élevée.
Traitement
Traitement non médicamenteux
Perte de poids (régime hypocalorique, activité physique).
Traitement médicamenteux
La première étape - en présence d'une résistance à l'insuline, il est recommandé de prescrire de la metformine à une dose quotidienne de 1000 à 1500 mg pour augmenter la sensibilité à l'insuline.
La deuxième étape - en cas de troubles graves du cycle menstruel et de taux élevés de testostérone, il est recommandé de prescrire des médicaments à effet antiandrogène contenant de l'acétate de cyprotérone (2 mg) et de l'éthinylestradiol (35 mcg) pendant 3 mois.
La troisième étape est la stimulation de l’ovulation suivie d’un soutien gestagène (le schéma est décrit ci-dessus) et de la prise de dexaméthasone à une dose quotidienne de 0,25 à 0,5 mg.
En cas d'hyperprolactinémie et d'hypothyroïdie, une correction médicamenteuse appropriée doit être effectuée lors des cycles de stimulation de l'ovulation. En cas de grossesse, le traitement par bromocriptine doit être interrompu et la lévothyroxine poursuivie.
Si la stimulation de l'ovulation est inefficace, il faut se demander s'il faut prescrire des inducteurs directs de l'ovulation, s'il faut recourir à un traitement chirurgical des ovaires polykystiques ou à une fécondation in vitro.
Prise en charge ultérieure du patient
Chez les patientes atteintes du syndrome métabolique, la grossesse est souvent compliquée par une hypertension artérielle, une néphropathie et une hypercoagulation. Il est donc nécessaire de surveiller la tension artérielle et de réaliser des hémostase dès les premiers stades de la grossesse, et de corriger les troubles (si nécessaire) par des antihypertenseurs, des antiplaquettaires et des anticoagulants. Des médicaments gestagènes sont prescrits jusqu'à 16 semaines de grossesse: la didrogestérone à la dose de 20 mg/jour ou la progestérone micronisée à la dose de 200 mg/jour en deux prises.
Toutes les femmes atteintes d'hyperandrogénie représentent un groupe à risque de développer une insuffisance isthmo-cervicale. Une surveillance de l'état du col de l'utérus doit être effectuée dès la 16e semaine de grossesse et, si nécessaire, une correction chirurgicale de l'insuffisance isthmo-cervicale est nécessaire.
Causes immunologiques des fausses couches à répétition
On sait actuellement qu'environ 80 % des cas de fausses couches répétées jusqu'alors inexpliqués (après exclusion des causes génétiques, anatomiques et hormonales) sont associés à des troubles immunitaires. On distingue les maladies auto-immunes et allo-immunes, conduisant à des fausses couches à répétition.
Dans les processus auto-immuns, les tissus du système immunitaire deviennent la cible d'une agression, c'est-à-dire que la réponse immunitaire est dirigée contre ses propres antigènes. Dans ce cas, le fœtus souffre secondairement des lésions tissulaires maternelles.
Dans les troubles allo-immunitaires, la réponse immunitaire d’une femme est dirigée contre les antigènes embryonnaires/fœtaux reçus du père et qui sont potentiellement étrangers au corps de la mère.
Les maladies auto-immunes les plus fréquemment observées chez les patientes présentant des fausses couches à répétition comprennent la présence d'anticorps antiphospholipides, antithyroïdiens et antinucléaires dans le sérum. Ainsi, il a été établi que 31 % des femmes présentant des fausses couches à répétition hors grossesse présentent des auto-anticorps anti-thyroglobuline et anti-thyroïde-peroxydase (auto-anticorps microsomaux thyroïdiens [thyroïde-peroxydase]); dans ces cas, le risque de fausse couche spontanée au premier trimestre de grossesse s'élève à 20 %. En cas de fausses couches à répétition, la présence d'anticorps antinucléaires et antithyroïdiens indique la nécessité d'examens complémentaires pour identifier le processus auto-immun et confirmer le diagnostic.
Le syndrome des antiphospholipides (APS) reste une maladie auto-immune généralement reconnue conduisant à la mort de l'embryon/du fœtus.
Troubles allo-immunitaires
Actuellement, les processus allo-immuns conduisant au rejet fœtal comprennent la présence d'un nombre accru (plus de 3) d'antigènes communs du système du complexe majeur d'histocompatibilité chez les conjoints (souvent observé dans les mariages consanguins); de faibles niveaux de facteurs de blocage dans le sérum de la mère; des niveaux accrus de cellules tueuses naturelles (cellules NK CD56, CD16) dans l'endomètre et le sang périphérique de la mère à la fois en dehors et pendant la grossesse; des niveaux élevés de concentration d'un certain nombre de cytokines dans l'endomètre et le sérum sanguin, en particulier, l'interféron γ, le facteur de nécrose tumorale a, les interleukines-1 et 2.
Actuellement, les facteurs allo-immunitaires responsables des fausses couches précoces et les moyens de corriger ces pathologies sont à l'étude. Il n'existe pas de consensus sur les méthodes thérapeutiques. Selon certains chercheurs, l'immunisation active avec des lymphocytes de donneur n'a pas d'effet significatif, tandis que d'autres auteurs décrivent un effet positif significatif avec une telle immunisation et un traitement par immunoglobulines.
Actuellement, la progestérone est l'un des agents immunomodulateurs en début de grossesse. Des études ont notamment démontré le rôle de la dydrogestérone à une dose quotidienne de 20 mg chez les femmes présentant des fausses couches à répétition au premier trimestre de grossesse et présentant un taux accru de cellules CD56 dans l'endomètre.
 [ 11 ], [ 12 ], [ 13 ], [ 14 ], [ 15 ], [ 16 ]
[ 11 ], [ 12 ], [ 13 ], [ 14 ], [ 15 ], [ 16 ]
Thrombophilies génétiquement déterminées
Les formes suivantes de thrombophilies génétiquement déterminées sont considérées comme des affections thrombophiliques pendant la grossesse conduisant à des fausses couches habituelles.
- Déficit en antithrombine III.
- Mutation du facteur V (mutation de Leiden).
- Déficit en protéine C.
- Déficit en protéine S.
- Mutation du gène de la prothrombine G20210A.
- Hyperhomocystéinémie.
Un examen visant à identifier les causes rares de thrombophilie est nécessaire dans les cas où il y avait:
- antécédents familiaux - thromboembolie avant 40 ans chez les proches;
- épisodes fiables de thrombose veineuse et/ou artérielle avant l’âge de 40 ans;
- thrombose récurrente chez le patient et ses proches;
- complications thromboemboliques pendant la grossesse et après l’accouchement lors de l’utilisation d’une contraception hormonale;
- fausses couches répétées, mortinaissances, retard de croissance intra-utérin, décollement placentaire;
- prééclampsie précoce, syndrome HELLP.
Causes infectieuses des fausses couches à répétition
Le rôle du facteur infectieux comme cause de fausses couches à répétition fait actuellement l'objet de nombreux débats. Il est connu qu'une primo-infection en début de grossesse peut provoquer des lésions embryonnaires incompatibles avec la vie, conduisant à des fausses couches spontanées sporadiques. Cependant, la probabilité d'une réactivation de l'infection, accompagnée de fausses couches répétées, est négligeable. De plus, aucun micro-organisme provoquant des fausses couches à répétition n'a été identifié à ce jour. Des études menées ces dernières années ont montré que la plupart des femmes présentant des fausses couches à répétition et une endométrite chronique présentent une prévalence de 2 à 3 types, voire plus, de micro-organismes anaérobies obligatoires et de virus dans l'endomètre.
Français Selon VM Sidelnikova et al., chez les femmes souffrant de fausses couches à répétition, le diagnostic d'endométrite chronique en dehors de la grossesse a été vérifié histologiquement dans 73,1 % des cas et dans 86,7 %, une persistance de micro-organismes opportunistes dans l'endomètre a été observée, ce qui peut certainement être la cause de l'activation de processus immunopathologiques. Une infection virale mixte persistante (virus de l'herpès simplex, Coxsackie A, Coxsackie B, entérovirus 68-71, cytomégalovirus) est trouvée chez les patientes souffrant de fausses couches à répétition significativement plus souvent que chez les femmes ayant des antécédents obstétricaux normaux. K. Kohut et al. (1997) ont montré que le pourcentage de modifications inflammatoires de l'endomètre et du tissu décidual chez les patientes ayant subi une fausse couche primaire récurrente est significativement plus élevé que chez les femmes après une fausse couche ayant des antécédents d'au moins un accouchement à terme.
La colonisation bactérienne et virale de l'endomètre résulte généralement de l'incapacité du système immunitaire et des défenses non spécifiques de l'organisme (système du complément, phagocytose) à éliminer complètement l'agent infectieux. Parallèlement, sa propagation est limitée par l'activation des lymphocytes T (lymphocytes T auxiliaires, NK) et des macrophages. Dans tous les cas mentionnés ci-dessus, on observe une persistance des micro-organismes, caractérisée par l'attraction de phagocytes mononucléaires, de NK et de NK, synthétisant diverses cytokines, vers le site de l'inflammation chronique. Apparemment, cet état de l'endomètre empêche la création d'une immunosuppression locale en période préimplantatoire, nécessaire à la formation d'une barrière protectrice et au rejet d'un fœtus à moitié étranger.
À cet égard, avant la grossesse, les femmes présentant des fausses couches à répétition doivent être diagnostiquées avec une endométrite chronique. Pour confirmer ou exclure ce diagnostic, une biopsie endométriale est réalisée le 7e ou le 8e jour du cycle menstruel, avec examen histologique, PCR et bactériologique du matériel utérin. Une fois le diagnostic confirmé, l'endométrite chronique est traitée conformément aux normes de traitement des maladies inflammatoires des organes pelviens.

