Expert médical de l'article
Nouvelles publications
Atrophie faciale progressive
Dernière revue: 05.07.2025

Tout le contenu iLive fait l'objet d'un examen médical ou d'une vérification des faits pour assurer autant que possible l'exactitude factuelle.
Nous appliquons des directives strictes en matière d’approvisionnement et ne proposons que des liens vers des sites de médias réputés, des instituts de recherche universitaires et, dans la mesure du possible, des études évaluées par des pairs sur le plan médical. Notez que les nombres entre parenthèses ([1], [2], etc.) sont des liens cliquables vers ces études.
Si vous estimez qu'un contenu quelconque de notre contenu est inexact, obsolète ou discutable, veuillez le sélectionner et appuyer sur Ctrl + Entrée.
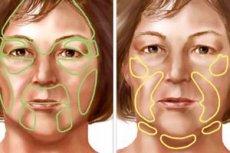
Dans la littérature, cette maladie est connue sous deux termes: atrophie faciale progressive hémisphérique (hemiatrophia faciei progressiva) et atrophie faciale progressive bilatérale (atrophia faciei progressiva bilateralis).
De plus, une atrophie hémisphérique et croisée du visage et du corps peut être observée.
Causes atrophie faciale progressive
On suppose que la maladie peut être causée par un traumatisme du crâne ou du visage, une infection générale ou locale, la syphilis, la syringomyélie, une lésion de la paire V ou VII de nerfs crâniens, une extirpation ou une blessure du tronc sympathique cervical, etc. Certains auteurs admettent la possibilité d'une hémiatrophie du visage, associée à une hémiatrophie du corps due à une dystrophie des parties diencéphaliques du système nerveux autonome.
Il existe des cas d'hémiatrophie après une encéphalite épidémique, ainsi qu'en cas de tuberculose pulmonaire ayant affecté le tronc sympathique cervical.
Selon les données disponibles, l'atrophie faciale progressive est, dans l'écrasante majorité des cas, un syndrome associé à diverses maladies, dans lequel le système nerveux autonome est impliqué à différents niveaux du processus pathologique. De toute évidence, les traumatismes et d'autres facteurs ne sont qu'un facteur favorisant le développement de ces graves phénomènes neurodystrophiques.
Symptômes atrophie faciale progressive
Les patients se plaignent généralement que la moitié affectée du visage est plus petite que la moitié saine; la différence de volume de la partie faciale du crâne et des tissus mous augmente progressivement; du côté affecté, la peau est de couleur tremble foncé, amincie et se rassemble en de nombreux plis lors du sourire.
Parfois, les patients notent une douleur de picotement dans la zone de la joue affectée ou dans toute la moitié du visage, un larmoiement de l'œil du côté affecté, en particulier par temps froid, par vent, et une différence de couleur des joues, particulièrement perceptible par temps froid.
Dans l'hémiatrophie sévère, une moitié du visage semble appartenir à une personne extrêmement émaciée par la famine ou une intoxication cancéreuse, tandis que l'autre moitié appartient à une personne en bonne santé. La peau du côté affecté est gris-jaunâtre ou brunâtre et ne rougit pas. La fente palpébrale est élargie en raison de l'affaissement de la paupière inférieure.
En appuyant sur les foramens supra-orbitaires, infra-orbitaires et mentaux, une douleur apparaît.
Le réflexe cornéen est réduit, mais les pupilles sont uniformément dilatées et réagissent de manière égale à la lumière.
La peau amincie ressemble à du parchemin; l'atrophie s'étend également au tissu sous-cutané, aux muscles masticateurs et temporaux et au tissu osseux (mâchoire, os zygomatique et arcade zygomatique).
Le menton est déplacé vers le côté affecté, car la taille du corps et la branche de la mâchoire inférieure sont réduites, cela est particulièrement prononcé chez les patients souffrant d'hémiatrophie du visage depuis l'enfance; la moitié du nez est également réduite, l'oreillette est ridée.
Dans certains cas, l'hémiatrophie du visage est associée à une atrophie de la même moitié du corps, et parfois à une atrophie du côté opposé du corps (hémiatrophie cruciata), à une sclérodermie unilatérale ou à un dépôt excessif de pigments dans la peau, à une croissance altérée ou à une dépigmentation des cheveux, à une hémiatrophie de la langue, du palais mou et des processus alvéolaires, à des caries et à une perte de dents, ainsi qu'à une transpiration altérée.
Ayant atteint un degré ou un autre, l'hémiatrophie faciale s'arrête, se stabilise et ne progresse plus.
Les examens cliniques et physiologiques de ce groupe de patients ont montré que dans toutes les formes d'atrophie faciale progressive, il existe, à des degrés divers, des troubles prononcés de la fonction du système nerveux autonome.
Chez les patients atteints de dystrophie faciale unilatérale, une asymétrie des potentiels électriques et de la température cutanée est généralement détectée, avec une prédominance du côté affecté.
Dans la plupart des cas, on observe une diminution de l'indice oscillographique et un spasme des capillaires du côté affecté, ce qui indique la prédominance du tonus du système nerveux sympathique.
Presque tous les patients présentent des modifications à l'électroencéphalogramme, caractéristiques d'une atteinte des formations hypothalamo-mésencéphaliques du cerveau. Les examens électromyographiques révèlent presque systématiquement des modifications de l'activité électrique des muscles du côté de la dystrophie, y compris lorsque des manifestations atrophiques tissulaires sont cliniquement observées.
Sur la base d’un ensemble de données de recherche cliniques et physiologiques, LA Shurinok identifie deux stades d’atrophie faciale: progressive et stationnaire.
Diagnostics atrophie faciale progressive
L'hémiatrophie faciale doit être différenciée de l'asymétrie du sous-développement congénital (non progressif) du visage, de l'hémi-hypertrophie faciale, ainsi que du torticolis musculaire, de la sclérodermie focale, de l'atrophie tissulaire des lipodystrophies et de la dermatomyosite. Ces dernières maladies sont abordées dans les cours d'orthopédie générale et de dermatologie.
Traitement atrophie faciale progressive
Les méthodes chirurgicales de traitement de l'atrophie faciale progressive ne sont autorisées qu'après arrêt ou inhibition de la progression du processus, c'est-à-dire à son deuxième stade. À cette fin, un traitement médicamenteux et physiothérapeutique complexe, associé à un blocage vago-sympathique et, parfois, à un blocage du ganglion cervico-thoracique, est recommandé.
Pour améliorer le métabolisme tissulaire, des vitamines (thiamine, pyridoxine, cyanocobalamine, acétate de tocophérol), de l'aloès, du corps vitré ou de la lidase doivent être prescrits pendant 20 à 30 jours. Afin de stimuler le métabolisme musculaire, de l'ATP est administrée par voie intramusculaire à raison de 1 à 2 ml pendant 30 jours. La thiamine contribue à normaliser le métabolisme des glucides, ce qui augmente la quantité d'ATP (formée par phosphorylation oxydative dans les mitochondries). La cyanocobalamine, le nérobol et le rétabolil contribuent à normaliser le métabolisme des protéines.
Pour influencer les parties centrales et périphériques du système nerveux autonome (SNA), on combine l'électrophorèse des ganglions sympathiques cervicaux, un collier galvanique, l'électrophorèse endonasale avec une solution à 2% de chlorure de calcium ou de diphenhydramine (7-10 séances), l'UHF sur la région hypothalamique (6-7 séances) et un demi-masque galvanique avec lidase (n° 7-8).
Il est nécessaire d’exclure les sources d’irritation provenant du foie, de l’estomac, des organes pelviens, etc.
En cas d'augmentation du tonus sympathique et de faiblesse simultanée des divisions parasympathiques du système nerveux, il est recommandé d'associer des médicaments sympatholytiques et cholinomimétiques, en tenant compte du niveau de lésion: en cas de lésion des structures végétatives centrales, des agents adrénolytiques centraux sont prescrits (chlorpromazine, oxazil, réserpine, etc.); les ganglions sont mieux traités par des ganglioplégiques (pachycarpine, hexonium, pentamine, gangleron, etc.). Lorsque les divisions périphériques et centrales du système nerveux central sont impliquées, des antispasmodiques tels que la papavérine, le dibazol, l'euphylline, la platiphylline, la khelline, la spasmolytine et l'acide nicotinique sont utilisés.
Le tonus sympathique est réduit en limitant l'apport en protéines et en graisses dans l'alimentation; pour renforcer l'effet parasympathique, on prescrit de l'acétylcholine, du carbachol, ainsi que des anticholinestérasiques (par exemple, prosérine, oxamizine, mestinone) et des antihistaminiques (diphenhydramine, pipolfène, suprastine). De plus, une alimentation riche en glucides, un climat frais de montagne ou de mer, des bains de dioxyde de carbone (37 °C) et d'autres méthodes prescrites par les neurologues sont indiqués (LA Shurinok, 1975).
Grâce au traitement préopératoire conservateur, le processus se stabilise, bien que l'atrophie reste généralement exprimée extérieurement.
Les myogrammes des muscles faciaux montrent une augmentation de leur activité bioélectrique, une diminution voire une disparition de l'asymétrie des indicateurs de l'état du système nerveux autonome, une diminution dans un certain nombre de cas (formes initiales de la maladie) des valeurs des potentiels électriques de la peau du visage, et la disparition des perturbations de la thermotopographie de la peau.
Méthodes de traitement chirurgical de l'atrophie faciale progressive
Les principales méthodes de traitement chirurgical de l’atrophie faciale sont les suivantes.
- Injections de paraffine sous la peau de la joue atrophiée. En raison de risques de thrombose et d'embolie vasculaire, les chirurgiens n'utilisent pas actuellement cette méthode.
- Greffe de tissu sous-cutané (en raison de son plissement progressif et irrégulier, elle n'a pas non plus trouvé une large application).
- L'introduction d'explants en plastique permet de corriger l'asymétrie faciale au repos, tout en immobilisant le côté affecté et en altérant la symétrie du sourire. Les patients sont également insatisfaits de la rigidité du plastique, situé à des endroits habituellement mous et malléables. À cet égard, l'implantation de plastiques poreux est plus prometteuse, mais les résultats de leur utilisation sont peu convaincants dans la littérature. Il est également recommandé d'utiliser des explants en silicone, qui présentent une inertie biologique et une élasticité stable.
- L'implantation de cartilage écrasé et de base de tissu conjonctif de la tige de Filatov sous la peau présente presque les mêmes inconvénients: rigidité (cartilage), capacité à immobiliser le visage (cartilage, tige).
- Réimplantation d'un lambeau cutané désépidermisé et sans tissu sous-cutané ou de la couche protéique d'un testicule de taureau en utilisant les méthodes de Yu. I. Vernadsky.
Correction des contours du visage selon la méthode de Yu. I. Vernadsky
Une incision est pratiquée dans la région sous-mandibulaire, à travers laquelle la peau, préalablement « soulevée » avec une solution de novocaïne à 0,25 %, est décollée à l'aide de grands ciseaux Cooper courbés à bouts émoussés ou d'une râpe spéciale à long manche.
Après avoir tassé et pressé la poche ainsi créée de l'extérieur, les contours du futur greffon sont dessinés sur la face antérieure de l'abdomen, sous anesthésie locale, à l'aide d'un gabarit en plastique préalablement préparé. Dans la zone délimitée (avant la prise du greffon), la peau est désépidermisée, puis le lambeau est séparé en veillant à ne pas emprisonner le tissu sous-cutané.
Après avoir pris le lambeau sur des fils en plastique (supports), leurs extrémités sont enfilées dans le chas de 3 ou 4 aiguilles droites épaisses (« gypsy »). À l'aide de ces aiguilles, les extrémités des supports sont tirées dans la plaie sous-cutanée du visage. Elles sont ensuite extraites des arcades supérieures et latérales de la plaie et attachées sur de petits rouleaux d'iodoforme. De cette façon, le greffon cutané semble tendu sur toute la surface de la plaie sous-cutanée. Grâce à sa surface cicatricielle des deux côtés, le greffon se développe sur la peau et les tissus sous-cutanés à l'intérieur de la poche de la plaie.
Aux endroits où la dépression des joues est la plus prononcée, le lambeau est doublé ou posé en trois couches en cousant une sorte de « patch » – une duplication du lambeau principal. L'effet esthétique de cette méthode est remarquable: l'asymétrie faciale est éliminée; la mobilité de la moitié affectée du visage, bien que réduite, n'est pas complètement paralysée.
Pendant et après l'opération, il n'y a généralement pas de complications (sauf en cas d'infection entraînant le rejet du greffon ou de l'explant). Cependant, avec le temps, une certaine atrophie de la peau transplantée (ou d'autres matériaux biologiques) se produit et une nouvelle couche doit être ajoutée. Chez certains patients, après la transplantation d'autoskin dépidermisé, des kystes sébacés progressivement plus volumineux se développent. Dans ce cas, il est recommandé de perforer la peau au-dessus du site d'accumulation graisseuse (à 2 ou 3 endroits) avec une aiguille d'injection épaisse et de la faire sortir par les perforations. La cavité vide est ensuite lavée à l'alcool éthylique à 95 % afin de dénaturer les cellules activées des glandes sébacées; une partie de l'alcool est laissée dans la cavité sous un pansement compressif appliqué pendant 3 à 4 jours.
Pour éviter la formation de kystes sébacés (athéromes) et de traumatismes supplémentaires, il est conseillé d'utiliser la couche protéique d'un testicule de taureau au lieu de l'autoderme, qui est perforée avec un scalpel en damier et injectée sous la peau de la zone affectée du visage (de la même manière que l'autoderme).
 [ 19 ]
[ 19 ]
Correction du contour du visage à l'aide de la méthode AT Titova et NI Yarchuk
La chirurgie plastique de contour est réalisée en utilisant un fascia large allogénique préservé de la cuisse, en le greffant en une ou deux couches ou en forme d'accordéon (en le ondulé) si une quantité importante de matière plastique est nécessaire.
Un bandage compressif est appliqué sur le visage pendant 2,5 à 3 semaines.
2 à 3 jours après l'opération, une fluctuation est déterminée dans la zone de transplantation, causée non pas par l'accumulation de liquide sous la peau, mais par un gonflement de la greffe fasciale et une inflammation aseptique de la plaie.
Pour réduire l’enflure après la chirurgie, appliquez du froid sur la zone de transplantation pendant 3 jours et prenez de la diphénhydramine par voie orale à raison de 0,05 g 3 fois par jour pendant 5 à 7 jours.
Le gonflement postopératoire du greffon est dangereux lorsque l'incision pour former le lit et introduire le fascia est située directement au-dessus de la zone de transplantation. Cela peut entraîner une tension excessive sur les bords de la plaie, entraînant leur séparation et la chute d'une partie du fascia. Pour prévenir cette complication, les incisions cutanées doivent être situées en dehors de la zone de transplantation. Si cela se produit, il est possible, dès les premiers stades, de se limiter à retirer une partie du greffon fascial et de réaliser des sutures secondaires sur la plaie.
Si une infection se produit et qu’une inflammation se développe dans la plaie, la greffe entière doit être retirée.
Malgré le décollement tissulaire important lors de la transplantation de fascia, les hématomes sous-cutanés et les hémorragies intradermiques sont extrêmement rares, ce qui s'explique en partie par l'effet hémostatique du tissu fascial. Le risque de formation d'hématome est le plus élevé lors de l'élimination de déformations prononcées de la partie latérale du visage. Un décollement tissulaire important par une incision en avant du pavillon de l'oreille crée les conditions préalables à une accumulation de sang dans la partie inférieure fermée du lit formé. En cas de suspicion d'hématome, il est recommandé de créer un écoulement dans la partie inférieure de la plaie.
Complications
La complication la plus grave est la suppuration de la plaie chirurgicale, qui survient lorsque le greffon ou le site receveur s'infecte. Pour éviter cela, il est nécessaire de respecter scrupuleusement les règles d'asepsie lors de la préparation et de la transplantation des greffons fasciaux, en veillant à ne pas endommager la muqueuse buccale lors de la formation du site au niveau des joues et des lèvres.
L'apparition d'une communication entre la plaie chirurgicale et la cavité buccale pendant l'intervention chirurgicale est une contre-indication à la transplantation de fascia, de membrane protéique, etc. Une intervention répétée n'est autorisée qu'après plusieurs mois.
Français Considérant que le tissu adipeux sous-cutané de la plante du pied humain (dont l'épaisseur est de 5 à 25 mm), ainsi que le derme du pied, diffèrent fortement de la graisse et du derme d'autres zones, et qu'ils sont très résistants, denses, élastiques et ont de faibles propriétés antigéniques, NE Sel'skiy et al. (1991) recommandent cet allomatériau pour la chirurgie plastique du contour du visage. Après l'avoir utilisé chez 21 patients, les auteurs ont noté une suppuration et un rejet de la greffe chez 3 personnes. De toute évidence, il est nécessaire de continuer à étudier les résultats immédiats et à long terme de l'utilisation de ce matériau plastique, car, contrairement à la peau désépithélialisée d'autres zones, la peau plantaire est dépourvue de glandes sudoripares et sébacées, ce qui est très important (en termes de prévention de la formation de kystes).

