Nouvelles publications
Un système d'administration de médicaments en boucle fermée pourrait améliorer l'administration des chimiothérapies
Dernière revue: 02.07.2025

Tout le contenu iLive fait l'objet d'un examen médical ou d'une vérification des faits pour assurer autant que possible l'exactitude factuelle.
Nous appliquons des directives strictes en matière d’approvisionnement et ne proposons que des liens vers des sites de médias réputés, des instituts de recherche universitaires et, dans la mesure du possible, des études évaluées par des pairs sur le plan médical. Notez que les nombres entre parenthèses ([1], [2], etc.) sont des liens cliquables vers ces études.
Si vous estimez qu'un contenu quelconque de notre contenu est inexact, obsolète ou discutable, veuillez le sélectionner et appuyer sur Ctrl + Entrée.
Lorsque les patients atteints de cancer suivent une chimiothérapie, les doses de la plupart des médicaments sont calculées en fonction de la surface corporelle du patient. Celle-ci est estimée à l'aide d'une équation prenant en compte la taille et le poids du patient. Cette équation a été formulée en 1916 à partir des données de neuf patients seulement.
Cette approche simplifiée du dosage ne prend pas en compte d'autres facteurs et peut entraîner une administration excessive ou insuffisante d'un médicament. Par conséquent, certains patients peuvent présenter une toxicité inutile ou une efficacité insuffisante de la chimiothérapie qu'ils reçoivent.
Pour améliorer la précision du dosage de la chimiothérapie, les ingénieurs du MIT ont développé une approche alternative permettant de personnaliser la dose pour chaque patient. Leur système mesure la quantité de médicament présente dans l'organisme du patient et transmet ces données à un contrôleur capable d'ajuster le débit de perfusion en conséquence.
Cette approche pourrait aider à compenser les différences dans la pharmacocinétique des médicaments causées par la composition corporelle, la prédisposition génétique, la toxicité organique induite par la chimiothérapie, les interactions avec d’autres médicaments et aliments, et les variations circadiennes dans les enzymes responsables de la dégradation des médicaments de chimiothérapie, affirment les chercheurs.
« En reconnaissant les progrès dans la compréhension de la façon dont les médicaments sont métabolisés et en appliquant des outils d'ingénierie pour simplifier le dosage personnalisé, nous pensons que nous pouvons contribuer à transformer la sécurité et l'efficacité de nombreux médicaments », a déclaré Giovanni Traverso, professeur associé de génie mécanique au MIT, gastro-entérologue au Brigham and Women's Hospital et auteur principal de l'étude.
Louis DeRidder, étudiant diplômé du MIT, est l'auteur principal de l'article publié dans la revue Med.
Surveillance continue
Dans cette étude, les chercheurs se sont concentrés sur un médicament appelé 5-fluorouracile, utilisé pour traiter le cancer colorectal et d'autres cancers. Ce médicament est généralement administré sur une période de 46 heures, et sa posologie est déterminée à l'aide d'une formule basée sur la taille et le poids du patient, ce qui donne une estimation de sa surface corporelle.
Cependant, cette approche ne tient pas compte des différences de composition corporelle, qui peuvent affecter la distribution du médicament dans l'organisme, ni des variations génétiques qui influencent son métabolisme. Ces différences peuvent entraîner des effets secondaires nocifs en cas d'administration excessive du médicament. Une dose insuffisante peut entraîner une élimination tumorale insuffisante.
« Les personnes ayant la même surface corporelle peuvent avoir des tailles et des poids très différents, une masse musculaire différente ou une génétique différente, mais tant que la taille et le poids intégrés à cette équation donnent la même surface corporelle, leur dose est identique », explique DeRidder, doctorant au programme de génie médical et de physique médicale du programme Harvard-MIT en sciences de la santé et technologie.
Un autre facteur pouvant modifier la quantité de médicament dans le sang à un moment donné est la variation circadienne d'une enzyme appelée dihydropyrimidine déshydrogénase (DPD), qui dégrade le 5-fluorouracile. L'expression de la DPD, comme de nombreuses autres enzymes de l'organisme, est régulée par un rythme circadien. Ainsi, la dégradation du 5-FU par la DPD n'est pas constante, mais varie selon l'heure de la journée. Ces rythmes circadiens peuvent entraîner une variation d'un facteur dix de la quantité de 5-FU dans le sang d'un patient pendant une perfusion.
« En utilisant la surface corporelle pour calculer la dose de chimiothérapie, nous savons que deux personnes peuvent présenter des toxicités très différentes dues au 5-fluorouracile. Un patient peut avoir des cycles de traitement avec une toxicité minimale, puis un cycle avec une toxicité terrible. La façon dont le patient métabolise la chimiothérapie a changé d'un cycle à l'autre. Notre méthode de dosage obsolète ne prend pas en compte ces changements, et les patients en souffrent », explique Douglas Rubinson, oncologue clinicien au Dana-Farber Cancer Institute et auteur de l'article.
Une façon de tenter de compenser la variabilité de la pharmacocinétique de la chimiothérapie est une stratégie appelée surveillance thérapeutique médicamenteuse, dans laquelle le patient fournit un échantillon de sang à la fin d'un cycle de traitement. Après analyse des concentrations de médicament dans cet échantillon, la posologie peut être ajustée, si nécessaire, au début du cycle suivant (généralement après deux semaines pour le 5-fluorouracile).
Il a été démontré que cette approche conduit à de meilleurs résultats pour les patients, mais elle n’a pas été largement utilisée pour les chimiothérapies telles que le 5-fluorouracile.
Les chercheurs du MIT souhaitaient développer un type de surveillance similaire, mais de manière automatisée, qui permettrait de personnaliser le dosage des médicaments en temps réel, ce qui pourrait conduire à de meilleurs résultats pour les patients.
Dans leur système en boucle fermée, les concentrations de médicament peuvent être surveillées en continu et ces informations sont utilisées pour ajuster automatiquement le débit de perfusion du médicament de chimiothérapie afin de maintenir la dose dans la plage cible.
Ce système en boucle fermée permet de personnaliser le dosage des médicaments afin de prendre en compte les rythmes circadiens des niveaux d'enzymes métabolisant les médicaments, ainsi que tout changement dans la pharmacocinétique du patient depuis le dernier traitement, comme la toxicité organique induite par la chimiothérapie.
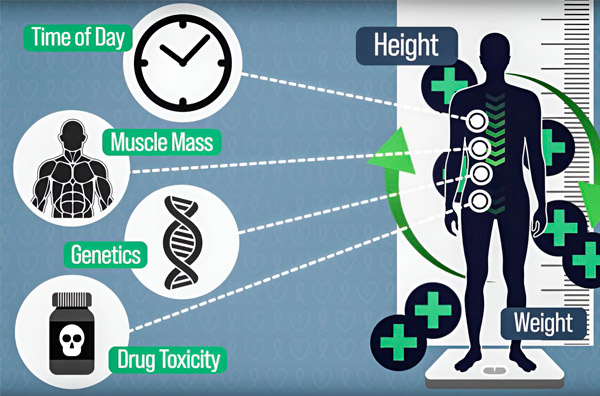
Pour optimiser la précision du dosage de la chimiothérapie, des ingénieurs du MIT ont mis au point un système permettant de mesurer en continu la quantité de médicament présente dans l'organisme d'un patient pendant une perfusion de plusieurs heures. Cela permettra de compenser les différences liées à la composition corporelle, à la génétique, à la toxicité des médicaments et aux fluctuations circadiennes. Source: Avec l'aimable autorisation des chercheurs.
Le nouveau système développé par les chercheurs, baptisé CLAUDIA (Closed-Loop AUtomated Drug Infusion regulAtor), utilise un équipement disponible dans le commerce pour chaque étape. Des échantillons de sang sont prélevés toutes les cinq minutes et rapidement préparés pour analyse. La concentration sanguine de 5-fluorouracile est mesurée et comparée à la plage cible.
La différence entre les concentrations cibles et mesurées est entrée dans un algorithme de contrôle, qui ajuste ensuite le débit de perfusion si nécessaire pour maintenir la dose dans la plage de concentrations à laquelle le médicament est efficace et non toxique.
« Nous avons développé un système qui nous permet de mesurer en continu la concentration du médicament et d'ajuster le débit de perfusion en conséquence pour maintenir la concentration du médicament dans la fenêtre thérapeutique », explique DeRidder.
Réglage rapide
Lors de tests sur des animaux, les chercheurs ont découvert qu’en utilisant CLAUDIA, ils pouvaient maintenir la quantité de médicament circulant dans le corps dans la plage cible environ 45 % du temps.
Chez les animaux traités par chimiothérapie sans CLAUDIA, les concentrations de médicament ne sont restées dans la fourchette cible que 13 % du temps en moyenne. Les chercheurs n'ont pas testé l'efficacité des concentrations de médicament dans cette étude, mais le maintien des concentrations dans la fourchette cible est considéré comme permettant d'obtenir de meilleurs résultats et une toxicité moindre.
CLAUDIA a également permis de maintenir la dose de 5-fluorouracile dans la plage cible, même après l'administration d'un médicament inhibant l'enzyme DPD. Chez les animaux ayant reçu cet inhibiteur sans surveillance ni ajustement continus, les taux de 5-fluorouracile ont été multipliés par huit.
Pour cette démonstration, les chercheurs ont réalisé manuellement chaque étape du processus à l’aide d’équipements disponibles dans le commerce, mais prévoient désormais d’automatiser chaque étape afin que la surveillance et les ajustements de dose puissent être effectués sans intervention humaine.
Pour mesurer les concentrations de médicaments, les chercheurs ont utilisé la chromatographie liquide à haute performance couplée à la spectrométrie de masse (HPLC-MS), une technique qui peut être adaptée pour détecter presque n’importe quel type de médicament.
« Nous voyons un avenir où nous pourrons utiliser CLAUDIA pour tout médicament possédant les propriétés pharmacocinétiques appropriées et détectable par HPLC-MS, permettant un dosage personnalisé pour de nombreux médicaments différents », explique DeRidder.
