Nouvelles publications
Un nouveau dispositif améliore la production de cellules souches pour le traitement de la maladie d'Alzheimer
Dernière revue: 02.07.2025

Tout le contenu iLive fait l'objet d'un examen médical ou d'une vérification des faits pour assurer autant que possible l'exactitude factuelle.
Nous appliquons des directives strictes en matière d’approvisionnement et ne proposons que des liens vers des sites de médias réputés, des instituts de recherche universitaires et, dans la mesure du possible, des études évaluées par des pairs sur le plan médical. Notez que les nombres entre parenthèses ([1], [2], etc.) sont des liens cliquables vers ces études.
Si vous estimez qu'un contenu quelconque de notre contenu est inexact, obsolète ou discutable, veuillez le sélectionner et appuyer sur Ctrl + Entrée.

Des chercheurs suédois affirment avoir perfectionné une technique permettant de convertir des cellules cutanées ordinaires en cellules souches neurales, ce qui, selon eux, les rapproche de thérapies cellulaires personnalisées abordables pour les maladies d'Alzheimer etde Parkinson.
À l’aide d’un dispositif microfluidique conçu sur mesure, l’équipe de recherche a développé une approche inédite et accélérée pour reprogrammer les cellules cutanées humaines en cellules souches pluripotentes induites (iPSC), puis les convertir en cellules souches neurales.
Saumya Jain, premier auteur de l'étude, affirme que la plateforme pourrait améliorer et réduire le coût de la thérapie cellulaire en rendant les cellules plus compatibles et mieux acceptées par l'organisme du patient. L'étude a été publiée dans la revue Advanced Science par des scientifiques du KTH Royal Institute of Technology.
Anna Herland, auteur principal de l'étude, a déclaré que l'étude démontrait la première utilisation de la microfluidique pour diriger les iPSC pour devenir des cellules souches neurales.
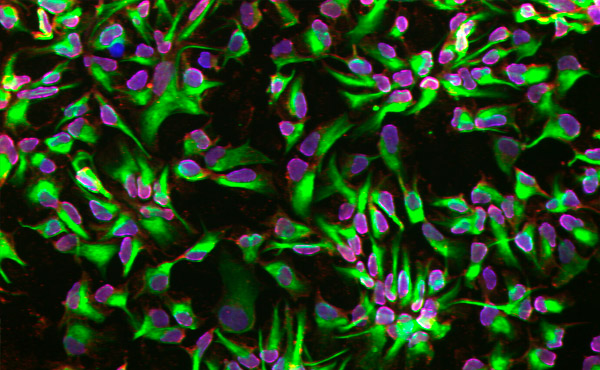
Cellules souches neurales différenciées grâce à une plateforme microfluidique. Photo: KTH Royal Institute of Technology
La transformation de cellules normales en cellules souches neurales se déroule en deux étapes. Tout d'abord, les cellules sont exposées à des signaux biochimiques qui les induisent à devenir des cellules souches pluripotentes (CSPi), capables de générer différents types de cellules.
Elles sont ensuite transférées dans une culture qui reproduit les signaux et les processus de développement impliqués dans la formation du système nerveux. Cette étape, appelée différenciation neuronale, réoriente les cellules vers le stade de cellules souches neurales.
Au cours de la dernière décennie, l'environnement de laboratoire pour ce type de travaux est progressivement passé des tablettes traditionnelles aux dispositifs microfluidiques. Herland affirme que la nouvelle plateforme représente une amélioration de la microfluidique pour les deux étapes: la génération d'iPSC et la différenciation des cellules souches neurales.
En utilisant des cellules provenant de biopsies de peau humaine, les chercheurs ont découvert que la plateforme microfluidique accélérait l’engagement des cellules dans un destin neuronal à un stade plus précoce par rapport à celles différenciées dans des plaques conventionnelles.
« Nous avons démontré que l’environnement confiné de la plateforme microfluidique améliore l’engagement à générer des cellules souches neurales », explique Herland.
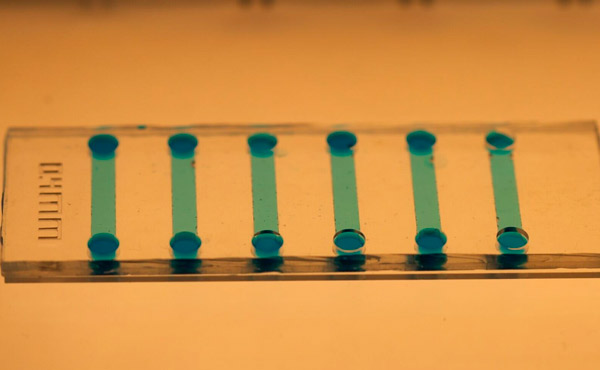
Gros plan de la puce microfluidique utilisée pour induire des cellules souches. Photo: KTH Royal Institute of Technology
Jain affirme que la puce microfluidique est facile à fabriquer à l'aide de polydiméthylsiloxane (PDMS) et que sa taille microscopique permet de réaliser des économies importantes sur les réactifs et le matériel cellulaire.
La plateforme peut être facilement modifiée pour permettre la différenciation en d'autres types cellulaires, ajoute-t-il. Elle est automatisable, offrant ainsi un système fermé garantissant la cohérence et la fiabilité de la production de populations cellulaires hautement homogènes.
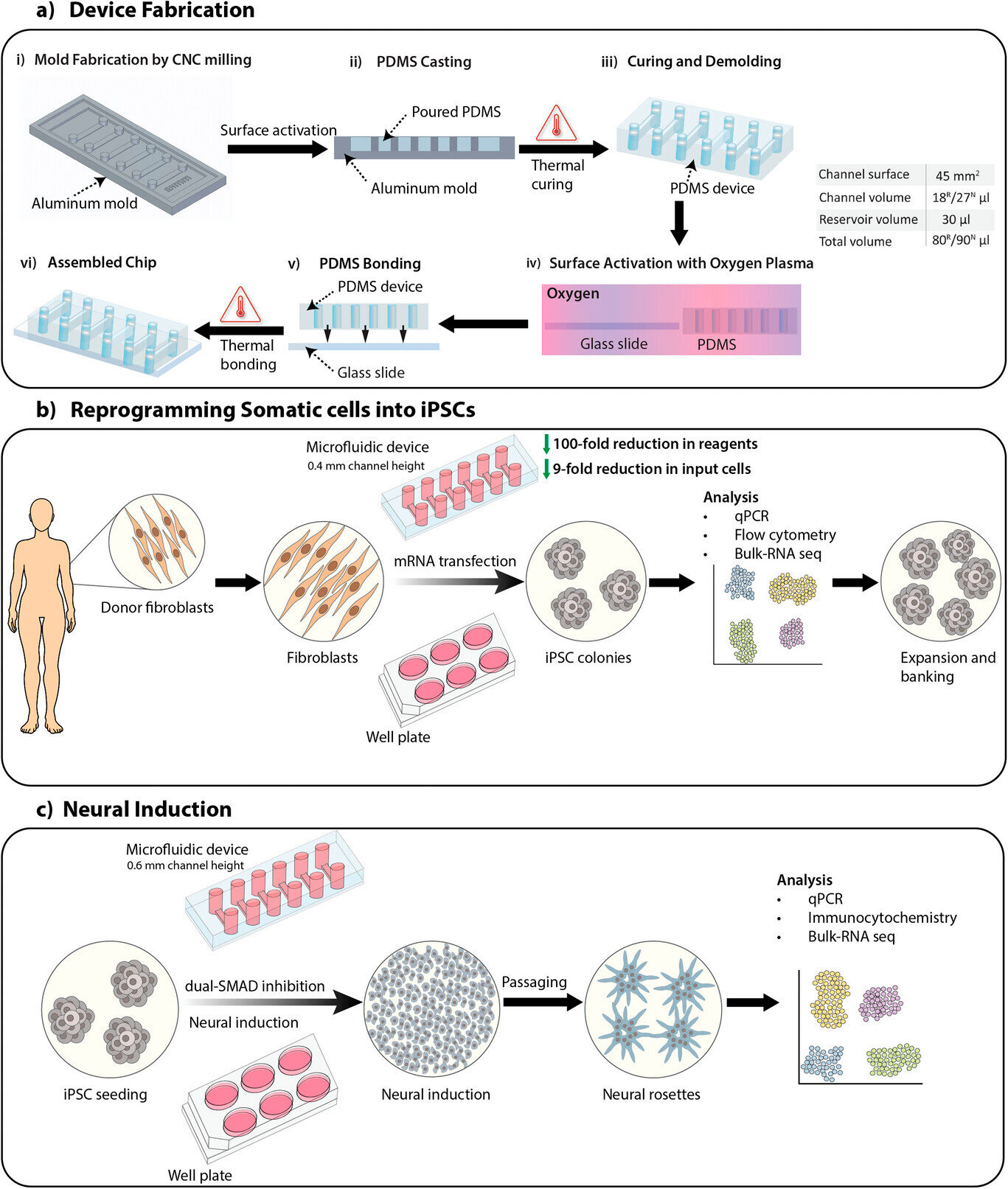
Présentation de l'étude, incluant la fabrication du dispositif, la reprogrammation de cellules somatiques en cellules souches pluripotentes induites (CSPi) et l'induction neurale de CSPi par le protocole de double inhibition SMAD pour générer des cellules souches neurales.
A) Procédé de fabrication d'un dispositif microfluidique avec des canaux de 0,4 mm et 0,6 mm de haut pour la reprogrammation (R) et l'induction neurale (N) des cellules somatiques, respectivement. Les volumes des canaux et le volume total sont indiqués dans le tableau.
B) Présentation du processus de reprogrammation de cellules somatiques en CSPi sur des dispositifs et plaques microfluidiques par transfection d'ARNm.
C) Présentation du processus d'induction neurale de CSPi en cellules souches neurales sur des dispositifs et plaques microfluidiques par le protocole de double inhibition SMAD.
Source: Advanced Science (2024). DOI: 10.1002/advs.202401859
« Il s’agit d’une étape vers l’accessibilité des thérapies cellulaires personnalisées pour les maladies d’Alzheimer et de Parkinson », ajoute Jain.
L'étude a également impliqué des scientifiques du Karolinska Institutet et de l'Université de Lund, collaborant au sein du consortium IndiCell.
