Nouvelles publications
Le médicament LM11A-31 ralentit la progression de la maladie d'Alzheimer lors d'un essai clinique
Dernière revue: 02.07.2025

Tout le contenu iLive fait l'objet d'un examen médical ou d'une vérification des faits pour assurer autant que possible l'exactitude factuelle.
Nous appliquons des directives strictes en matière d’approvisionnement et ne proposons que des liens vers des sites de médias réputés, des instituts de recherche universitaires et, dans la mesure du possible, des études évaluées par des pairs sur le plan médical. Notez que les nombres entre parenthèses ([1], [2], etc.) sont des liens cliquables vers ces études.
Si vous estimez qu'un contenu quelconque de notre contenu est inexact, obsolète ou discutable, veuillez le sélectionner et appuyer sur Ctrl + Entrée.

Dans une étude récente publiée dans la revue Nature Medicine, des scientifiques ont mené une étude de phase 2a randomisée, en double aveugle et contrôlée par placebo pour examiner l'innocuité et l'efficacité du LM11A-31 dans le traitement de la maladie d'Alzheimer (MA) par modulation du récepteur de la neurotrophine p75 (p75NTR).
La MA à début tardif est la forme la plus courante de démence, caractérisée par une défaillance synaptique, une dégénérescence et une perte de cellules nerveuses. Bien que les deux principaux médicaments utilisés pour le traitement de la MA ciblent l'accumulation de protéines amyloïdes-β ou tau anormales, ils ne traitent qu'une partie de la physiopathologie. Une autre approche consiste à cibler les récepteurs et les réseaux de signalisation qui influencent les voies biologiques fondamentales. Des études précliniques montrent que la modulation de p75NTR par une nouvelle petite molécule chimique, LM11A-31, réduit la perte synaptique causée par les protéines amyloïdes et tau anormales.
Description de l'étude
Dans cet essai clinique randomisé, les chercheurs ont examiné si le LM11A-31 pouvait ralentir la progression de la maladie d'Alzheimer en modulant le p75NTR chez l'homme.
Français Les participants à l'étude ont reçu des capsules orales de LM11A-31 à des doses de 200 mg et 400 mg ou un placebo dans un rapport 1:1:1 à 242 patients souffrant d'asthme léger à modéré pendant 26 semaines. Les participants avaient une maladie d'Alzheimer biologiquement confirmée (taux de protéine β-amyloïde 42 (Aβ42) dans le liquide céphalorachidien inférieur à 550 ng/L ou rapport Aβ42:β40 inférieur à 0,89) diagnostiquée selon les critères de McKhann, avec des scores au Mini-Psychiatric Examination (MMSE) de 18 à 26, des scores à l'échelle de dépression gériatrique (GDS) inférieurs à 5,0, des scores à l'échelle ischémique de Hachinski modifiée (HIS) ≤ 4,0, une éducation formelle ≥ 8 ans et un déclin cognitif antérieur ≥ 6 mois.
Les participants admissibles avaient pris des inhibiteurs de l'acétylcholinestérase (IAchE) ou des antagonistes partiels des récepteurs NMDA pendant ≥ 3 mois avant leur inclusion dans l'étude. Ils n'avaient pas pris de drogues illicites telles que des antipsychotiques, des benzodiazépines, des antiépileptiques, des sédatifs, des antihypertenseurs centraux, des nootropes (à l'exception du ginkgo biloba) ou des analgésiques contenant des opioïdes.
Le critère d'évaluation principal de l'étude était la sécurité et la tolérance, évaluées à l'aide de l'échelle Columbia d'évaluation de la gravité des pensées et comportements suicidaires (C-SSRS), des signes vitaux, de la tension artérielle et des paramètres hématologiques. L'imagerie par résonance magnétique structurale (IRMc), la tomographie par émission de positons au fluorodésoxyglucose (TEP-FDG) et les biomarqueurs du liquide céphalorachidien (LCR) ont été utilisés pour évaluer les critères cognitifs secondaires. Les mesures de la MA comprenaient la protéine tau phosphorylée Thr181, la protéine tau totale, les activités Aβ40, Aβ42 et AChE. L'équipe a utilisé un test neuropsychologique personnalisé pour évaluer les critères cognitifs secondaires au départ, aux semaines 12 et 26.
Résultats de la recherche
L'étude a révélé que le LM11A-31 était sûr et bien toléré, sans aucun problème de sécurité significatif. Les effets indésirables les plus fréquents étaient les céphalées, la diarrhée, l'éosinophilie et la rhinopharyngite, les troubles gastro-intestinaux et l'éosinophilie étant les principaux motifs d'arrêt du traitement. Les arrêts de traitement ont été plus fréquents dans le groupe 400 mg que dans les groupes 200 mg et placebo. L'IRM n'a révélé aucun problème de sécurité, notamment d'anomalies liées à la protéine amyloïde. Aucune différence significative n'a été observée entre les deux groupes de traitement en termes de scores cognitifs ou d'anomalies amyloïdes.
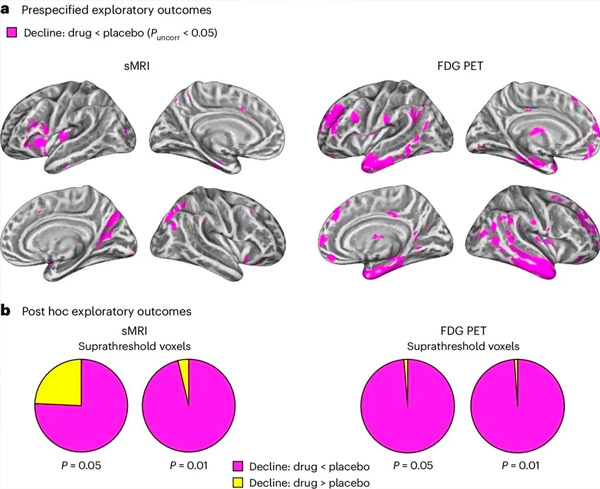
A. Une analyse de covariance par modèles mixtes à deux facteurs a examiné les interactions entre le traitement (médicament ou placebo) et le temps (avant ou après traitement). Un contraste t unilatéral examinant l'hypothèse d'interaction (le médicament ralentit la progression par rapport au placebo) a montré que le traitement par LM11A-31 ralentissait la dégénérescence longitudinale (panneaux de gauche) et l'hypométabolisme du glucose (panneaux de droite) dans le groupe médicament (IRMc, n = 127; TEP, n = 121) par rapport au groupe placebo (IRMc, n = 66; TEP, n = 62). Les voxels montrant cette interaction sont présentés à un seuil non corrigé de p < 0,05 (magenta) sur une surface corticale spécifique à la population. Les hémisphères gauche et droit sont représentés respectivement dans les lignes supérieure et inférieure. Les régions cérébrales montrant des interactions incompatibles avec l'hypothèse sont présentées dans la figure 7 des données supplémentaires.
B. Nombre total de voxels dans les régions cérébrales vulnérables prédéfinies de la MA (surface totale des diagrammes circulaires) montrant soit une interaction conforme à l'hypothèse (magenta), soit une interaction incompatible avec l'hypothèse (jaune) dans chaque modalité d'imagerie (IRMc, panneau de gauche; TEP au FDG, panneau de droite) à des seuils de plus en plus libéraux de P non corrigé < 0,01 et P < 0,05. Les simulations de Monte Carlo ont montré que les ratios de voxels montrant des effets conformes à l'hypothèse par rapport à ceux incompatibles avec l'hypothèse étaient significativement plus élevés que ceux observés sur la base de données générées aléatoirement pour l'IRMc et la TEP (P < 0,001 pour chaque modalité; test bilatéral).
Le LM11A-31 a efficacement réduit l'augmentation des taux d'Aβ42 et d'Aβ40 dans le LCR par rapport au groupe placebo. Le médicament a également montré une réduction de la variation annuelle médiane en pourcentage du biomarqueur protéique présynaptique SNAP25 et une diminution du biomarqueur postsynaptique NG, indiquant un ralentissement de la perte des connexions présynaptiques et postsynaptiques. Le LM11A-31 a également réduit l'augmentation de YKL40, entraînant une diminution des scores MMSE et une augmentation des scores ADAS-Cog-13. Le médicament a également réduit la perte de matière grise dans le lobe frontal et le cortex pariétal postérieur, ainsi qu'une diminution du métabolisme du glucose dans des zones telles que le cortex entorhinal, le cortex temporal, l'hippocampe, le cortex insulaire et le cortex préfrontal.
Conclusion
L'étude a conclu que la modulation de p75NTR par LM11A-31 est adaptée à des essais cliniques de plus grande envergure. LM11A-31 a satisfait au critère principal de sécurité et a été bien toléré chez les patients atteints de MA légère à sévère. Ces résultats indiquent la nécessité de mener d'autres études, avec des durées de traitement plus longues, afin d'évaluer le potentiel des petites molécules à réguler p75NTR comme traitement modificateur de la maladie dans la MA. L'étude a montré que LM11A-31 affectait significativement plusieurs biomarqueurs, notamment Aβ40, Aβ42, SNAP25, NG et YKL40, indiquant un ralentissement de la progression pathologique. Des études ultérieures pourraient évaluer d'autres indicateurs de la santé gliale.
