Nouvelles publications
Une protéine clé identifiée pour prévenir la perte de masse osseuse dans l'ostéoporose
Dernière revue: 02.07.2025

Tout le contenu iLive fait l'objet d'un examen médical ou d'une vérification des faits pour assurer autant que possible l'exactitude factuelle.
Nous appliquons des directives strictes en matière d’approvisionnement et ne proposons que des liens vers des sites de médias réputés, des instituts de recherche universitaires et, dans la mesure du possible, des études évaluées par des pairs sur le plan médical. Notez que les nombres entre parenthèses ([1], [2], etc.) sont des liens cliquables vers ces études.
Si vous estimez qu'un contenu quelconque de notre contenu est inexact, obsolète ou discutable, veuillez le sélectionner et appuyer sur Ctrl + Entrée.
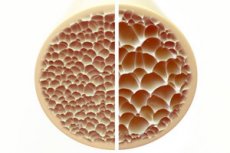
L'ostéoporose, une maladie caractérisée par des os poreux et fragiles, représente une menace importante pour la santé du squelette. Les os, principaux supports structurels du corps humain, fournissent un soutien vital. La diminution de la masse osseuse altère non seulement ce soutien, mais aussi la fonction globale, entraînant une diminution de la qualité de vie.
L'incidence de l'ostéoporose augmentant avec le vieillissement de la population, la charge financière des soins de longue durée s'accroît. Il est donc nécessaire de comprendre les mécanismes qui contribuent au développement de l'ostéoporose et de développer des traitements ciblés et efficaces pour minimiser son impact à long terme.
Les ostéoblastes et les ostéoclastes sont deux types de cellules qui jouent un rôle essentiel dans le maintien et le remodelage du tissu osseux. Alors que les ostéoblastes sont des cellules ostéoformatrices responsables de la synthèse et du dépôt de nouveau tissu osseux, les ostéoclastes sont des cellules dégradantes impliquées dans la dégradation et l'élimination du tissu osseux ancien ou endommagé.
Une augmentation de la proportion d'ostéoclastes entraîne une perte osseuse dans des maladies telles que l'ostéoporose, la polyarthrite rhumatoïde (inflammation des articulations) et les métastases osseuses (cancer qui s'est propagé aux os). Les ostéoclastes résultent de la différenciation des macrophages ou des monocytes, qui sont des types de cellules immunitaires.
Ainsi, l'inhibition de la différenciation des ostéoclastes pourrait constituer une stratégie thérapeutique pour prévenir la perte osseuse. Cependant, les mécanismes moléculaires précis régulant le processus complexe de remodelage osseux restent flous.
Dans une nouvelle étude, le professeur Tadayoshi Hayata, M. Takuto Konno et Mme Hitomi Murachi de l'Université des sciences de Tokyo, en collaboration avec leurs collègues, ont étudié la régulation moléculaire de la différenciation des ostéoclastes. La stimulation par le ligand RANKL (récepteur activateur du facteur nucléaire kappa B) induit la différenciation des macrophages en ostéoclastes.
De plus, les voies de signalisation de la protéine morphogénétique osseuse (BMP) et du facteur de croissance transformant (TGF-β) ont été impliquées dans la régulation de la différenciation des ostéoclastes médiée par RANKL. Dans cette étude, les chercheurs ont cherché à étudier le rôle de Ctdnep1, une phosphatase (enzyme qui élimine les groupes phosphates) dont on a rapporté qu'elle inhibait les voies de signalisation de la BMP et du TGF-β.
L’étude est publiée dans la revue Biochemical and Biophysical Research Communications.
Le professeur Hayata déclare: « RANKL agit comme un accélérateur de la différenciation des ostéoclastes. Conduire une voiture nécessite non seulement un accélérateur, mais aussi des freins. Nous avons constaté ici que Ctdnep1 agit comme un frein dans la différenciation des ostéoclastes. »
Les chercheurs ont d'abord examiné l'expression de Ctdnep1 dans les macrophages de souris traités par RANKL et dans les cellules témoins non traitées. Ils ont observé que l'expression de Ctdnep1 ne changeait pas en réponse à la stimulation par RANKL. Cependant, elle était localisée dans le cytoplasme sous forme granulaire chez les macrophages et différenciée en ostéoclastes, contrairement à sa localisation périnucléaire normale chez d'autres types cellulaires, ce qui témoigne de sa fonction cytoplasmique dans la différenciation des ostéoclastes.
De plus, la réduction de Ctdnep1 (régulation négative de l'expression génique) a entraîné une augmentation du nombre d'ostéoclastes positifs pour la phosphatase acide résistante au tartrate (TRAP), où TRAP est un marqueur des ostéoclastes différenciés.
L'inactivation de Ctdnep1 a entraîné une augmentation de l'expression de marqueurs clés de la différenciation, dont « Nfatc1 », un facteur de transcription principal induit par RANKL pour la différenciation des ostéoclastes. Ces résultats corroborent l'hypothèse d'une fonction de freinage de Ctdnep1, qui régulerait négativement la différenciation des ostéoclastes. De plus, l'inactivation de Ctdnep1 a également entraîné une augmentation de l'absorption du phosphate de calcium, suggérant un rôle suppresseur de Ctdnep1 dans la résorption osseuse.
Enfin, bien que l'inactivation de Ctdnep1 n'ait pas altéré la signalisation BMP et TGF-β, les cellules déficientes en Ctdnep1 présentaient des taux accrus de protéines phosphorylées (activées), issues de la voie de signalisation RANKL. Ces résultats suggèrent que l'effet inhibiteur de Ctdnep1 sur la différenciation des ostéoclastes pourrait ne pas être médié par la signalisation BMP et TGF-β, mais par une régulation négative de la voie de signalisation RANKL et des taux de protéine Nfatc1.
Globalement, ces résultats apportent de nouvelles connaissances sur le processus de différenciation des ostéoclastes et identifient des cibles thérapeutiques potentielles pour le développement de traitements visant à réduire la perte osseuse due à l'hyperactivité des ostéoclastes. Outre les maladies caractérisées par une perte osseuse, Ctdnep1 a également été identifié comme un facteur causal du médulloblastome, une tumeur cérébrale infantile. Les auteurs sont optimistes quant à l'extension de leurs recherches à d'autres maladies humaines, au-delà du métabolisme osseux.
Le professeur Hayata conclut: « Nos résultats suggèrent que Ctdnep1 est nécessaire pour prévenir l'ostéoclastogenèse excessive. Ces résultats pourraient approfondir nos connaissances sur la manière dont le réseau de phosphorylation-déphosphorylation contrôle la différenciation des ostéoclastes et pourraient fournir de nouvelles stratégies thérapeutiques pour le traitement des maladies osseuses associées à une activité ostéoclastique excessive. »
