Nouvelles publications
« De l'oxygène pour les cellules »: un simple implant a permis de réduire le taux de sucre sans médicaments puissants
Dernière revue: 18.08.2025

Tout le contenu iLive fait l'objet d'un examen médical ou d'une vérification des faits pour assurer autant que possible l'exactitude factuelle.
Nous appliquons des directives strictes en matière d’approvisionnement et ne proposons que des liens vers des sites de médias réputés, des instituts de recherche universitaires et, dans la mesure du possible, des études évaluées par des pairs sur le plan médical. Notez que les nombres entre parenthèses ([1], [2], etc.) sont des liens cliquables vers ces études.
Si vous estimez qu'un contenu quelconque de notre contenu est inexact, obsolète ou discutable, veuillez le sélectionner et appuyer sur Ctrl + Entrée.
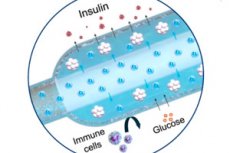
Un nouvel implant « d'oxygène » pour le traitement du diabète de type 1 a été décrit dans Nature Communications: un générateur électrochimique d'oxygène compact (iEOG) alimente en continu une macrocapsule contenant des cellules sécrétant de l'insuline en O₂. Ce système permet un compactage serré des îlots isolés (jusqu'à 60 000 IEQ/ml) et maintient leur viabilité et leur sécrétion même en cas de faible teneur en oxygène. Chez des rats diabétiques, le dispositif implanté sous la peau a maintenu une glycémie normale jusqu'à trois mois, sans immunosuppression. Les rats témoins, sans oxygène, sont restés hyperglycémiques.
Arrière-plan
- Le principal problème technique est l'oxygène. Dès que l'on « cache » les cellules derrière la membrane et que l'on place le dispositif sous la peau (extraction facile et pratique), elles manquent d'oxygène: la diffusion à travers la membrane et la zone peu vascularisée ne répond pas aux besoins des îlots « voraces ». D'où la mort prématurée, un travail insuffisant et la nécessité de réduire considérablement l'ensemencement, faute de quoi la capsule devient énorme.
- Pourquoi est-ce si difficile physiquement? L'oxygène ne traverse les tissus que sur de très courtes distances, et les cellules encapsulées ne possèdent pas de vaisseaux sanguins propres; pendant les premiers mois, leur vie repose uniquement sur la diffusion passive. Tout épaississement des matériaux ou compaction des cellules entraîne rapidement l'hypoxie au centre de la capsule.
- Qu'as-tu déjà essayé?
- Ils ont mis au point des macrodispositifs rechargeables en oxygène (par exemple, βAir): un réservoir interne est rempli quotidiennement d'oxygène; des essais précliniques et des essais cliniques préliminaires ont été réalisés. Cela fonctionne, mais cela demande beaucoup de travail au patient.
- Des donneurs chimiques d'O₂ et des matériaux « transporteurs » (composés perfluorés) ont été testés: ils sont efficaces, mais leur effet est court et difficile à contrôler. Des cadres « à air » permettant d'accélérer l'apport d'O₂ dans l'épaisseur du gel sont également apparus.
- Les capsules elles-mêmes et les sites d'implantation (membranes fines, prévascularisation) ont été améliorés, mais sans source externe d'O₂, ils se heurtent toujours aux limites de densité cellulaire.
- Quelle lacune dans l'énigme ces nouveaux travaux comblent-ils? Les auteurs de Nature Communications montrent un apport continu d'oxygène provenant d'un mini-générateur situé directement à l'intérieur du système de macroencapsulation: le dispositif prélève l'eau des tissus et libère électrochimiquement de l'O₂, qui « respire » uniformément le long de la capsule contenant les cellules. L'idée est de doter la capsule de son propre « compresseur d'aquarium » afin qu'elle puisse contenir davantage de cellules tout en les maintenant en vie et fonctionnelles, même dans un endroit sous-cutané peu « oxygéné ».
Pourquoi est-ce vraiment nécessaire?
La transplantation d'îlots ou de cellules bêta est l'une des pistes les plus prometteuses pour une « guérison fonctionnelle » du diabète de type 1. Cependant, deux obstacles majeurs se posent:
- Immunité – nécessite généralement des immunosuppresseurs à vie;
- Manque d'oxygène: les capsules qui protègent le système immunitaire isolent simultanément les cellules des vaisseaux, et les cellules bêta, gourmandes en O₂, « suffoquent ». Cette nouvelle technologie s'attaque au deuxième obstacle: elle fournit à la capsule sa propre source d'oxygène contrôlée.
Comment fonctionne l'implant
- Deux parties. Dans un boîtier en titane se trouve un mini-générateur d'oxygène (iEOG), qui extrait l'eau du liquide interstitiel et libère l'O₂ par électrolyse; à côté se trouve une fine capsule linéaire à cellules (semblable à une longue « saucisse »), traversée par un tube perméable aux gaz: l'oxygène est absorbé uniformément sur toute la capsule. Entre les cellules et les tissus se trouve une membrane semi-perméable (électrospin + alginate): le glucose et l'insuline la traversent, contrairement aux cellules immunitaires.
- Dimensions: La deuxième version de l'iEOG mesure 13 mm de diamètre et 3,1 mm d'épaisseur, pour un poids d'environ 2 g. Associé à une capsule, ce système peut être inséré et retiré par une petite incision, ce qui est important pour la sécurité.
- Productivité. Le générateur produit environ 1,9 à 2,3 cm³ d'O₂/h et maintient le débit spécifié pendant des mois, voire des années (jusqu'à 2,5 ans lors d'essais à long terme en solution saline). Après implantation chez le rat, ce niveau a été maintenu. Ce débit est calculé pour couvrir les besoins de centaines de milliers d'équivalents d'îlots, soit l'ordre de grandeur nécessaire à une personne.
Ce que les expériences ont montré
- In vitro: à 1 % d'O₂ (hypoxie sévère), l'oxygénation a maintenu la viabilité et la sécrétion dans les agrégats d'INS-1 et dans les îlots humains emballés dans une couche très dense (60 000 IEQ/mL).
- In vivo (rats). Après implantation sous-cutanée dans un modèle de diabète allogénique, le système iEOG a normalisé la glycémie jusqu'à 3 mois sans immunosuppression; les dispositifs sans oxygène n'ont eu aucun effet. L'histologie autour du générateur n'a montré aucun effet indésirable significatif.
Pourquoi est-ce important pour la clinique?
- Un pas vers des dimensions réalistes. Pour administrer à un adulte une dose de 300 000 à 770 000 IEQ, la capsule doit être bien compacte, ce qui a toujours été limité par l'oxygène. L'apport contrôlé d'O₂ supprime le plafond de densité et permet de rendre le dispositif suffisamment compact pour une implantation réelle.
- Plus pratique. Auparavant, nous avions essayé les donneurs d'oxygène chimiques (peroxydes) – ils sont peu efficaces et incontrôlables – ainsi que les réservoirs d'O₂ à remplissage quotidien par la peau – encombrants et peu pratiques. Ici, l'oxygène est fourni en continu et à doses mesurées, sans injection.
Des détails techniques qui impressionnent
- La source d'eau est le tissu. L'iEOG absorbe la vapeur du liquide interstitiel à travers une « fenêtre » poreuse, puis un assemblage membrane-électrode classique (MEA) et une tension de 1,4 à 1,8 V sont utilisés pour séparer l'eau en H₂ et O₂; les gaz sont éliminés par différents canaux.
- Durabilité. Trois dispositifs en solution saline ont fonctionné pendant 11 mois, 2 ans et 2,5 ans en courant continu sans dégradation par le flux d'oxygène; après implantation chez des rats immunodéficients et immunocompétents, les performances ont été maintenues.
Limites et « et ensuite »
C'est encore au stade préclinique: rats, haute densité dans la capsule, apport d'oxygène - tout va bien, mais des tests clés sont à venir:
- adaptation aux doses et aux délais humains;
- fiabilité et alimentation électrique des électrochimistes du corps humain depuis des années (l'architecture d'alimentation électrique n'est pas détaillée dans l'article);
- minimisation de la fibrose autour des capsules et stabilité de la diffusion;
- Tests sur des cellules souches bêta et sur des modèles plus proches de l'humain. Les auteurs comparent ouvertement leur solution aux approches précédentes et la positionnent comme une plateforme pour des capsules cliniquement traduisibles.
Conclusion
Pour que les cellules bêta transplantées puissent vivre et fonctionner sans immunosuppresseurs, elles ont besoin de respirer. L'équipe de Cornell et de ses partenaires a montré qu'un mini-générateur d'oxygène intégré à une capsule linéaire peut « alimenter » les cellules en O₂ suffisamment longtemps et uniformément pour qu'elles puissent supporter une densité élevée et réduire leur glycémie, même en localisation sous-cutanée. La clinique est encore loin d'être achevée, mais la logique d'ingénierie est simple et efficace: fournir de l'air aux cellules là où il en manque.
