Nouvelles publications
Les dérivés de la thalidomide entraînent la mort de cellules cancéreuses résistantes
Dernière revue: 14.06.2024

Tout le contenu iLive fait l'objet d'un examen médical ou d'une vérification des faits pour assurer autant que possible l'exactitude factuelle.
Nous appliquons des directives strictes en matière d’approvisionnement et ne proposons que des liens vers des sites de médias réputés, des instituts de recherche universitaires et, dans la mesure du possible, des études évaluées par des pairs sur le plan médical. Notez que les nombres entre parenthèses ([1], [2], etc.) sont des liens cliquables vers ces études.
Si vous estimez qu'un contenu quelconque de notre contenu est inexact, obsolète ou discutable, veuillez le sélectionner et appuyer sur Ctrl + Entrée.
Une étude menée par l'Université Goethe de Francfort souligne la possibilité que les dérivés de la thalidomide soient potentiellement adaptés au traitement du cancer. Dans les années 1950, la thalidomide était vendue comme somnifère. Plus tard, il est devenu connu pour provoquer de graves malformations chez le fœtus au début de la grossesse.
La molécule est également connue pour marquer les protéines de la cellule en vue de leur destruction. Dans le cadre des recherches en cours, les scientifiques ont créé des dérivés de la thalidomide. Ils ont pu montrer que ces substances affectent la destruction des protéines responsables de la survie des cellules cancéreuses.
Peut-être qu'aucune autre molécule n'a un passé aussi mouvementé que la thalidomide. C'était le composant principal d'un médicament approuvé dans de nombreux pays dans les années 1950 comme sédatif-hypnotique. Cependant, il est vite devenu évident que les femmes enceintes prenant de la thalidomide donnaient souvent naissance à des enfants présentant de graves malformations.
Cependant, au cours des dernières décennies, la médecine a de nouveau placé de grands espoirs en elle. Des recherches ont montré, entre autres, qu'il inhibe la croissance des vaisseaux sanguins et qu'il est donc potentiellement adapté pour couper les tumeurs de leur milieu nutritif. Ensuite, il s'est également révélé très efficace dans le traitement du myélome multiple, des tumeurs malignes de la moelle osseuse.
« Nous savons désormais que la thalidomide peut être qualifiée de « colle moléculaire » », explique le Dr Xinglai Cheng de l'Institut de chimie pharmaceutique de l'Université Goethe de Francfort. "Cela signifie qu'il est capable de saisir deux protéines et de les joindre."
Ceci est particulièrement intéressant car l'une de ces protéines est une sorte de « machine à étiqueter » : elle attache une étiquette « TRASH » sans ambiguïté à une autre protéine.
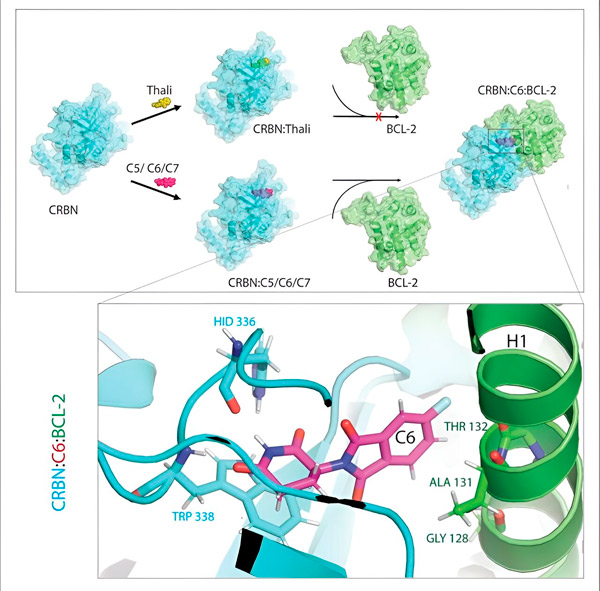
Les dérivés de la thalidomide C5, C6 et C7 modifient le CRBN, la « machine à étiqueter », afin qu'il puisse se lier au BCL-2. Ainsi, la molécule BCL-2 est marquée pour la dégradation, une nouvelle stratégie possible pour lutter contre le cancer. Auteur : Dr Xinglai Cheng
Le système d'élimination des déchets de la cellule reconnaît cette étiquette : il saisit la molécule de protéine marquée et la déchiquete. "C'est ce mécanisme qui explique les différents effets de la thalidomide", explique Cheng. "En fonction de la protéine marquée, cela peut entraîner des déformations au cours du développement embryonnaire ou la destruction de cellules malignes."
Ce mécanisme est très prometteur sur le plan médical, car les cellules cancéreuses dépendent de certaines protéines pour survivre. S’ils pouvaient être systématiquement ciblés et déchiquetés, la maladie pourrait être guérie. Le problème est que la colle moléculaire est assez particulière.
L'un de ses partenaires de liaison est toujours une machine de marquage cellulaire, ou dans le langage scientifique, une ligase E3 appelée CRBN. Seules quelques-unes des milliers de protéines présentes dans le corps peuvent être un deuxième partenaire - lesquelles dépendent de la colle.
"Nous avons donc créé une série de dérivés de la thalidomide", explique Cheng. "Nous avons ensuite étudié s'ils avaient des propriétés adhésives et, si oui, contre quelles protéines ils étaient efficaces." Pour ce faire, les chercheurs ont ajouté leurs dérivés à toutes les protéines de la lignée cellulaire cultivée. Ils ont ensuite observé laquelle de ces protéines se dégradait ensuite en présence de CRBN.
"Au cours du processus, nous avons identifié trois dérivés susceptibles de marquer une protéine cellulaire très importante pour la dégradation, BCL-2", explique Cheng. "BCL-2 empêche les cellules d'activer leur programme d'autodestruction, donc s'il manque, les cellules meurent."
BCL-2 est donc depuis longtemps au centre de la recherche sur le cancer. Il existe même déjà un médicament contre la leucémie appelé vénétoclax, qui réduit l'efficacité du BCL-2 et provoque ainsi l'autodestruction des cellules mutées.
"Cependant, dans de nombreuses cellules cancéreuses, BCL-2 lui-même est muté. En conséquence, le vénétoclax n'inhibe plus la protéine", explique Cheng. "Nous avons pu montrer que nos dérivés marquent également cette forme mutée pour la dégradation. De plus, nos partenaires de l'Institut Max Planck de biophysique ont simulé l'interaction des dérivés de la thalidomide avec BCL-2 sur ordinateur. Cela a montré que les dérivés se lient à des sites complètement différents de ceux du vénétoclax - un résultat que nous avons ensuite pu confirmer expérimentalement."
De plus, les chercheurs ont testé leurs substances sur des mouches des fruits contenant des cellules cancéreuses. Le taux de survie des mouches ainsi traitées était significativement plus élevé. Cependant, Cheng met en garde contre toute excitation excessive, car ces résultats relèvent encore de la recherche fondamentale. "Bien qu'ils montrent que les molécules modifiées de thalidomide ont un grand potentiel thérapeutique, nous ne pouvons pas encore dire si elles feront leurs preuves dans la pratique à un moment donné."
Les résultats de l'étude ont été publiés dans la journal Cell Reports Physical Science.
