Nouvelles publications
L'étude souligne la nécessité de mettre au point des thérapies spécifiques au type de cellules pour lutter contre le VIH.
Dernière revue: 02.07.2025

Tout le contenu iLive fait l'objet d'un examen médical ou d'une vérification des faits pour assurer autant que possible l'exactitude factuelle.
Nous appliquons des directives strictes en matière d’approvisionnement et ne proposons que des liens vers des sites de médias réputés, des instituts de recherche universitaires et, dans la mesure du possible, des études évaluées par des pairs sur le plan médical. Notez que les nombres entre parenthèses ([1], [2], etc.) sont des liens cliquables vers ces études.
Si vous estimez qu'un contenu quelconque de notre contenu est inexact, obsolète ou discutable, veuillez le sélectionner et appuyer sur Ctrl + Entrée.
Des chercheurs de l'Université de l'Illinois ont démontré l'importance de cibler des types cellulaires spécifiques dans le traitement du VIH. Leur étude, publiée dans la revue Proceedings of the National Academy of Sciences, est l'une des premières à examiner les effets différentiels ou spécifiques à chaque type cellulaire de la modulation de la latence du VIH sur les cellules myéloïdes, un type de cellules immunitaires produites dans la moelle osseuse.
L'un des principaux obstacles à l'élimination de l'infection par le VIH est la gestion de la latence, c'est-à-dire la période pendant laquelle une cellule infectée reste dormante et ne peut produire de virus. Les cellules latentes du VIH s'accumulent dans l'organisme dans des endroits appelés réservoirs. Ces réservoirs latents sont problématiques car ils peuvent commencer à produire du virus à tout moment.
L'éradication complète de la maladie nécessiterait l'élimination de toutes les cellules latentes de l'organisme ou une résistance permanente aux stimuli d'activation. Cependant, la réactivation peut être déclenchée par divers facteurs, notamment les signaux qui dirigent la différenciation des cellules myéloïdes.
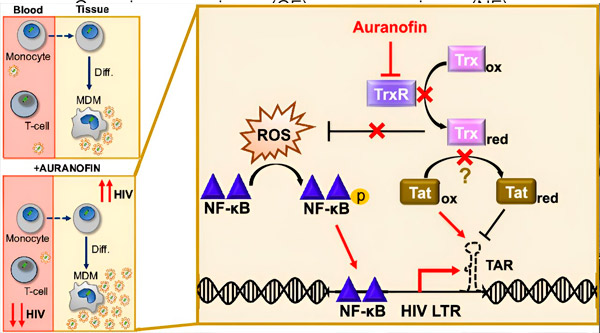
La régulation de la latence du VIH dans les macrophages dérivés des monocytes (MDM) pourrait présenter un risque pour la dissémination virale. La différenciation des monocytes en macrophages peut déclencher une réactivation du VIH, favorisant potentiellement la dissémination virale dans les tissus (en haut à gauche). Un candidat clinique, l'Auranofin, réduit l'ADN viral dans le sang et favorise la latence du VIH dans les lymphocytes T et les monocytes, mais provoque une réactivation du VIH dans les MDM (en bas à gauche). Dans les MDM, nous émettons l'hypothèse que l'inhibition de TrxR par l'Auranofin entraîne une accumulation d'espèces réactives de l'oxygène (ERO), ce qui induit l'activation de NF-κB et du promoteur LTR du VIH (à droite). L'inhibition de TrxR pourrait réduire la réduction du substrat, permettant à la protéine Tat de rester préférentiellement oxydée, où elle peut se lier à TAR et initier la transcription du VIH. Source: Proceedings of the National Academy of Sciences (2024). DOI: 10.1073/pnas.2313823121
Depuis des années, la recherche sur le traitement du VIH s'articule autour de deux approches: « choc et élimination » et « blocage et verrouillage ». La première, combinée à un traitement antirétroviral, active les cellules infectées latentes et les détruit par apoptose, ou mort cellulaire programmée, tandis que la seconde force les cellules infectées à entrer dans un état de latence profond, d'où elles ne peuvent plus se réactiver d'elles-mêmes.
La recherche autour de ces techniques s'est traditionnellement concentrée sur un type de globules blancs appelés lymphocytes T, principale cible de l'infection par le VIH. Cependant, les réservoirs latents ne se limitent pas aux lymphocytes T; ils contiennent en réalité des dizaines de types cellulaires différents, chacun présentant ses propres profils d'expression des gènes du VIH.
« Il existe une grande diversité de cellules, même au sein d'une même lignée », a déclaré Collin Kieffer, professeur adjoint de microbiologie et auteur de l'article. « La variabilité de la réponse dans ces réservoirs augmente avec chaque nouveau type cellulaire. »
Alexandra Blanco, étudiante diplômée du laboratoire de Kieffer, souhaitait étudier des types de cellules jusque-là ignorés par la recherche traditionnelle sur le VIH. En se concentrant sur les cellules myéloïdes, elle a créé une banque de clones contenant 70 populations de monocytes infectés de manière latente. Blanco a ensuite analysé les populations clonales et leurs réponses à l'activation. Ces réponses variaient considérablement, soulignant la grande diversité au sein d'un même type cellulaire.
Cette observation a soulevé une nouvelle question: les différents types de cellules réagissent-ils réellement différemment aux traitements de latence du VIH? En effet, leurs résultats ont montré que certains traitements de latence du VIH peuvent favoriser la latence des lymphocytes T et des monocytes, tout en inversant celle des macrophages.
« Toutes les cellules du corps ne sont pas identiques », a expliqué Kieffer. « Il est donc logique que toutes les cellules infectées ne réagissent pas de la même manière au virus. »
Leur article souligne la nécessité pour les futurs traitements contre le VIH de prendre en compte tous les types de cellules et la manière dont chaque cellule pourrait répondre aux thérapies potentielles.
Leurs conclusions s’appuient sur les recherches de Roy Dar, un ancien professeur de bio-ingénierie de l’Illinois dont le laboratoire a étudié l’hétérogénéité de l’expression des gènes du VIH.
« Il a lancé le projet, et nous l'avons repris et développé jusqu'à ce qu'il soit là où il est aujourd'hui », a déclaré Kieffer. « Cette collaboration a véritablement donné naissance à ces résultats. Elle a ouvert une nouvelle voie pour notre laboratoire, et nous en sommes très enthousiastes. »
Une découverte supplémentaire et inattendue issue de l'analyse de Blanco a révélé des modifications de la taille et de la forme des cellules en réponse à l'infection, suggérant que le VIH peut altérer la morphologie cellulaire. Le prochain objectif de Blanco est d'identifier les mécanismes biologiques sous-jacents à ces changements phénotypiques.
Kieffer et les membres de son laboratoire sont également impatients de reproduire leurs résultats, principalement obtenus sur une lignée cellulaire, sur des cellules primaires. Reproduire ces résultats dans un modèle plus proche de l'humain améliorerait la pertinence clinique de l'étude, a expliqué Kieffer.
« Nous aimerions effectuer des criblages plus larges sur les lymphocytes T, les monocytes et les macrophages afin d'identifier des médicaments potentiels susceptibles d'agir sur tous ces types de cellules », a déclaré Blanco. « Nous pourrions découvrir encore plus de molécules dont le comportement n'est pas spécifique à chaque type de cellule. »
