Nouvelles publications
La mutation du gène ARID1A rend les tumeurs sensibles à l'immunothérapie
Dernière revue: 02.07.2025

Tout le contenu iLive fait l'objet d'un examen médical ou d'une vérification des faits pour assurer autant que possible l'exactitude factuelle.
Nous appliquons des directives strictes en matière d’approvisionnement et ne proposons que des liens vers des sites de médias réputés, des instituts de recherche universitaires et, dans la mesure du possible, des études évaluées par des pairs sur le plan médical. Notez que les nombres entre parenthèses ([1], [2], etc.) sont des liens cliquables vers ces études.
Si vous estimez qu'un contenu quelconque de notre contenu est inexact, obsolète ou discutable, veuillez le sélectionner et appuyer sur Ctrl + Entrée.
L'immunothérapie a révolutionné le traitement du cancer ces dernières années. Au lieu de cibler directement les tumeurs, elle oriente le système immunitaire des patients vers une attaque plus efficace. Cette approche est particulièrement efficace pour certains cancers difficiles à traiter. Cependant, moins de la moitié des patients atteints de cancer répondent aux immunothérapies actuelles, d'où l'urgente nécessité d'identifier des biomarqueurs permettant de prédire quels patients sont les plus susceptibles de bénéficier du traitement.
Récemment, des scientifiques ont remarqué que les patients dont les tumeurs présentent une mutation dans le gène ARID1A sont plus susceptibles de répondre positivement au blocage du point de contrôle immunitaire, un type d’ immunothérapie qui agit en maintenant activées les cellules immunitaires qui combattent le cancer.
Étant donné que la mutation du gène ARID1A est présente dans de nombreux cancers, notamment les cancers de l’endomètre, de l’ovaire, colorectal, gastrique, du foie et du pancréas, les chercheurs du Salk Institute se sont demandés comment elle pourrait contribuer à la sensibilité au traitement et comment les cliniciens pourraient utiliser ces informations pour personnaliser le traitement du cancer pour chaque patient.
Leur nouvelle étude, publiée dans la revue Cell, montre que la mutation ARID1A rend les tumeurs sensibles à l'immunothérapie en recrutant des cellules immunitaires anticancéreuses dans la tumeur grâce à une réponse immunitaire de type antiviral.
Les chercheurs suggèrent que cette mutation et la réponse immunitaire antivirale pourraient servir de biomarqueur pour mieux sélectionner les patients susceptibles de bénéficier d'immunothérapies spécifiques, comme le blocage des points de contrôle immunitaires. Ces résultats encouragent également le développement de médicaments ciblant ARID1A et les protéines apparentées afin de rendre d'autres tumeurs plus sensibles à l'immunothérapie.
« Cela pourrait véritablement changer l'issue du traitement du cancer pour les patients », a déclaré Diana Hargreaves, professeure agrégée et auteure principale de l'étude. « Les patients porteurs de la mutation ARID1A présentent déjà une réponse immunitaire. Il nous suffit donc de stimuler cette réponse en bloquant les points de contrôle immunitaires pour les aider à détruire leurs tumeurs de l'intérieur. »
Bien que l'on sache que les personnes porteuses de mutations ARID1A réagissent bien au blocage des points de contrôle immunitaires, le lien exact entre les deux restait flou. Pour éclaircir ce mécanisme, des scientifiques du Salk Institute ont utilisé des modèles murins de mélanome et de cancer colorectal porteurs à la fois de la mutation ARID1A et de la mutation ARID1A fonctionnelle.
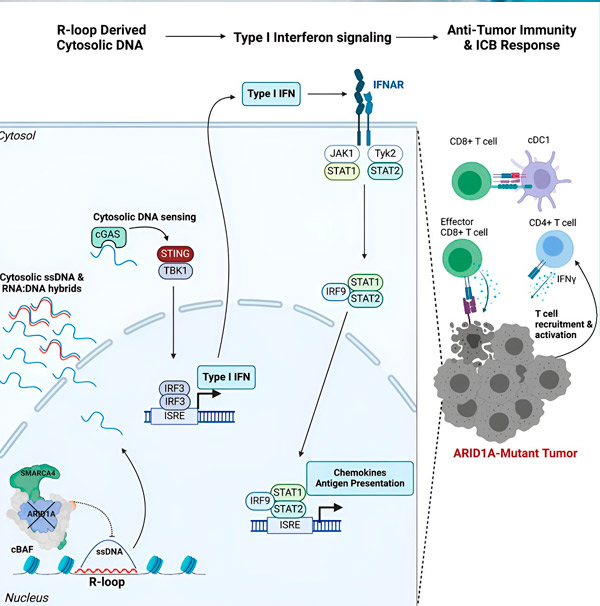
Source: Cell (2024). DOI: 10.1016/j.cell.2024.04.025
L'équipe a observé une réponse immunitaire robuste dans tous les modèles porteurs de la mutation ARID1A, mais pas dans ceux où ARID1A était fonctionnel, ce qui étaye l'hypothèse selon laquelle la mutation ARID1A est bel et bien à l'origine de cette réponse. Mais comment cela fonctionne-t-il au niveau moléculaire?
« Nous avons découvert qu'ARID1A joue un rôle important dans le noyau en maintenant une organisation correcte de l'ADN », explique Matthew Maxwell, premier auteur de l'étude et étudiant diplômé au laboratoire Hargreaves. « Sans ARID1A fonctionnel, l'ADN libre peut être excisé et libéré dans le cytosol, activant ainsi une réponse immunitaire antivirale bénéfique, qui peut être renforcée par le blocage des points de contrôle immunitaires. »
Le gène ARID1A code pour une protéine qui contribue à réguler la forme de notre ADN et à maintenir la stabilité du génome. Lorsqu'ARID1A mute, il déclenche une chaîne d'événements de type Rube Goldberg dans les cellules cancéreuses.
Premièrement, l'absence d'ARID1A fonctionnel entraîne la libération d'ADN dans le cytosol. L'ADN cytosolique active alors un système d'alarme antiviral, la voie cGAS-STING, car nos cellules sont adaptées pour marquer tout ADN présent dans le cytosol comme étranger afin de se protéger des infections virales. Enfin, la voie cGAS-STING incite le système immunitaire à recruter des lymphocytes T dans la tumeur et à les activer en lymphocytes T tueurs spécialisés dans le cancer.
À chaque étape, en fonction de la précédente, cette chaîne d'événements – mutation du gène ARID1A, échappement de l'ADN, alarme cGAS-STING, recrutement des lymphocytes T – entraîne une augmentation du nombre de lymphocytes T anticancéreux dans la tumeur. Le blocage des points de contrôle immunitaires permet alors de garantir que ces lymphocytes T restent activés, renforçant ainsi leur capacité à vaincre le cancer.
« Nos résultats fournissent un nouveau mécanisme moléculaire par lequel une mutation d'ARID1A pourrait contribuer à une réponse immunitaire antitumorale », explique Hargreaves. « Ce qui est passionnant dans ces résultats, c'est leur potentiel translationnel. Nous pouvons utiliser les mutations d'ARID1A pour sélectionner les patients devant bénéficier d'un blocage des points de contrôle immunitaire, et nous découvrons maintenant un mécanisme par lequel les médicaments inhibant ARID1A ou son complexe protéique pourraient être utilisés pour améliorer l'immunothérapie chez d'autres patients. »
En décrivant le mécanisme par lequel le blocage des points de contrôle immunitaires est plus efficace dans les cancers porteurs d'une mutation du gène ARID1A, les chercheurs justifient la priorité accordée à cette immunothérapie chez les patients porteurs d'une mutation du gène ARID1A. Ces résultats constituent une étape importante vers la personnalisation du traitement du cancer et inspirent le développement de nouvelles thérapies ciblant le gène ARID1A et son complexe protéique.
À l’avenir, l’équipe du Salk Institute espère que ses résultats amélioreront les résultats du traitement des patients atteints de divers types de cancer associés aux mutations ARID1A, et a l’intention d’explorer cette traduction clinique en collaboration avec l’Université de Californie à San Diego.
