Nouvelles publications
Clarification des mécanismes cellulaires de la parodontite grâce à un modèle animal amélioré
Dernière revue: 14.06.2024

Tout le contenu iLive fait l'objet d'un examen médical ou d'une vérification des faits pour assurer autant que possible l'exactitude factuelle.
Nous appliquons des directives strictes en matière d’approvisionnement et ne proposons que des liens vers des sites de médias réputés, des instituts de recherche universitaires et, dans la mesure du possible, des études évaluées par des pairs sur le plan médical. Notez que les nombres entre parenthèses ([1], [2], etc.) sont des liens cliquables vers ces études.
Si vous estimez qu'un contenu quelconque de notre contenu est inexact, obsolète ou discutable, veuillez le sélectionner et appuyer sur Ctrl + Entrée.
Des chercheurs de l'Université médicale et dentaire de Tokyo (TMDU) ont développé une technique qui leur permet d'analyser en détail l'évolution de la parodontite au fil du temps.
Les maladies parodontales, représentées par la parodontite, sont la principale cause de perte de dents et touchent près d'un adulte sur cinq dans le monde. Dans la plupart des cas, cette affection résulte d'une réponse inflammatoire à une infection bactérienne des tissus autour des dents.
À mesure que la situation s'aggrave, les gencives commencent à reculer, exposant les racines des dents et des os. Notamment, l'incidence de la parodontite augmente avec l'âge, et à mesure que l'espérance de vie des populations du monde entier augmente, il est important d'avoir une solide compréhension de ses causes sous-jacentes et de sa progression.
Dans une étude publiée dans Nature Communications, les chercheurs du TMDU ont trouvé un moyen d'atteindre cet objectif en améliorant un modèle animal largement utilisé pour étudier la parodontite.
L'étude directe de la parodontite chez l'homme est difficile. En conséquence, les scientifiques se tournent souvent vers des modèles animaux pour leurs recherches précliniques. Par exemple, le « modèle de parodontite induite par ligature chez la souris » permet, depuis son introduction en 2012, aux chercheurs d'étudier les mécanismes cellulaires à l'origine de cette maladie.
En termes simples, dans ce modèle, la maladie parodontale est induite artificiellement en plaçant des sutures de soie sur les molaires de souris, ce qui provoque une accumulation de plaque dentaire. Bien que cette méthode soit pratique et efficace, elle ne couvre pas le tableau complet de la parodontite.
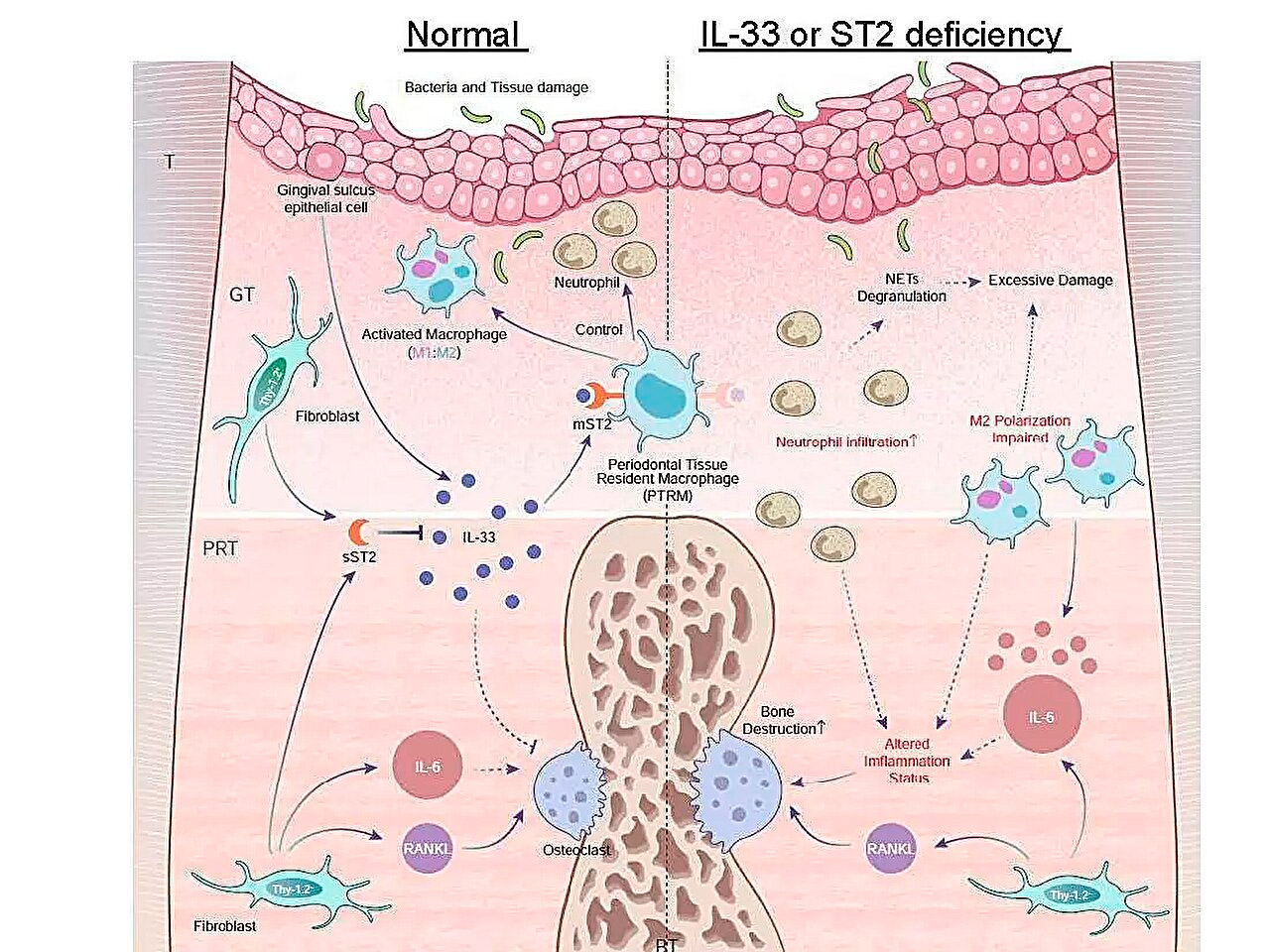
Illustration schématique des profils d'expression des gènes inflammatoires au cours de la parodontite et du rôle de l'axe IL-33/ST2 dans le contrôle de l'inflammation aiguë. Source : Université médicale et dentaire de Tokyo.
« Bien que le tissu parodontal soit composé de gencive, de ligament parodontal, d'os alvéolaire et de cément, l'analyse est généralement effectuée exclusivement sur des échantillons gingivaux en raison de limitations techniques et quantitatives », note l'auteur principal de l'étude, Anhao Liu. "Cette stratégie d'échantillonnage limite les conclusions qui peuvent être tirées de ces études. Des méthodes sont donc nécessaires pour analyser simultanément tous les composants tissulaires."
Pour remédier à cette limitation, l'équipe de recherche a développé un modèle modifié de parodontite induite par la ligature. Au lieu de la ligature simple classique, ils ont utilisé une triple ligature sur la molaire supérieure gauche des souris mâles. Cette stratégie a élargi la zone de perte osseuse sans destruction osseuse significative autour de la deuxième molaire, augmentant ainsi le nombre de types différents de tissu parodontal.
"Nous avons isolé trois principaux types de tissus et évalué le rendement en ARN entre les deux modèles. Les résultats ont montré que le modèle à triple ligature augmentait efficacement le rendement, atteignant quatre fois la quantité de tissu périradiculaire normal et prenant en charge l'analyse haute résolution de différents types de tissus. ", explique Sr. Par le Dr Mikihito Hayashi.
Après avoir confirmé l'efficacité de leur modèle modifié, les chercheurs ont commencé à étudier les effets de la parodontite sur l'expression des gènes parmi différents types de tissus au fil du temps, en se concentrant sur les gènes associés à l'inflammation et à la différenciation des ostéoclastes.
L'une de leurs principales découvertes était que l'expression du gène Il1rl1 était significativement plus élevée dans le tissu périradiculaire cinq jours après la ligature. Ce gène code pour la protéine ST2 dans les isoformes du récepteur et du leurre, qui se lie à une cytokine appelée IL-33, impliquée dans les processus inflammatoires et immunorégulateurs.
Pour mieux comprendre le rôle de ce gène, l'équipe a induit une parodontite chez des souris génétiquement modifiées dépourvues des gènes Il1rl1 ou Il33. Ces souris ont démontré une destruction osseuse inflammatoire accélérée, mettant en évidence le rôle protecteur de la voie IL-33/ST2. Une analyse plus approfondie des cellules contenant la protéine ST2 sous sa forme réceptrice, mST2, a montré que la majorité d'entre elles provenaient de macrophages.
"Les macrophages sont généralement classés en deux types principaux, pro-inflammatoires et anti-inflammatoires, en fonction de leur activation. Nous avons constaté que les cellules exprimant mST2 sont uniques dans le sens où elles expriment simultanément certains marqueurs des deux types de macrophages", commente auteur principal, Dr Takanori Iwata. "Ces cellules étaient présentes dans le tissu périradiculaire avant le début de l'inflammation, c'est pourquoi nous les appelions des « macrophages parodontaux résidents ». »
Ensemble, les résultats de cette étude démontrent la puissance du modèle animal modifié pour étudier la parodontite à une échelle plus détaillée, jusqu'au niveau biomoléculaire.
"Nous proposons la possibilité d'une nouvelle voie moléculaire, l'IL-33/ST2, régulant l'inflammation et la destruction osseuse dans les maladies parodontales, ainsi que de macrophages spécifiques dans le tissu périradiculaire, qui est profondément impliqué dans la maladie parodontale. Nous espérons que cela mènera au développement de nouvelles stratégies de traitement et méthodes de prévention », conclut l'auteur principal, le Dr Tomoki Nakashima.
