Nouvelles publications
Des scientifiques ont créé un composé "caméléon" pour traiter les cancers du cerveau résistants aux médicaments
Dernière revue: 02.07.2025

Tout le contenu iLive fait l'objet d'un examen médical ou d'une vérification des faits pour assurer autant que possible l'exactitude factuelle.
Nous appliquons des directives strictes en matière d’approvisionnement et ne proposons que des liens vers des sites de médias réputés, des instituts de recherche universitaires et, dans la mesure du possible, des études évaluées par des pairs sur le plan médical. Notez que les nombres entre parenthèses ([1], [2], etc.) sont des liens cliquables vers ces études.
Si vous estimez qu'un contenu quelconque de notre contenu est inexact, obsolète ou discutable, veuillez le sélectionner et appuyer sur Ctrl + Entrée.
Une nouvelle étude menée par des scientifiques de l’Université Yale décrit comment un nouveau composé chimique attaque les tumeurs cérébrales résistantes aux médicaments sans endommager les tissus sains environnants.
L'étude, publiée dans le Journal of the American Chemical Society, constitue une étape importante dans le développement de ce que l'on appelle des « composés caméléons » qui pourraient être utilisés pour lutter contre une série de cancers dangereux.
Les gliomes se développent chez environ 6,6 personnes sur 100 000 chaque année et chez 2,94 personnes sur 100 000 avant l'âge de 14 ans. En excluant les métastases d'autres cancers qui atteignent le système nerveux central, les gliomes représentent 26 % de toutes les tumeurs cérébrales (tumeurs cérébrales primaires) et 81 % de toutes les tumeurs cérébrales malignes.
Depuis des décennies, les patients atteints de glioblastome sont traités par un médicament appelé témozolomide. Cependant, la plupart des patients développent une résistance au témozolomide en moins d'un an. Le taux de survie à cinq ans des patients atteints de glioblastome est inférieur à 5 %.
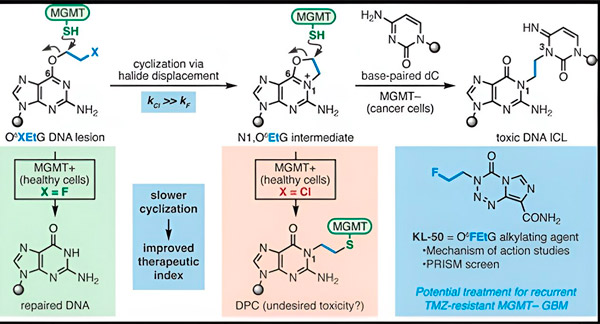
En 2022, le chimiste Seth Herzon de Yale et le radio-oncologue Dr Ranjit Bindra ont développé une nouvelle stratégie pour traiter plus efficacement les glioblastomes. Ils ont créé une classe de molécules anticancéreuses, appelées composés caméléon, qui exploitent un défaut d'une protéine de réparation de l'ADN appelée O6-méthylguanine ADN méthyltransférase (MGMT).
De nombreuses cellules cancéreuses, dont les glioblastomes, sont dépourvues de la protéine MGMT. De nouveaux composés caméléons sont conçus pour endommager l'ADN des cellules tumorales dépourvues de MGMT.
Les composés caméléons initient des lésions à l'ADN en y déposant des lésions primaires qui évoluent progressivement vers des lésions secondaires hautement toxiques appelées réticulations interbrins. MGMT protège l'ADN des tissus sains en réparant les lésions primaires avant qu'elles ne se transforment en réticulations interbrins mortelles.
Pour leur nouvelle étude, les co-auteurs Herzon et Bindra se sont concentrés sur leur caméléon principal, le KL-50.
« Nous avons utilisé une combinaison de chimie synthétique et d'études de biologie moléculaire pour élucider les bases moléculaires de nos observations précédentes, ainsi que la cinétique chimique qui confère à ces composés leur sélectivité unique », a déclaré Herzon, professeur de chimie Milton Harris à Yale. « Nous démontrons que le KL-50 est unique en ce sens qu'il forme des liaisons croisées de l'ADN uniquement dans les tumeurs dont la réparation de l'ADN est défectueuse. Il épargne les tissus sains. »
Source: Journal of the American Chemical Society (2024). DOI: 10.1021/jacs.3c06483
Il s'agit d'une différence significative, soulignent les chercheurs. Plusieurs autres composés anticancéreux ont été conçus pour déclencher des liaisons croisées entre brins, mais ils ne sont pas sélectifs pour les cellules tumorales, ce qui limite leur utilité.
Le secret du succès du KL-50 réside dans son timing d'action, ont souligné les chercheurs. Le KL-50 forme des liaisons interbrins plus lentement que les autres agents de réticulation. Ce délai donne aux cellules saines suffisamment de temps pour utiliser la MGMT afin d'empêcher la formation de liaisons.
« Ce profil unique suggère son potentiel pour le traitement du glioblastome pharmacorésistant, un domaine où les besoins cliniques sont importants », a déclaré Bindra, professeur Harvey et Kate Cushing de radiologie thérapeutique à la faculté de médecine de Yale. Bindra est également directeur scientifique du Centre des tumeurs cérébrales de la famille Chenevert à l'hôpital Smilo.
Herzon et Bindra ont déclaré que leur étude souligne l'importance de prendre en compte les taux de modification chimique et de réparation biochimique de l'ADN. Ils pensent pouvoir utiliser cette stratégie pour développer des traitements contre d'autres cancers présentant des défauts spécifiques de réparation de l'ADN associés aux tumeurs.
